生后早期大鼠初级视皮层Ⅰ层中间神经元电学特性研究
许兴哲 李延海 ,2,3
1生物医学信息工程教育部重点实验室,西安交通大学生命科学与技术学院,健康与康复科学研究所(西安 710049)
2国家医疗保健器具工程技术研究中心(广州 510500)
3神经功能信息学与康复工程民政部重点实验室(西安 710049)
大脑新皮层(neocortex)结构被认为与脑的高级认知功能如学习、记忆、注意、思维等息息相关,其相关神经机制研究已受到广泛关注。哺乳动物大脑新皮层具有典型的六层结构,不同层具有不同的细胞构筑、纤维联系和生理功能。新皮层的Ⅰ层位于皮层的表面,软脑膜下方,其神经元密度远低于Ⅱ~Ⅵ层[1]。研究发现,枕叶初级视皮层(V1)单眼区域(Oc1M区)面积1 mm2的神经元柱平均含有71600个神经元,其中Ⅰ层神经元的数量仅为600,并且Ⅰ层中几乎不含有锥体神经元,这使得对Ⅰ层神经元特性及功能的研究变得十分困难[2,3]。然而新皮层Ⅰ层是树突和轴突十分密集的区域,这表明Ⅰ层神经元可以接受大量的信号传入。实验发现,初级视皮层(V1)区域的Ⅰ层神经元可以接受来自初级听皮层和前额叶扣带回等多个脑区的信号传入[4,5]。同时,V1的Ⅰ层神经元能够通过一种自上而下的调节方式对Ⅱ/Ⅲ层或更深层的神经元进行调制,这种调制作用能够影响同一神经元柱或多个临近的神经元柱[6]。由此可见,Ⅰ层神经元在神经网络功能的实现中有着极为重要的信息调制作用。事实上,Ⅰ层所有神经元都是中间神经元,且多为GABA(γ-氨基丁酸)能抑制性神经元,其功能是在皮层内形成局部抑制回路,调制神经信息传递[7]。已有实验证实,Ⅰ层抑制性神经元能够通过抑制Ⅱ/Ⅲ层的抑制性神经元而形成去抑制效果来特异性增强锥体神经元的运动方向选择性[8]。此外,实验还发现Ⅰ层中间神经元之间存在化学性突触和电突触共存的现象,相同类型的Ⅰ层神经元之间普遍存在电耦合现象,这与大脑的注意功能和认知活动密切相关[9]。虽然此前已有研究提出Ⅰ层神经元从形态上分为单束细胞(single bouquet cells,SBCs)和细长的神经胶质样细胞(elongated neurogliaform cells,ENGCs)两大类[10,11],但是到目前为止,尚未见视觉发育可塑性关键期内Ⅰ层神经元电学特性及其分类的研究报道。本研究采用脑片膜片钳全细胞记录技术,在急性分离大鼠视皮层脑片标本上,探讨初级视皮层(Oc1M区)Ⅰ层中间神经元的被动和主动电学特性,以及动作电位(action potential,AP)的发放特征,并根据其电学特性进行分类,为进一步了解不同类型的Ⅰ层神经元功能及其在视觉信息处理中的作用提供背景性资料。
1 材料与方法
1.1 实验动物
本实验使用健康的SPF级雄性Sprague-Dawley大鼠30只,鼠龄为13~15天,由西安交通大学实验动物中心提供。
1.2 视皮层脑片制备与孵育
采用常规方法制备大鼠视皮层脑片标本,每只大鼠取单侧视皮层组织,制备2个脑片[12]。即大鼠乙醚麻醉后,迅速断头取脑置于冰冷(0~4℃)的、95%O2和5%CO2混合气饱和并持续通气的人工脑脊液(Artificial cerebro-spinal fluid,ACSF)中。ACSF离子成分及浓度 (mmol/L):NaCl 120,KCl 2,KH2PO41.2,MgCl2·6H2O 1.2,CaCl22.5,NaHCO326,Glucose 11(pH=7.4,渗透压为300~310 mOsm/kg·H2O)。对脑组织进行修块处理后,使用振动切片机(美国WPI公司,NVSLM1)对含有视皮层Oc1M区的脑组织块进行冠状切片,切成300 μm厚的脑片。将脑片置于O2/CO2混合气饱和的ACSF孵育槽中孵育,在31℃下孵育30 min后,转移到室温(23℃)孵育30 min以上备用。
1.3 视皮层脑片膜片钳全细胞记录
将孵育后的脑片移至灌流槽,并将U形盖网放置于脑片上方以防止脑片的移动。使用蠕动泵(美国WPI公司,PERIPRO-4LS)向灌流槽中持续灌流氧饱和的人工脑脊液,灌流速度为1.5~2.5 ml/min。使用直立式红外微分干涉相差显微镜(日本尼康公司,FN1)确定脑区和选择细胞,即在低倍物镜下(×5),参照大鼠脑立体定位图[13]找到大鼠视皮层Oc1M区Ⅰ层。然后切换到高倍浸水物镜(×40)下,观察Ⅰ层中间神经元的形态,寻找边界清楚、表面光滑且折光性强的细胞进行脑片膜片钳实验。使用玻璃微电极拉制仪(日本Narishige公司,PC-10)拉制记录电极,电极阻抗为3~6 MΩ。电极内液成分及其浓度(mmol/L):葡糖酸钾130,NaCl 5,MgCl22,CaCl20.1,EGTA 1,HEPES 10,Na2ATP 2,Na3GTP 0.25(pH=7.2,渗透压为280~290 mOsm/kg·H2O)。通过膜片钳放大器(美国Molecular Devices公司,700B)对膜电流或膜电位进行钳制。通过数模/模数转换器(美国Molecular Devices公司,1440A)进行采样,采样频率为10k Hz,低通滤波3k Hz。数据的采集使用美国Molecular Devices公司的pCLAMP 10.3软件。用于统计分析的实验数据标准为串联阻抗Ra小于25 MΩ,变化不大于10%,且动作电位幅值大于80 mV。
1.4 神经元电学特性测量
在全细胞模式下,稳定5 min后对神经元的被动和主动电学特性进行测量。在电压钳模式下,钳制细胞膜电位于-70 mV,通过pCLAMP软件提供的膜测试功能读取细胞膜电容(membrane capacitance,Cm)和膜时间常数(membrane time constant,Tau)等被动电学参数。对细胞施加步进的超极化电压刺激,测量细胞对电压响应的I-V曲线,并计算其输入阻抗(input resistance,Rin)。在电流钳模式下,将细胞电流钳制于0 pA,此时的膜电位即为静息电位(resting potential,Vres)。之后施加持续时间为1 ms去极化方波步进电流刺激,以诱导单个动作电位的发生,观察动作电位的波形、幅值、能够诱发细胞产生动作电位临界膜电位值的阈电位(threshold potentials,Vts)和动作电位后电位(after-potentials)等主动电学特性。神经元兴奋性的大小受阈电位(Vts)和静息电位(Vres)的影响,阈电位与静息电位之间的差值(Vts-Vres)记为神经元的能障,其含义表示神经元受到兴奋性刺激产生动作电位所需的去极化程度。最后向细胞注入持续时间为1 s步进的去极化方波电流刺激,诱发神经元连续发放动作电位,观察神经元动作电位的发放特征。
1.5 数据分析及统计学处理
实验记录到状态良好的Ⅰ层神经元共58例,其中后去极化神经元19例,后超极化神经元39例。共43例Ⅰ层神经元能够产生稳定的连续动作电位发放。使用Clampfit 10.3软件进行数据分析,采用SPSS软件进行统计分析。所有数据使用均数 ±标准误来表示,采用独立样本t检验进行组间数据比较,P<0.05表示具有显著性差异。
2 结果
2.1 大鼠初级视皮层Ⅰ层中间神经元的分类
在电流钳模式下,给予记录神经元持续时间为1 ms的单个去极化方波电流刺激,诱导神经元产生单个动作电位,结果发现,在视觉发育可塑性关键期内,初级视皮层Ⅰ层神经元后电位存在后去极化(after-depolarization,ADP)和后超极化(after-hyperpolarization,AHP)两种类型,后去极化的幅度能够达到15.11±3.02 mV;而后超极化的幅度为-6.22±0.53 mV。因此,根据动作电位的后电位不同将初级视皮层Ⅰ层神经元区分为后去级化神经元(after-depolarization neurons,ADPNs)和后超极化神经元(after-hyperpolarization neurons,AHPNs)两类(图 1A 和图 1B),其中ADPNs占初级视皮层Ⅰ层神经元的32.8%(n=19),而AHPNs占所有视皮层Ⅰ层神经元的67.2%(n=39,图1C)。
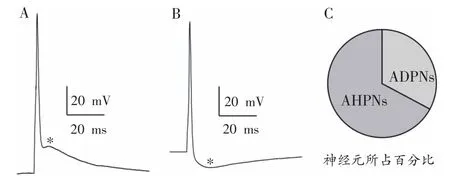
图1 两类Ⅰ层中间神经元的动作电位波形及其比例
2.2 两类Ⅰ层中间神经元的能障(energy b arrriieerr,VV ttss--VVrreess)比较
在电流钳模式下,测得ADPNs和AHPNs的静息电位分别为-61.84±0.79 mV与-55.40±1.00 mV,两者间存在显著性差异(P<0.05,图2A);ADPNs的阈电位为-32.02±1.94 mV,AHPNs的阈电位为-37.69± 0.88 mV,两者间亦存在显著性差异(P<0.05,图2B)。之后进一步比较两类细胞的能障,ADPNs的能障为29.80±2.07 mV,AHPNs的能障为17.10±1.14 mV,ADPNs与AHPNs能障相比具有显著性差异(P<0.05,图2C),上述实验结果表明,与AHPNs相比较,ADPNs具有较低的兴奋性和较高的能障,需要更强的去极化刺激才能诱发其产生动作电位。
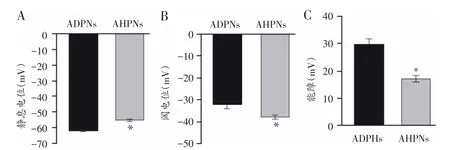
图2 两类Ⅰ层中间神经元的静息电位、阈电位和能障的比较
2.3 大鼠初级视皮层Ⅰ层中间神经元的其他电学特性
基于上述视皮层Ⅰ层中间神经元的分类,进一步统计这些神经元的其他电学特性参数(表1)。结果表明,ADPNs和AHPNs的动作电位幅值分别为97.67±1.48 mV与92.10±1.10 mV,两者间存在显著性差异(P<0.05)。而ADPN为-77.79 ± 3.94 mV/mS,AHPNs为-66.51±2.80 mV/mS,两者间亦存在显著性差异(P<0.05)。而其膜电容、时间常数、输入阻抗以及动作电位的最大上升斜率等参数均无显著性差异(P>0.05)。
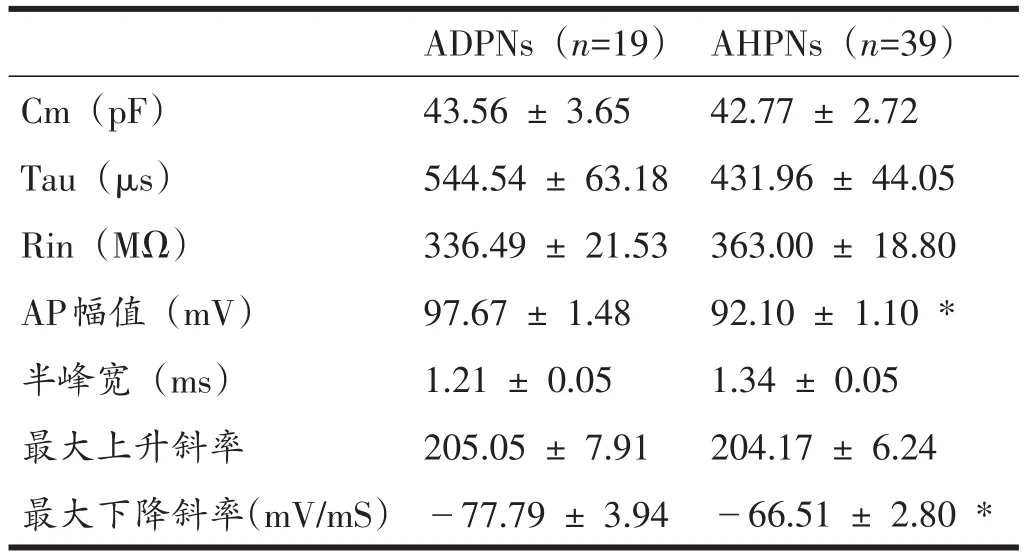
表1 ADPNs和AHPNs的电学特性
2.4 大鼠初级视皮层Ⅰ层两类中间神经元动作电位的发放特性
在电流钳模式下,向大鼠视皮层Ⅰ层中间神经元注入持续时间为1 s的去极化方波电流刺激,观察两类神经元动作电位的发放特性。结果发现,随着注入电流强度的增加,动作电位的发放频率逐渐增加。在注入60 pA去极化刺激条件下,ADPNs第12个动作电位的瞬时发放频率为24.38±2.20 Hz,AHPNs第12个动作电位的瞬时发放频率为25.11±1.17 Hz,两组间无显著性差异(P>0.05,n=43,图3A和3B)。随着两类神经元动作电位的连续发放,其动作电位发放均存在峰值的降低与半峰宽变大的现象,且两组间存在显著性差异(P<0.05,n=43,图3C和3D),进一步比较两类神经元第12个动作电位和第1个动作电位的幅值比和半峰宽比,结果显示ADPNs动作电位幅值比和半峰宽比分别为0.99±0.01和1.49±0.05,而AHPNs动作电位幅值比和半峰宽比分别为0.96±0.004和 1.32±0.02,两者均存在显著性差异(P<0.05,n=43,图3A和3B)。此外,ADPNs与AHPNs动作电位的发放频率也存在频率适应性现象[14],ADPNs与AHPNs第12个动作电位与第1个动作电位的瞬时频率比分别为0.65±0.04和0.87 ± 0.06(P<0.05,n=43,图3E)。
3 讨论
大脑皮层Ⅰ层位于皮层的表面,由低密度的神经元、神经胶质细胞、皮层锥体细胞的顶树突以及其它新皮层区域和丘脑的轴突组成。Ⅰ层神经元为抑制性中间神经元,且95%以上为GABA能中间神经元,可以直接抑制大脑皮层锥体细胞的顶树突产生抑制效应,也可以抑制其他抑制性中间神经元产生去抑制效应,因此,大脑皮层Ⅰ层神经元通过抑制和去抑制两种调控方式来上调和下调大脑皮层锥体神经元的活动,进而对大脑皮层神经元信号的正常传递、信息整合以及视觉注意功能等起着非常重要的调制作用[11]。本研究在SD大鼠初级视皮层Oc1M区Ⅰ层中间神经元上,使用全细胞记录技术探讨了Ⅰ层中间神经元电学特性。结果表明,大鼠视皮层Ⅰ层神经元后电位存在ADP和AHP两种类型。已有研究发现,ADP的产生与神经元持续性钠电流(persistent sodium current,INap)密切相关[15];此外,KCNQ/M(Kv7)钾通道亦参与了神经元ADP的形成[16]。另有资料表明,AHP可能与钙诱导的钙释放(CICR)有关,内源性钙离子的升高进一步激活钙激活钾通道,导致AHP的产生[17,18]。
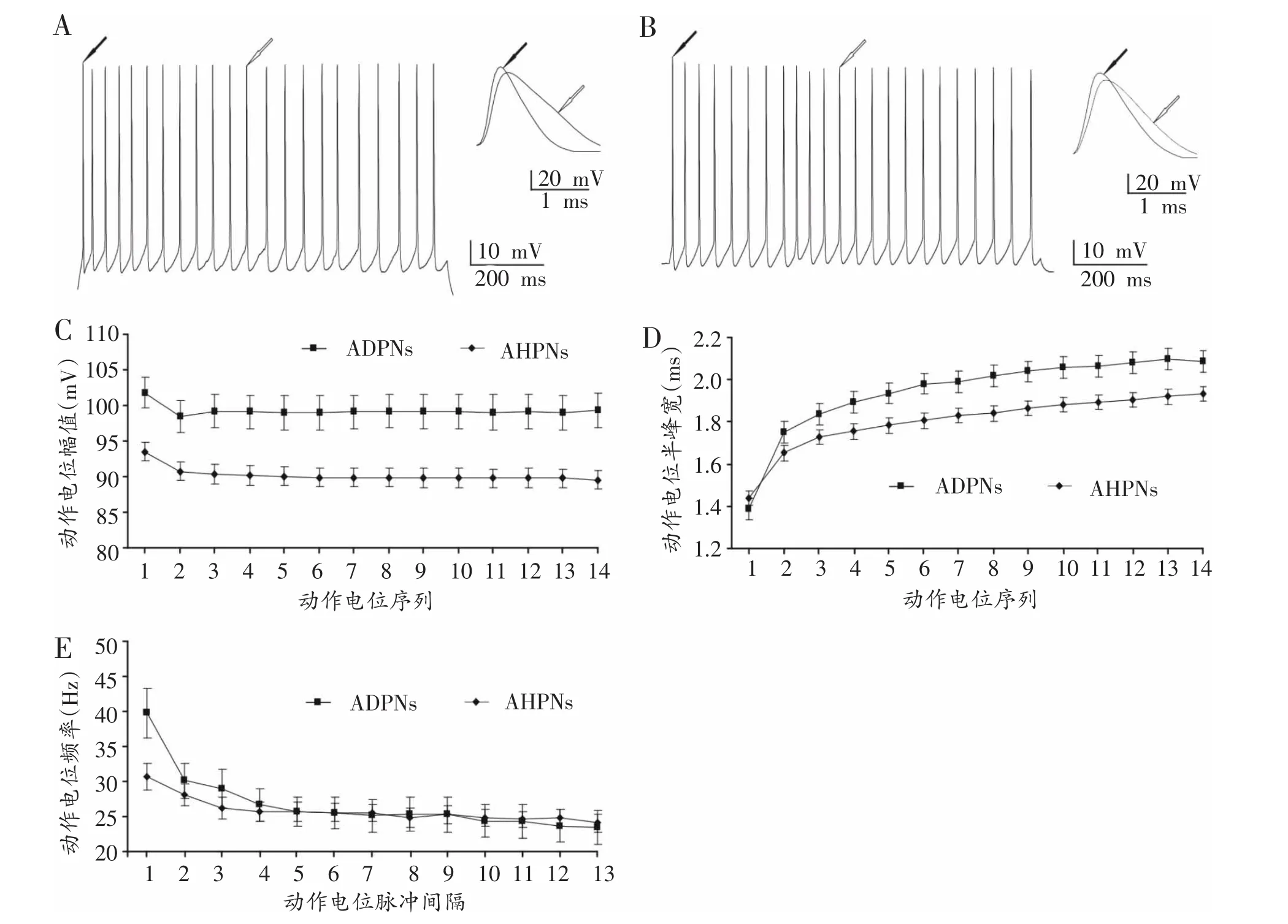
图3 两类Ⅰ层中间神经元动作电位发放特性的比较
基于后电位的特性的不同将视皮层I层中间神经元分为ADPNs与AHPNs两类。两类神经元间在静息电位和阈电位上均存在显著性差异,即ADPNs具有膜内负电位值较大的静息电位和和膜内负电位较小的阈电位,而AHPNs具有膜内负电位值较小的静息电位和膜内负电位值较大的阈电位,因此ADPNs比AHPNs具有更大的能障,上述结果表明AHPNs比ADPNs对兴奋性刺激更加敏感,在受到相同去极化刺激时,AHPNs比ADPNs更容易爆发动作电位。此外,两类神经元在动作电位幅值等电学特性上亦存在显著的差异,提示同类型的神经元在神经信息传递以及神经网络调控中具有不同的作用。
在神经元注入一段去极化刺激后,神经元诱发的动作电位发放频率可能受到膜兴奋性和后电位的调节[16]。本研究发现两类神经元具有相似的平均发放频率,ADPNs具有较低的兴奋性和后去极化电位,而AHPNs具有较高的兴奋性和后超极化电位,后超极化电位能够降低神经元在峰电位之后一段时间内的兴奋性,防止神经元对刺激产生过高强度的响应,因此,神经元兴奋性和后电位的共同影响导致了两类神经元具有相似的发放频率。本研究还发现两类神经元具有不同的动作电位幅值以及峰展宽,提示两类神经元膜上可能具有不同的Na+通道和K+通道密度[15]。初级视皮层Ⅰ层两类神经元中广泛存在频率适应性变化的情况,这些发放特性的不同,提示了两类神经元可能影响了不同的突触微环路,发挥不同的功能,在局部神经元回路中可能起到相互补充的作用[14]。此外,有研究发现Ⅰ层的一些GABA能神经元拥有轴突异位自发性放电的现象,这有利于神经元对机体进行调控,对皮层进行信息整合存在一定的意义[19]。
4 总结
本实验使用脑片膜片钳全细胞记录技术,在大鼠初级视皮层脑片标本上,探讨Ⅰ层中间神经元的被动和主动电学特性以及神经元的发放特性。结果显示,大鼠初级视皮层Ⅰ层存在后去极化神经元和后超极化神经元两种类型,且二者的被动和主动电学特性以及发放特性具有显著性差异。这些研究结果为进一步探讨不同类型的Ⅰ层中间神经元对深层神经元的调控作用、对信息整合、运动视觉信息处理以及注意功能的实现机制提供了电生理学基础。

