翅茎白粉藤乙醇浸膏体内抗氧化活性研究①
姚瑰玮 刘辰鹏 杨永兆 李 娟 林明琴③
(1 海南医学院药学院 海南海口571119;2 海南医学院基础医学与生命科学学院 海南海口571119)
翅茎白粉藤(Cissus hexangularisThorel ex Planch.) 是 葡萄科 (Vitaceae) 白粉藤属(CissusL.)植物,别名五俭藤、山坡瓜藤、拦河藤、散血龙(海南)等,是海南等热带和亚热带地区盛产的特色黎族药用植物,广泛分布于海南中部、西部及西南部[1-2]。民间常用其藤茎捣敷或煎水洗,治疗跌打损伤、刀刃伤,具有显著的抗菌消炎、清热解毒等功效[3-5]。姚瑰玮等[6]研究表明,翅茎白粉藤中含有糖类、苷类、黄酮类、酚类、蒽醌类、香豆素、生物碱及挥发油等化学成分。刘元等[7]研究表明,翅茎白粉藤中含有白藜芦醇。黄酮类化合物及白藜芦醇等成分正是药物抗氧化的活性物质基础,该类成分大量存在于醇提液中。目前国内外未见翅茎白粉藤总黄酮抗氧化作用的研究报道。
本文采用乙醇氧化损伤模型,通过检测小鼠血清中MDA(丙二醛)、GSH(还原型谷胱甘肽)含量,SOD(超氧化物歧化酶)及GSH-Px(谷胱甘肽过氧化物酶)活力来评价翅茎白粉藤乙醇浸膏的体内抗氧化活性,并探讨其作用机制,为寻找天然抗氧化剂以及翅茎白粉藤的开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 样本
翅茎白粉藤藤茎样本采自海南省万宁市兴隆镇,经海南医学院中药教研室曾念开教授鉴定为翅茎白粉藤(Cissus hexangularisThorel ex Planch)。标本保存在海南医学院化学实验教学中心。
1.1.2 动物
SPF 级雄性昆明种健康成年小鼠50 只,体重25~30 g,购自海南省药物研究所,动物合格证号:No.46002100000692。
1.1.3 试剂
PEG400 (AR,上海阿拉丁生物科技有限公司)、冰醋酸、无水乙醇、NaCl 均为国产分析纯试剂,购买于西陇科学股份有限公司;丙二醛(MDA)测试盒(A003-1)、还原型谷胱甘肽(GSH)测试盒(A006-2-1)、总超氧化物歧化酶(T-SOD)测试盒(A001-1)、谷胱甘肽过氧化物酶(GSHPx)测试盒(A005)均由南京建成生物工程研究所提供。试验用水为超纯水。
1.1.4 仪器
U-2900 型双光束紫外可见分光光度计(日本株式会社日立高新技术那珂事业所);AE100 电子天平(梅特勒-托利多仪器上海有限公司);HYQ-2121A涡旋混匀器(美国精骐有限公司);DK-8D三温三控水槽(上海博迅实业有限公司医疗设备厂);RJ-TDL-40B-Ⅱ低速台式大容量离心机(无锡市瑞江分析仪器有限公司司);TGL-16G 台式高速离心机(上海安亭科学仪器厂)。
1.2 方法
1.2.1 供试样品的制备
1.2.1.1 浸膏的制备
将翅茎白粉藤藤茎洗净、40℃烘干、粉碎过40 目筛,保存备用。样品粉末与75%乙醇按1∶5(V∶V)的比例以85℃水浴回流提取3 h,过滤烘干至恒重,阴凉干燥处保存。所得浸膏即为翅茎白粉藤乙醇提取物,平均浸膏得率为15.0%[6]。
1.2.1.2 供试液的配制
取翅茎白粉藤乙醇浸膏干燥膏体,研磨成细粉状,以13.75%PEG400 溶液为潜溶剂,将翅茎白粉藤乙醇浸膏配制成含生药量分别为1.829、3.657、7.315 g/kg 的混悬液,必要时可微微加热以加速溶解。临用前配制,每次灌胃前摇匀后使用。
1.2.2 药效学实验
1.2.2.1 造模方法
参照国食药监保化[2012]107 号《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》[8],高、中、低剂量组给予不同浓度的供试液0.2 mL/10 g,模型对照组和空白对照组给予同体积溶剂,连续灌胃15 d,末次灌胃后,模型对照组和3个剂量组禁食16 h(过夜),然后1次性灌胃给予50%乙醇12 mL/(kg·bw),6 h 后取材,空白对照组不作处理,不禁食取材。
1.2.2.2 实验分组及样品采集
将50 只昆明种小鼠适应性喂养一周后,按体重随机分成5 组,分别为空白组,模型组,高、中、低剂量组,各组均饲予基础饲料,自由饮水;高剂量组以7.315 g/kg 的翅茎白粉藤乙醇混悬液灌胃给药,中剂量组灌胃3.657 g/kg 混悬液,低剂量组灌胃1.829 g/kg 混悬液,模型对照组和空白对照组给予同体积溶剂,每日灌胃一次,连续灌胃15 d,末次灌胃后,模型组对照组和高、中、低剂量组禁食16 h(过夜),然后1 次性灌胃给予50%乙醇12 mL/(kg·bw);6 h 后摘取眼球取血,空白对照组不作处理,不禁食取血;4000 r/min 离心10 min后取血清,-80 ℃冻存待测;摘取眼球取血后立即脱颈处死,迅速摘取肝脏和肾脏,用生理盐水洗净、吸干水分并称重,计算脏器系数[9]。脏器系数计算公式为:
1.2.3 指标检测
观察和记录各组小鼠在给药后的外观表现。MDA 含量测定:取小鼠血清,参照MDA 试剂盒说明书操作,采用紫外分光光度法测定血清MDA 含量;GSH 含量测定:取小鼠血清,参照GSH 试剂盒说明书操作,采用紫外分光光度法测定血清GSH 含量;SOD 活力测定:取小鼠血清,参照T-SOD 试剂盒说明书操作,采用紫外分光光度法测定血清SOD活力值;GSH-Px 活力测定:取小鼠血清,参照GSH-Px试剂盒说明书操作,采用紫外分光光度法测定血清GSH-Px活力值。
1.2.4 数据处理
先采用Excel 2010 对数据进行统计,再用SPSS 20.0统计软件处理,结果以(均数±标准差)(x±s)表示,组间比较采用单因素方差分析。
2 结果与分析
2.1 翅茎白粉藤乙醇浸膏对小鼠外观体征的影响
与空白组小鼠比较,模型组,低、中、高剂量组小鼠的食欲、活动情况、体毛、粪便均正常,无明显差异,无死亡,表明翅茎白粉藤乙醇浸膏无明显毒性。
2.2 翅茎白粉藤乙醇浸膏对小鼠肝肾系数的影响
脏器系数是指实验动物某脏器的重量与其体重之比,与机体的衰老程度相关,能宏观反映动物机体氧化损伤的程度[9]。翅茎白粉藤乙醇浸膏对小鼠脏器系数的影响见表1。
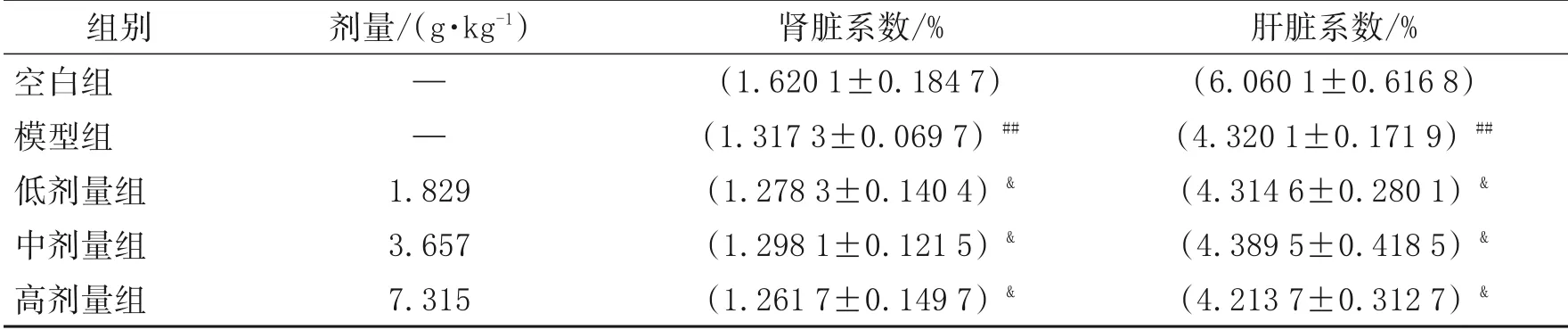
表1 翅茎白粉藤乙醇浸膏对小鼠肝肾系数的影响
从表1中的数据可知,与空白组比较,模型组肾脏系数和肝脏系数均显著下降(p<0.05),表明乙醇使小鼠肝脏和肾脏受到了一定损伤。高、中、低剂量组肾脏系数和肝脏系数与模型组相比无显著差异(p>0.05),这可能与造模时间短有关。
2.3 翅茎白粉藤乙醇浸膏对小鼠血清中MDA、GSH、SOD、GSH-Px的影响
丙二醛(MDA)是体内氧自由基攻击生物膜中的多不饱和脂肪酸而形成的脂质过氧化产物。MDA含量可以反映机体内脂质过氧化程度,间接反映细胞损伤程度[10-11]。还原型谷胱甘肽(GSH)是组织中主要的非蛋白质巯基化合物,也是最重要的非酶性抗氧化物,具有清除自由基,维持红细胞膜的完整性、细胞正常生长发育及细胞免疫等多种重要生理功能[12]。超氧化物歧化酶(SOD)是体内重要的抗氧化酶,对机体的氧化与抗氧化平衡起着至关重要的作用,该酶可以清除机体内的超氧阴离子自由基,从而保护细胞免受损伤[13]。谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的催化过氧化氢分解的酶,能特异性地催化GSH对过氧化氢的还原反应,从而阻断脂质过氧化反应,减少过氧化产物生成,起到保护细胞膜结构和功能完整的作用[13]。翅茎白粉藤乙醇浸膏对小鼠血清中MDA、GSH、SOD、GSH-Px 含量的影响结果见表2。
与空白组比较,模型组小鼠血清中MDA含量显著升高(p<0.01)、GSH 含量及SOD、GSH-Px 活力显著降低(p<0.01),显示造模成功。与模型组比较,高、中、低3 个剂量组小鼠血清中的MDA 含量均显著降低(p<0.01 或p<0.05),且在不同剂量组中MDA含量下降呈现浓度依赖性。说明翅茎白粉藤乙醇浸膏可以对抗乙醇氧化损伤造成的小鼠血清MDA 含量升高,从而降低机体脂质过氧化程度,对生物膜具有保护作用,且这种保护作用随给药浓度的增大而增强。
与模型组比较,高、中、低剂量组小鼠血清中的GSH 含量均显著升高(p<0.01 或p<0.05),且呈现浓度依赖性,表明翅茎白粉藤乙醇浸膏可以提高被乙醇氧化损伤的小鼠血清中的GSH 含量,清除体内多余自由基,从而保护受损细胞。与模型组比较,低剂量组和中剂量组小鼠血清中的SOD活力均显著升高(p<0.05),而高剂量组小鼠血清中的SOD 活力较模型组有极显著差异性(p<0.01),表明一定浓度的翅茎白粉藤乙醇浸膏可以显著提高被乙醇氧化损伤的小鼠血清中SOD 活力,清除氧自由基,修复因被氧化而损伤的细胞。与模型组比较,低剂量组和中剂量组小鼠血清中的GSH-Px 活力均显著升高(p<0.05),而高剂量组小鼠血清中的GSH-Px 活力较模型组有极显著差异性(p<0.01)。表明一定浓度的翅茎白粉藤乙醇浸膏可以显著提高被乙醇氧化损伤的小鼠血清中的GSH-Px 活力,减少过氧化产物的堆积,在一定程度上缓解乙醇对小鼠造成的氧化损伤。

表2 翅茎白粉藤乙醇浸膏对小鼠血清MDA、GSH、SOD、GSH-Px的影响
3 结论
翅茎白粉藤乙醇浸膏具有明显的体内抗氧化活性,其作用机制可能与降低机体脂质过氧化产物、防止有害物质堆积、增强机体抗氧化酶的活性、清除自由基等密切相关。翅茎白粉藤乙醇浸膏的成分复杂多样,具有体内抗氧化活性的成分可能是单体化合物,也可能是多种化学物质共同作用的效应。对于翅茎白粉藤乙醇浸膏体内抗氧化活性确切的药效物质基础还有待进一步研究。

