注射用质子泵抑制剂预防应激性溃疡的应用现状与挑战
王 佳,李丹滢,葛卫红*
1 南京大学医学院附属鼓楼医院 药学部,南京 210008;2 中国药科大学 基础医学与临床药学学院,南京 211198
应激性溃疡 (stress ulcer,SU) 是指机体在各类严重创伤、危重疾病或严重心理疾病等应激状态下发生的急性胃肠道黏膜糜烂、溃疡等病变,严重者可并发消化道出血穿孔,使原有疾病程度加重。美国药剂师协会相继于1999、2004、2007 年发布了用于指导ICU、外科、内科患者应激性溃疡的预防意见;中华医学会发布并更新的《应激性黏膜病变预防与治疗-中国普通外科专家共识(2015 版)》、《应激性溃疡专家建议(2018 版)》,均阐明了SU 的病因、危险因素、诊断、应对措施等,并从使用指征、药物选择、给药方案、停药指征等方面进行了相应的规定,提出静脉注射质子泵抑制剂使胃内pH 快速升至4 以上以达到预防目的。由此可见,合理使用质子泵抑制剂是预防应激性溃疡成功的关键。
1 应激性溃疡的发病机制
目前应激性溃疡被广泛接受的病理生理机制包括:在各种应激状态发生后①胃肠道黏膜在应激状态下局部发生微循环障碍,导致黏膜缺血,黏膜及上皮防御功能降低;②在发病早期胃酸、胃蛋白酶原等分泌增加,应激状态下的缺血可产生各类炎症介质,胃黏膜损伤因子作用增强;③应激状态出现后神经内分泌失调,下丘脑、室旁核和边缘系统作为应激的整合中枢,促进甲状腺素释放激素、5-羟色胺、儿苯酚胺等中枢介质参与并介导了SU 发生[1,2]。
SU 有着发病率低、死亡率高的特点。术后往往存在检查禁忌,未能及时确诊[3]。最新的临床数据显示,SU 的发生率为1%~8%,但受到原发病和合并症的影响,死亡率可达50%~80%[1,3,4]。而接受SU 预防治疗的ICU 患 者的出血风 险可降低约60%[5]。所以减少SU 的发生重在预防,早期应用抑酸药是预防SU 的有效方法。
2 质子泵抑制剂对SU 的预防性应用
PPI 的预防作用在国内外指南和实证研究中得到印证。在美国药剂师协会的预防意见中,提出PPI、H2RA 等均可作为预防药物。2008 年美国东部创伤协会EAST 指南、2013 年《中国神经外科重症管理专家共识》、2017 年美国Orlando Regional Medical Center 指南都对危险因素及预防使用PPI作出补充[6-8]。一项对6316 名冠状动脉搭桥患者的回顾性队列研究显示,预防性静脉注射奥美拉唑可降低胃肠道出血的风险[9]。相比于其他抗酸药,PPI 可能具有更强大的预防作用。一项研究将进行心脏手术的210 名患者分别给予胃黏膜保护剂、雷尼替丁、雷贝拉唑,结果表明,在出血性胃炎和活动性溃疡的发生率方面,雷贝拉唑均有明显优势[10]。故PPI 以其能迅速升高pH 且不良反应未明显增加,被多个指南与共识推荐为预防SU 的首选药物[1,3]。
PPI 在应对药物相关性溃疡的作用也得到明确。2016 年ACC/AHA《冠心病患者双联抗血小板治疗要点更新》提出,既往有消化道出血或具有高危消化道出血风险(老年人、服用华法林、激素或者非甾体抗炎药、CKD、合并糖尿病、贫血等)者,应服用PPIs[11]。2017 年美国胃肠病学协会更新了临床实践建议,提出NSAIDs 溃疡相关出血风险高的患者如果长期服用NSAIDs,应同时服用PPI[12]。一项对104 例低剂量阿司匹林治疗的患者分析的结果显示,使用奥美拉唑后溃疡/糜烂发生率明显低于法莫替丁(9.1% vs 30.6%);分析还发现奥美拉唑组胃十二指肠溃疡发生率更低(5.5% vs 20.4%)[13]。
3 质子泵抑制剂的作用机制
PPI 为弱碱性苯并咪唑类化合物,入血后首先迅速转运至胃黏膜壁细胞,最后到达强酸性分泌小管和泡腔处,在酸作用下生成次磺酰胺等活性产物,后与H+/K+-ATP 酶α 亚基中的半胱氨酸残基上的巯基、形成共价结合的二硫键,使H+/K+-ATP 酶不可逆性失活,达到抑制胃酸分泌的效果。自1987 年奥美拉唑问世以来,兰索拉唑、泮托拉唑、雷贝拉唑、艾司奥美拉唑等在剂型开发及适应症方面都取得了发展。注射剂、肠溶片、缓释片等广泛应用于治疗胃幽门螺杆菌感染,消化性溃疡,胃食管反流病,预防和治疗NSAIDs 相关性溃疡、应激性溃疡等。
由于其抑酸作用强、溃疡治愈率高、耐受性较好,能较快达到胃内pH 目标,临床应用已远超过H2RA 等传统抑酸药[2]。
4 注射用质子泵抑制剂的应用现状及挑战
4.1 注射用质子泵抑制剂应用广泛且处方金额大
据艾美仕的统计结果显示,在2016 年中国主流药物市场销售额排名中,PPI 仅次于抗生素和抗肿瘤药物;2017 年PPI 国内销售额为188 亿(注射剂162 亿),自2017 年起,多省市将PPI 列为重点监控药物品种。2020 年奥美拉唑、艾司奥美拉唑、兰索拉唑、泮托拉唑注射剂也作为乙类医保药物进入医保目录中[14]。国内20 家综合性医院最新调查显示,住院患者PPI 使用率为57.4%(其中注射剂占82.9%);预防NSAIDs 相关溃疡、应激性溃疡、抗血小板药物相关溃疡的使用率分别为69.2%、52.3%、70.3%[15]。加拿大相关调查也显示,2012 年泮托拉唑的年处方量高达1100 多万张,居于处方药第五位,在总药物费用支出中,有2.4 亿为PPI[16]。2015 年美国PPI 处方金额也高达118 亿美元[17]。
4.2 注射用质子泵抑制剂不合理应用问题多且集中
伴随着PPI 广泛的应用,诸多问题也开始出现。《非重症监护病房住院病人的应激性溃疡预防(2007 版)》显示,在非ICU 患者中有71%接受了过度治疗;国际多中心研究表明,高达80%的ICU 患者接受了不恰当的应激性溃疡的预防性治疗,超过50%的非重症患者也接受预防性治疗[18,19]。国内报道显示,在使用PPI 的住院患者中,超过80%属于预防性用药,其中43.19%属于无指征预防用药[20,21]。黄瑾等[22]对265 例骨科手术患者统计结果表明,无指征使用PPI 人均支出增加1301.34元。上述不合理问题主要发生在低风险或65 岁以下使用NSAIDs 而无危险因素的患者,表现在用药指征及疗程不合理(见表1)[23-30]。同时,PPI 溶剂选择、用法用量不合理、合并用药等在临床应用中也时有发生。以上预防性应用PPI 的不合理现象广泛存在,在无明显获益的同时还会增加治疗成本。

表1 2012~2019 年住院患者PPI 不合理用药情况
4.3 质子泵抑制剂不合理使用可能增加潜在风险
不合理使用PPI 会造成各器官系统的并发症[31]。近年来一些潜在的不良反应如营养素缺乏、感染、骨质疏松及骨折、高胃泌素血症等备受关注[32]。
PPI 可能增加骨折的风险。Yang YX 等[33]对平均年龄77岁老人的调查显示,使用PPI 后骨折的风险至少增加30%。对美国综合性卫生保健系统中33752 名髋部/股骨患者的病例对照研究表明,PPI 治疗2 年后,在合并危险因素(酗酒、关节炎、糖尿病、肾病、糖皮质激素使用)的患者中,髋骨骨折风险显著增加;以酗酒为例,风险增加16%[34]。
对PPI 引起胃肠道细菌过度繁殖也有广泛研究。2013 ACG-GERD 指南指出,PPI 治疗是难辨梭状芽孢杆菌感染的危险因素,在易感患者中应用须小心[35]。Lo WK 等[36]探究表明,对肝硬化有腹水和针对性进行抗生素预防使用的患者,小肠细菌过度繁殖风险增加至少2 倍。调查显示,长期使用PPI的患者发生弯曲杆菌、沙门氏菌、艰难梭菌等感染的风险至少增加2 倍[37,38]。随访队列研究显示风险增加,可能是由病理性细菌移位增强引起[39-42]。定量RT-PCR 对比PPI 处理后4周和8 周乳酸菌和链球菌,表明PPI 会引起肠道菌群失调,与之前通过基因组学分析得到的结果相一致[43,44]。
除了潜在的不良反应外,PPI 还常与其他药物发生相互作用。酪氨酸激酶抑制剂如吉非替尼的溶解呈pH 依赖性,与PPI 合用可能导致吸收减少,生物利用度降低;CYP2C19 参与华法林的代谢,而PPI 对代谢酶CYP2C19 有抑制作用,因此PPI 可能会干扰华法林的代谢,增强其抗凝效果和出血风险,合用时应注意监测INR 和凝血酶原时间。在临床应用时须严格监测相关药物浓度的变化,并对剂量进行适当的调整[45]。与常见药物可能发生相互作用的机制见表2。
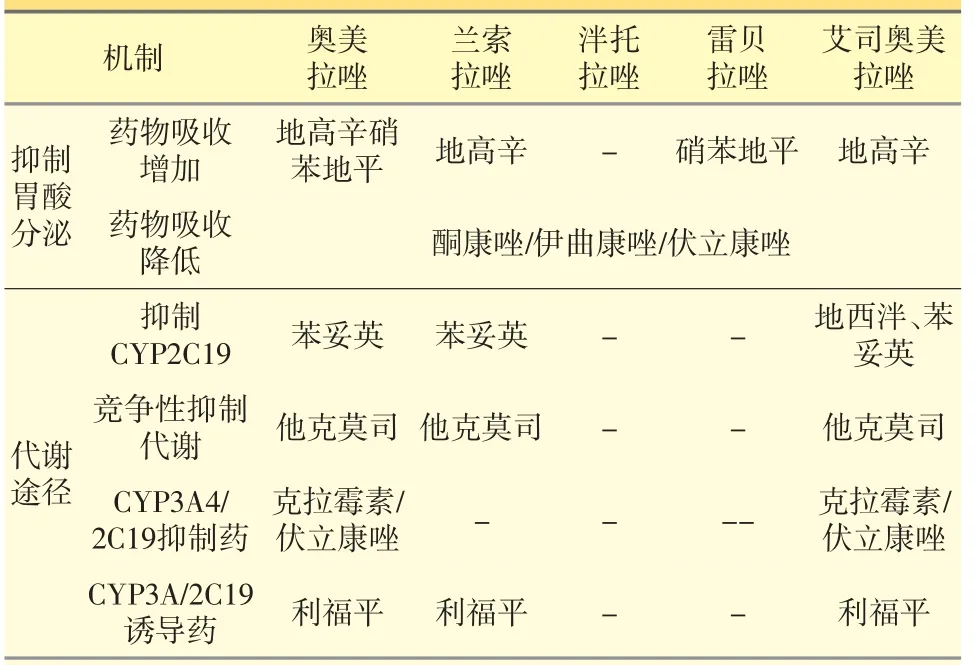
表2 PPI药物相互作用及可能的机制[46]
4.4 尚存的争议及挑战
(1)对比国内外应激性溃疡有关指南发现,指南多指导于ICU、外科手术患者。对非ICU 患者,PPI 预防应激性溃疡的研究及指南较少,获益与风险需要进一步研究。
(2)应激性溃疡的发病机制复杂,不同危险因素诱发的SU,是否采用统一方案,目前并没有任何指南提及,这其中涉及患者的疾病状态、合并用药和手术情况。如何寻找最优的给药方案成为目前预防应激性溃疡亟待解决的问题之一。
(3)国内指南中的适用人群存在差异。国内指导应激性溃疡的两部指南 《应激性黏膜病变预防与治疗专家共识(2015 版)》(简称为指南1)、《应激性溃疡防治专家建议(2018 版)》(简称为指南2),分别针对外科手术患者和住院患者,在临床应用时,可能会因指南的选择而出现不合理用药情况。
(4)国内指南对危险因素的界定有差异,主要表现在:
①烧伤面积都作为严重危险因素列出,但指南1 规定烧伤面积>35%,指南2 规定>30%;②持续一定天数的隐血阳性均作为潜在危险因素列出,指南1 规定>6 天,指南2 规定>3 天;③只有指南1 将男性高龄伴溃疡史、长期肠外营养列为严重危险因素,将灌注不足(败血症、休克等)列为潜在危险因素;④只有指南2 将呼吸窘迫综合征、心脑血管意外、心理应激、灌注不足(败血症、休克等)作为严重危险因素,将合用非甾体抗炎药作为潜在的危险因素。
不同患者使用PPI 的指征在国内外指南和共识中的具体差异见表3。

表3 国内外对于预防指征的差异对比
(5)国内指南对给药时机规定有差异。指南1 认为在危险因素出现后或复杂手术(>3 h)围手术期间可使用药物。指南2 推荐在术前可以对可能发生应激性溃疡的患者预防性使用药物。
5 讨论
5.1目前对于应激性溃疡预防性使用PPI 的研究大多集中在危重症患者中。对非重症患者的预防应用大多只在国内指南或指导原则中提及,但相关指南和共识因临床证据有限而质量不高,需要进一步采取循证医学方法,纳入高质量的试验结果,按照标准化流程制定质量更高、针对特定人群的临床预防指南,规范应激性溃疡的预防[49,50]。
5.2对于预防指征的危险因素判定缺乏统一标准。对国内外指南进行对比后发现,预防指征中的危险因素的界定仍存在差异,例如,复杂手术类型、长时间手术、既往消化道出血史等,是否作为独立危险因素;对不同疾病及基础状态的患者,不同医生对患者存在的某些主观判断也会造成影响。将危险因素量化或许可以解决这一问题,如美国学者Herzig SJ等[51]在2013 年进行了一项纳入75723 例非重症病人的大型队列研究中,将众多危险因素进行归类评分。危险因素包括:评分2 分的项目如年龄>60 岁、男性、急性肾功能不全、肝脏疾病(任何急性慢性肝病;肝移植病史等)、脓毒症、预防性抗凝药物(皮下注射普通肝素和≤60 mg·d-1依诺肝素);评分3分的项目如凝血障碍(PLT<50×109/L 或INR>1.5 倍,或PPT>2 倍正常值上限,或使用依诺肝素>60 mg·d-1)、合并内科疾病。将危险因素量化后,<7 分为低危,8~9 分为低中危,10~11 分为中高危,高危>12 分,不同风险等级可采取相应的预防措施。
5.3对医院调研结果发现,考虑到各PPI 自身的药学特性,PPI 种类、剂型、给药方式、疗程、停药时机也存在不合理使用情况。虽然各指南对PPI 种类未设限,但按照药品说明书来看,目前艾司奥美拉唑及奥美拉唑有预防SU 的明确适应症;各指南统一口服剂型优先;疗程与患者给药、停药时机有关。目前国内外指南对不同患者给药时机未统一明确,但普遍认为解除高危因素或能耐受肠内营养可停用PPI。所以患者依照实际情况不同,给药多集中在3~7 天,危重患者可延长至14 天。
5.4合理应用PPI 需要结合基因多态性和药代、药效动力学特点考量。PPI 均经过CYP2C19 代谢,不同PPI 与同功酶亲和力不同,参与代谢的CYP2C19 比例及其代谢途径也不尽相同。CYP2C19 基因多态性对5 种PPI 的影响差别大,奥美拉唑最大,艾司奥美拉唑最小。奥美拉唑是左旋和右旋光学异构体的混合体,两个异构体活性相近,但R 型异构体主要由CYP2C19 代谢,因此在药效上存在较大的个体差异。与CYP2C19 快代谢人群相比,慢代谢人群的清除率降低、消除半衰期延长、Cmax、AUC 增加,意味着到达胃壁细胞的药物总量越多,药物与质子泵接触概率越大,抑酸能力越强[52]。CYP2C19 基因多态性对PPI 的具体影响见表4。
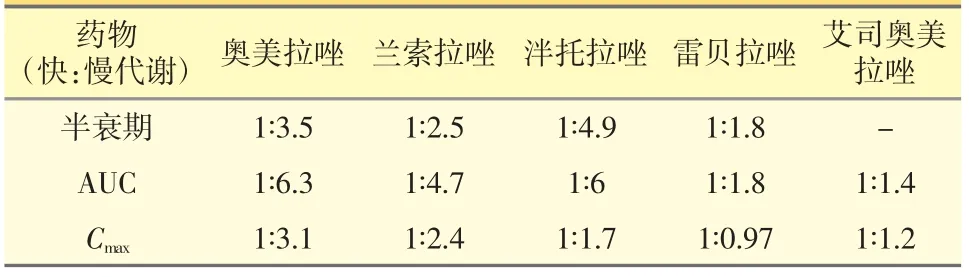
表4 CYP2C19 基因多态性(快慢代谢)对PPI 的影响
另外,PPI 与风险药物的相互作用通过以下途径实现:一是通过抑酸作用影响酮康唑、伊曲康唑等药物的吸收;二是通过代谢途径影响华法林、氯吡格雷等经CYP450 酶代谢的药物。同样也涉及到患者的基因多态性及药物代谢特点。因此在预防用PPI 时需要合理把握用药及停药指征,权衡患者出现不良反应及出血的风险。

