喀斯特峰丛洼地原生林群落更新动态
张 芳,杜 虎,曾馥平,彭晚霞,宋同清,*
1 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,长沙 410125 2 中国科学院环江喀斯特生态系统观测研究站,环江 547100 3 中国科学院大学,北京 100049
峰丛洼地是典型的喀斯特地貌,集中分布在西南喀斯特地区南部斜坡地带,面积约9.7万km2[1]。我国西南喀斯特地区生态系统的稳定性和抗干扰性差,产生了生境高度异质性、岩石裸露、土壤瘠薄且不连续、土壤总量和容量低、水土流失和岩溶干旱严重等自然胁迫环境,其适生植物具有嗜钙性、耐瘠性、耐旱性和石生性等限制特点[2],各种人为干扰导致喀斯特生态系统的严重退化和生物多样性严重丧失[3]。喀斯特地区的石漠化和严重的生态退化一直以来是植被恢复和生态重建的难点[4]。
群落中主要种群的更新主导着森林演替的方向,分析群落组成和结构动态,了解种群更新特征,可以更好地把握群落动态规律。森林动态是森林生态学研究的热点问题之一。由于森林动态周期较长,越来越多的学者开始强调自然森林群落长期重复研究的重要性[5-6]。建立长期固定样地监测动态变化,获取树种组成和群落结构等动态特征数据,了解森林变化规律、预测乔木树种种群发展趋势[7],可为森林保护、经营管理和研究提供理论依据。物种组成是群落最基本的特征,是形成群落结构的基础;物种多样性对生态系统功能具有促进作用[8-9],可作为判断群落结构变化或生态系统稳定性的指标[10-11]。森林内主要树种的更新动态,对于群落的结构和功能稳定或变化起着十分重要的作用[12]。前人对喀斯特植物的研究主要集中在植被结构和物种多样性变化[13-16],森林树种的空间分布[17],木本植物萌生特征[18]等方面研究;主要物种更新动态研究如古田山、百山祖、天目山[19-22]等地区,且大多是建立在森林动态样地两次定位监测,对喀斯特地区物种更新动态研究较少,且缺乏长期连续观测数据,很难从整体上把握种群更新规律。因此,有必要依托森林动态样地进行连续监测,分析种群更新特征。本研究基于木论喀斯特峰丛洼地原生林动态监测样地于2007、2012和2017年3次植被调查,探讨该群落的物种组成及群落结构变化特征,主要树种的种群大小变化趋势,分析群落动态。由于主要树种更新在很大程度上主导着植被演替的方向,分析其更新特征对于预测森林未来的变化趋势具有重要意义,能够为喀斯特植被恢复过程中物种选择和人工促进措施的制定等提供科学依据。
1 研究区概况
木论自然保护区地理坐标为107°54′01—108°05′51 E,25°07′01—25°12′22 N,位于广西环江毛南族自治县西北部,东西19.80 km、南北长10.75 km,林区总面积89.69 km2,属于中亚热带石灰岩区常绿落叶阔叶混交林生态系统,是世界上喀斯特地貌区幸存的连片面积最大、完好性保存最佳、原生性最强的喀斯特森林。森林覆盖率达94.8%,其典型景观单元为峰丛洼地,属中亚热带季风气候,平均气温19.3℃,无霜期310 d;年均降水量1529.2 mm。研究区域为一典型的峰丛洼地,面积190.2 hm2,其中洼地面积11.8 hm2,海拔最高处637.8 m,最低处为413.6 m。山坡裸岩率高达90%,只有零星分布的土壤,平均坡度约为35°,凹凸不平[23-24]。
2 研究方法
2.1 植被调查
2007年,在广西环江县西南部喀斯特集中连片区,从洼地向坡顶建立一块投影面积为200 m×100 m的动态监测样地。用全站仪将整个样地划分为20 m×20 m的样方,四角用PVC 管标记。将 20 m×20 m样方再划分为5 m×5 m样方,按CTFS(the Centre for Tropical Forest Science)标准(http://www.ctfs.si.edu)进行植被调查,按顺时针挂牌标记每个胸径(DBH)(Diameter at breast height)≥ 1 cm的个体,记录树种名称、胸径、树高、冠幅、坐标和生长状况等,挂牌标记[23]。样地植物主要为亚热带常绿阔叶林。
2.2 重要值计算
物种重要值的计算式为:重要值IV=(RF相对频度十RD相对显著度+RA相对多度)/3[26]。RF为相对频度、RD为相对显著度、RA为相对多度。依据物种的重要值的大小确定样地优势种。
2.3 物种多样性的计算方法
2)Simpson指数计算公式为:D=1-∑(Ni/N)2
3)Pielou均匀度指数计算公式为:Jsw=-(∑PilnPi)/lnS
式中,Pi=Ni/N,Pi为第i个物种的个体多度在样地中占所有物种多度之和的比例;N为样地内所有物种的个体总数;Ni为第i个物种的个体数;S为样方内物种数;Simpson优势度指数主要通过测定群落内物种的相遇几率来表征群落内物种的多样性以及优势度,当指数越大时群落物种多样性越高,指数越小说明群落物种多样性低而群落内优势种的优势度高。Pielou均匀度指数是表征群落内不同物种多度分布的均匀度,指数越大说明群落的均匀度越高[27]。
2.4 种群变化率的计算
依据三次调查数据,分析群落主要树种的补员和死亡动态及种群大小变化趋势。其中,补员是指在第二次调查中新出现的DBH≥1 cm的个体;死亡个体是指在复查时死亡或无法找到的植株。本文种群死亡率和补员率的研究对象为重要值排名前20的常见树种。通过计算各个物种在不同径级的死亡率(M)和补员率(R)参数,比较物种间的差异。
式中,N0和Nt分别为某一种群在第一次和第二次调查时的个体数,St是该种群在第二次调查时的存活个体数,T为两次调查时间间隔[19]。
2.5 生物量的计算
物种生物量采用本课题组前期研究所得的广西喀斯特森林乔木生物量回归拟合方程进行估算[28]。
2.6 数据处理
统计分析与制图通过SPSS 19.0、R 3.3.1和Origin 9.1软件完成。
3 研究结果
3.1 原生林科属种及个体数的变化
与2007年相比,2012年减少了1属3种,独立个体减少1040株,总个体数减少1787株。与2012年相比,2017年增加了2个科,减少了4属4种,其中减少12个种,新增8个种,大多数为偶见种(个体数<20),独立个体数减少了402株,总个体数减少了893株。随着时间推移,科的数量先稳定后增加,种属的数量逐渐减少,总个体数逐渐减少。
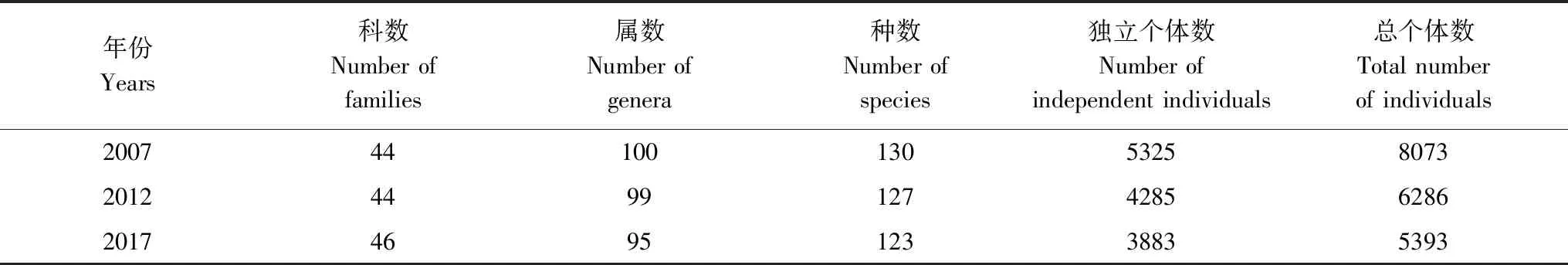
表1 木论喀斯特峰丛洼地原生林科属种及个体数的变化Table 1 Changes of species and individual number of the family of primary forest in karst cluster-peak-depression region
3.2 原生林重要值及排序变化
样地各物种的重要值差别不大,群落的优势种不明显。10年中,较优势的树种包括铁榄(Sinosideroxylonpedunculatum)、小叶栾树(Boniodendronminus)、小叶女贞(Ligustrumquihoui)、掌叶木(Handeliodendronbodinieri)、菜豆树(Radermacherasinica),重要值及排序发生了较大的变化。2017年,小叶栾树重要值上升为第一位,取代铁榄成为主要优势种。从2007年到2012年16个物种重要值排序增加,9个物种重要值排序减少;其中,长管越南茜(Rubovietnamiaaristata)的重要值降低;虾公木(Brideliafordii)的重要值增加。从2012年到2017年,15个物种重要值排序增加,12个物种重要值排序减少。其中,檵木(Loropetalumchinense)、盐肤木(Rhuschinensis)、鹅掌柴(Scheffleraoctophylla)、卵果海桐(PittosporumovoideumGowda)、虾公木重要值降低;密榴木(Miliusachunii)、苦树(Picrasmaquassioides)重要值增大。10年间,枫香树排序由17上升到6(表2)。
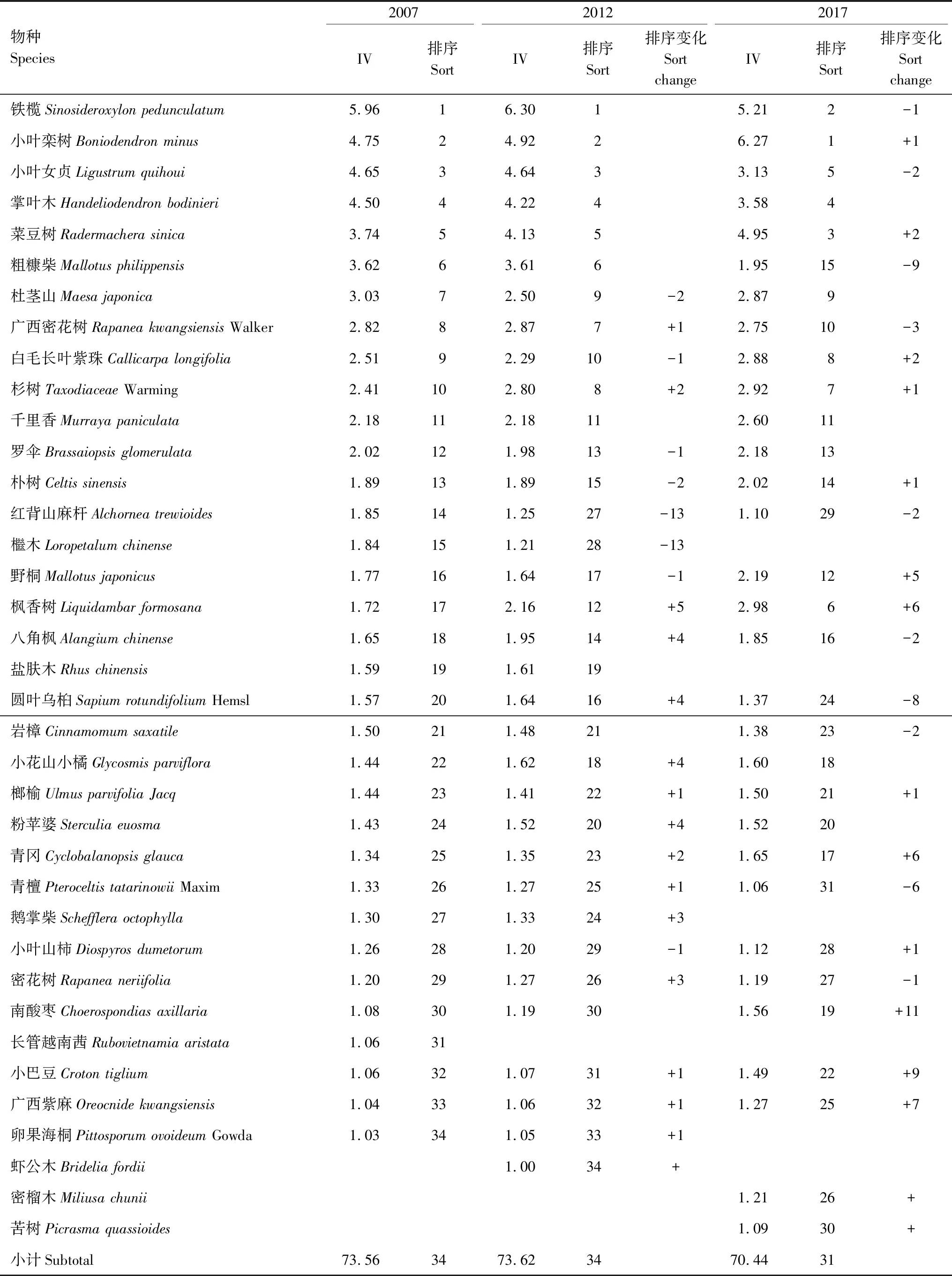
表2 木论喀斯特峰丛洼地原生林树种重要值及排序变化Table 2 Important values and sequence of primary forest species inkarst cluster-peak-depression region
+表示重要值排序增加,-表示重要值排序降低,数字表示增加或降低的排位数
3.3 原生林生物量密度及植被结构的变化
2012年生物量密度比2007年增加了10.72%;2017年较2012年增加了21.82%。胸径、树高进行多重比较分析显示,原生林的平均胸径,树高均随时间推移而增加。2017年胸径、树高显著高于2007年,与2012年差异不显著。2012年胸径比2007年增加了1.496 cm;2017年比2012年增加了0.591 cm。2012年树高比2007年高2.091 m;2017年比2012年增加了0.915 m(图1)。
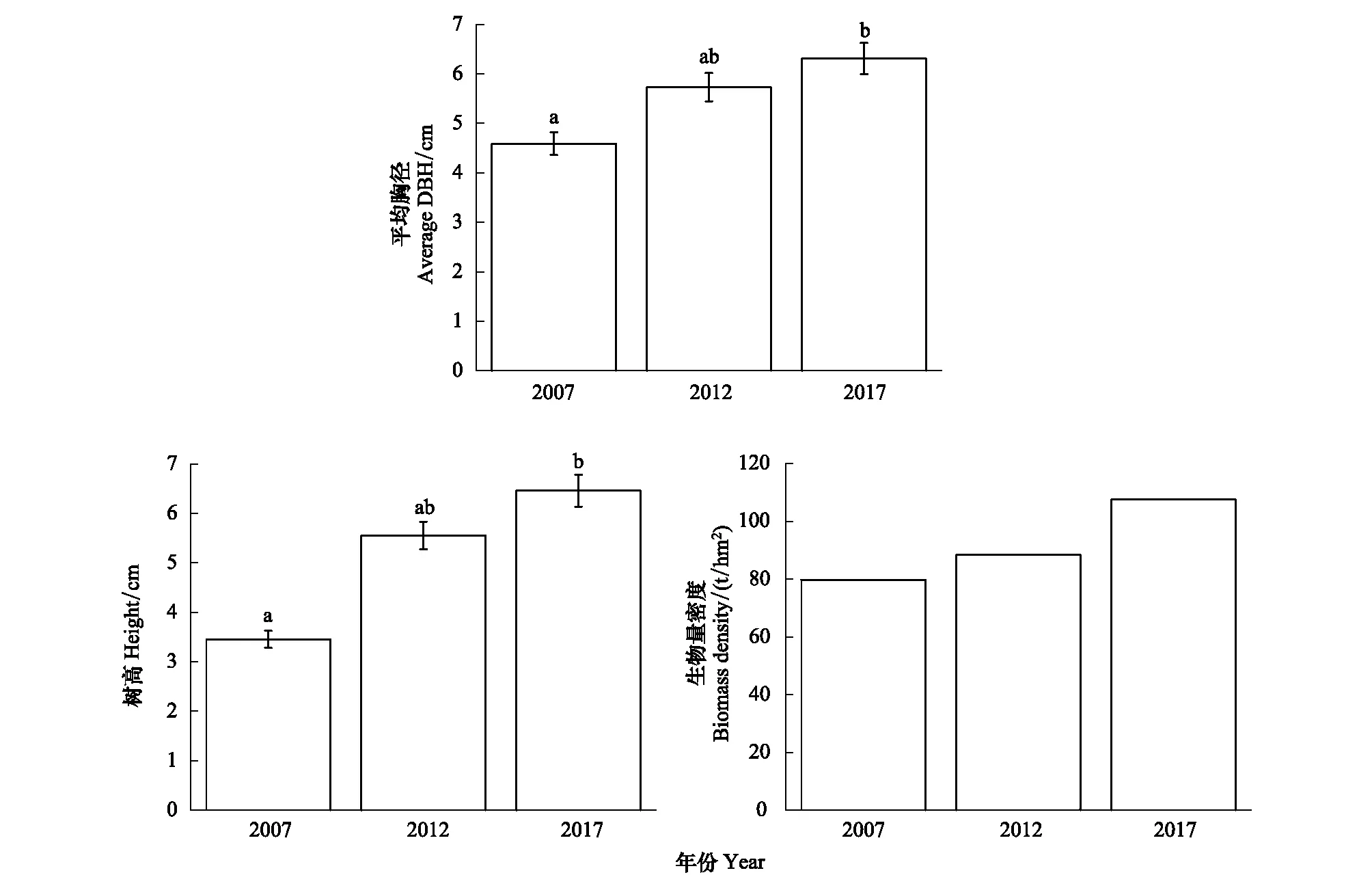
图1 木论喀斯特峰丛洼地原生林生物量密度及植被结构的变化Fig.1 The changes of biomass density and vegetation structure in karst cluster-peak-depression region
3.4 原生林径级结构变化
由图2可知,群落总体小径级个体很多,大径级个体较少,故形成倒“J”形的样地径级结构,随胸径增大死亡个体数呈减少的趋势。径级主要集中于DBH<5 cm和5—15 cm,其他径级分布较少。2007、2012、2017年中DBH<5 cm的植株分别占总多度的72.48%、61.23%、57.95%,10年间所占比例逐渐减少。DBH在5—15 cm的植株在分别占总多度的23.5%、32.8%、33.51%。DBH在15—25 cm的植株分别占总多度的2.69%、5.06%、6.73%。DBH在25—35 cm的植株分别占总多度的0.48%、0.81%、1.41%。DBH在5—15 cm、15—25 cm、25—35 cm的个体所占比例10年间逐渐增加。DBH≥35 cm的植株分别占总多度的0.17%、0.17%、0.39%,所占比例先稳定后增加。

图2 木论喀斯特峰丛洼地原生林径级结构变化Fig.2 The change of forest diameter structure in karst cluster-peak-depression region
3.5 死亡个体胸径和树高的相关关系
从死亡树高与胸径散点图增加可知(图 3),死亡个体与胸径有一定的相关性。死亡个体主要为幼树。随着胸径的增加,死亡个体逐渐减少。

图3 木论喀斯特峰丛洼地死亡个体胸径和树高的相关关系Fig.3 Correlation between DBH and tree height of dead individuals in karst cluster-peak-depression region
3.6 物种多样性变化
随着时间推移,Shannon指数、Simpson指数出现先降低后增加的趋势,均为2017>2007>2012。Pielou均匀度指数随着时间推移而增加,2012年较2007年增加了0.001,2017年较2012年增加了0.014(图4)。

图4 木论喀斯特峰丛洼地物种多样性变化Fig.4 Species diversity changesin karst cluster-peak-depression region
3.7 原生林主要物种死亡率、补员率及种群变化率
2007—2017年,种群变化率超过5%的物种包括粗糠柴、杜茎山、白毛长叶紫珠(Callicarpalongifolia)、红背山麻杆、野桐、盐肤木;2012—2017年,种群变化率超过5%的物种包括铁榄、小叶女贞、粗糠柴、红背山麻杆、檵木、盐肤木、圆叶乌桕(Sapiumrotundifolium),小叶栾树、菜豆树、白毛长叶紫珠、野桐、枫香树补员率大于死亡率,呈增长趋势。2012—2017年的种群变化率大于5%的物种比例高于2007—2012年,但2012—2017年有25%的种群呈增长趋势,群落稳定性大于2007—2012年。2007—2017年的10年变化中野桐、枫香树种群变化率为0.14%、1.46%,呈增长趋势,优势地位增加。小叶女贞、粗糠柴、杜茎山、红背山麻杆、檵木、盐肤木、圆叶乌桕种群变化率为-5.34%、-13.64%、-6.91%、-12.77%、-7.34%、-13.38%、-5.4%,属于快速变动种群,死亡率高于补员率,种群数量减少。小叶栾树、菜豆树、八角枫种群变化率分别为-1.16%、-1.7%、-1.43%,种群变化幅度小。10年平均死亡率8.23%、年平均补员率5.73%,种群变化率为-2.5%(表3)。

表3 原生林主要物种死亡率、补员率、种群变化率Table 3 Mortality,replenishment rate and population change rate of main tree species in primary forests
4 结论与讨论
随着时间推移,木论原生林木本植物科的数量先稳定后增加,种属数量逐渐减少,总个体数逐渐减少。2007—2012年减少3个种;2012—2017年减少12种,新增8种,均属于偶见种和稀有种。优势种通常是稳定的,而偶见种和稀有种会因个体死亡而消失。因此,群落中物种数量的波动主要取决于偶见种和稀有种的出现或消失[29-30]。10年间木本植物的重要值排名前五的物种相同,但物种的重要值及排序有一定的变化,群落的优势种组成及其优势程度变化不大,即该原生森林的优势种不明显,物种组成丰富、结构较稳定[31]。
样地平均胸径和树高随时间推移而增加,植被结构逐渐改变。平均胸径和树高在5年间的差异不显著,但10年间差异显著。生物量随着时间推移而增加,说明喀斯特森林仍在生长。但低于西南山地的主要森林类型(122.95 t/hm2)[32],说明木论原生林生物量还有生长空间。样地生物量总体低于非喀斯特地区(152.88 t/hm2)[33]。样地植被生长缓慢且生物量积累低,可能是由于喀斯特环境土层浅薄和地下水的渗漏限制了植物的生长和生物量的积累[33]。喻理飞等研究表明随着岩溶植被的自然恢复,群落物种丰富度、多样性指数和均匀度指数升高[26],本研究结果与之相似。2012年减少了3个物种,但是没有新增物种,因此多样性指数有所降低;2017年新增8个物种,多样性增加,并高于2007年,表明偶见种和稀有种进入和退出是引起群落物种多样性变化的主要原因。
群落的死亡率和补员率是反映群落更新动态的直接指标,死亡率和补员率处于相对较高的水平意味着种群更新速率较快。本研究中,10年间DBH≥1.0 cm个体的年死亡率为8.23%,年补员率为5.73%,种群变化率为-2.5%。巴拿马Barro Colorado(BCI)样地、马来西亚Pasoh样地、日本4 hm2暖温带常绿阔叶林[34-35]、天目山1 hm2常绿落叶阔叶混交林[21],鼎湖山20 hm2亚热带常绿阔叶林[36]等死亡率和补员率均不超过5%。而喀斯特特殊的二元水文结构及复杂的峰丛、洼地的地貌形态,使得不同的海拔和坡度及小生境类型存在较大差异,具有高度空间异质性,这可能是样地种群更新速率高的原因。前人研究表明补员率与死亡率的差值大于5%的种群属于快速变动的种群[29],将导致该物种在未来一段时间内个体数量加倍或减半。2012—2017年约有25%的种群呈增长趋势,大于2007—2012年;随着时间推移,群落稳定性逐渐增加。样地内小叶女贞、粗糠柴、杜茎山、红背山麻杆、檵木、盐肤木、圆叶乌桕等种群波动较大,呈衰退趋势,可能导致个体数量减半,最后极有可能被其他种群排挤出群落,相对优势地位也将被逐渐取代。小叶栾树、菜豆树种群可能在以后的演变过程中保持优势地位;其他物种变化幅度较小,基本维持原有规模。野桐和枫香树补员率高于死亡率,种群规模在扩大,优势地位逐渐上升。种群变化率也反映了群落物种组成的稳定性,20个物种中有约35%的物种种群变化率大于5%,群落稳定性一般,样地内阳性树种如红背山麻杆、盐肤木等导致内部还存在物种竞争排斥。除野桐和枫香树外的主要树种均没有明显进阶,死亡率高于更新率,种群处于衰退状态,优势树种的更新受到阻碍。随着群落郁闭度增加,物种入侵困难,一些阳性树种在环境资源竞争中处于劣势,无法继续生存,将逐渐退出群落,从而导致样地总个体数逐渐减少。
样地内小径级个体很多,大径级个体较少,死亡率随胸径增加而降低,故形成倒“J”形的样地径级结构;表明这些物种具有丰富的幼树储备,能够实现自我更新,总体上群落更新状态良好[37]。随着恢复时间推移,小径级个体所占比例减少,大径级所占比例逐渐增加。死亡个体胸径与树高有一定的相关性,死亡个体主要为小径级个体。由于喀斯特生境恶劣,生长比较缓慢,幼小植株受到的种内竞争压力极为强烈,由于资源有限,个体在发生光照、空间等资源竞争时,幼树又明显处于弱势地位,易发生密度制约导致高死亡率。同时为了更有效地利用资源就会发生自疏性死亡,以促进更新,保证种群在群落中的生存。这也体现了控制森林更新和结构的一种机制,即如果树木死亡主要是由竞争所驱动,则小径级树木相对于大径级树木死亡概率大[38]。大量小径级个体的死亡表明与其他径级相比小径级个体存在更为激烈的竞争。
喀斯特峰丛洼地原生林存在内部竞争,阳性树种的存在和逐渐退出,会使群落数量组成和结构相应地发生变化,喀斯特森林具有较高的死亡率和较低的生物量。有必要通过更长时期的连续监测,进一步揭示峰丛洼地原生林的更新过程中物种多样性、植被结构的变化及物种更新规律。
————水溶蚀岩石的奇观

