芽胞杆菌浸种对水稻内生细菌群落结构的影响
沙月霞,沈瑞清
宁夏农林科学院植物保护研究所,银川 750011
芽胞杆菌属(Bacillus)属于细菌界的厚壁菌门(Firmicutes)。稻瘟病是水稻生产中危害最严重的病害,由子囊菌Magnaportheoryzae(T.T.Hebert)Yaegashi &Udagawa(无性态:Pyriculariaoryzae)引起[1],一般情况下每年造成20%—30%的产量损失,严重的田块颗粒无收[2]。化学农药是防治稻瘟病最常用的药剂,但是大量重复使用容易污染生态环境,对人类健康也带来极大的威胁。因此,选用对生态环境无污染、杀菌效果明显的生防菌剂防治稻瘟病越来越受到关注。多项研究表明,芽胞杆菌产生抗逆性极强的芽胞,防病促生效果显著,对人畜无害,不易使病原菌产生抗药性,对生态环境安全,是防治稻瘟病的重要生防种质资源。已有研究表明贝莱斯芽胞杆菌(B.velezensis)E69、解淀粉芽胞杆菌(B.amyloliquefaciens)S170和短小芽胞杆菌(B.pumilus)S9对稻瘟病的防效明显[3],可以用于水稻可持续发展中稻瘟病的生物防治。
植物内生菌具有重要的生态功能,是植物微生态系统的重要组成部分[4-5],植物内生菌群落结构受地理环境[6-7]、栽培条件、品种基因型[8-9]、组织部位[10]、喷施药剂的影响。植物内生菌的群落结构与植物品种抗性密切相关[11-12],植物内生细菌是非常重要的内生菌资源,内生细菌的群落结构是否稳定也会影响植物品种的抗性。冯杭等[13]研究证实了番茄抗病品种的内生细菌总数量显著高于感病品种。West等[14]研究表明葡萄抗病品种的内生细菌的菌群结构和多样性与感病品种差异显著。
水稻内生细菌的群落多样性是衡量水稻植株是否健康的指标之一。已有的研究证实水稻内生细菌的生态功能包括增强水稻抗病虫害的能力[15]、促进植株生长或者增加产量[16-17]、提高抗逆境的能力[18]、加强寄主对氮等营养物质的吸收与代谢[19-20]、降解重金属污染和农药残留、与寄主互作等[21]。农药的施用对水稻内生细菌的群落多样性的影响较明显。崔凯等[22]发现吡虫啉、噻虫嗪和苯醚甲环唑喷施后显著降低水稻根系内生细菌群落丰富度。运用生物农药防治水稻病害已成为研究热点,但是对水稻内生细菌群落多样性的影响研究报道较少。
因此,本研究利用Illumina MiSeq测序技术研究芽胞杆菌浸种处理对水稻组织内生细菌群落多样性的影响。一方面明确芽胞杆菌浸种处理对水稻根部、茎部和叶部内生细菌的菌群组成、群落结构以及多样性的影响;另一方面剖析水稻组织内生细菌群落与水稻品种抗性之间的关系,从而揭示芽胞杆菌浸种处理对水稻品种抗性的影响。本文旨在为芽胞杆菌杀菌剂在水稻产业可持续发展中的应用提供科学依据。
1 研究材料和方法
1.1 试验地概况
试验于2018年8月—9月在宁夏农林科学院植物保护研究所日光温室进行(38°47′N,106°27′E,海拔高度1080 m)。种植土壤为营养土,有机质含量≥12.0%,腐殖植酸含量≥28%,水分≤20.0%,pH值4.0—8.0。
1.2 试验设计
试验设置12组样本处理,每组样本3个重复,分别是叶部样本L(Leaf):无菌水对照(CKL)、短小芽胞杆菌S9(S9L)、解淀粉芽胞杆菌S170(S170L)和贝莱斯芽胞杆菌E69(E69L);茎部样本S(Stem):无菌水对照(CKS)、短小芽胞杆菌S9(S9S)、解淀粉芽胞杆菌S170(S170S)和贝莱斯芽胞杆菌E69(E69S);根部样本R(Root):无菌水对照(CKR)、短小芽胞杆菌S9(S9R)、解淀粉芽胞杆菌S170(S170R)和贝莱斯芽胞杆菌E69(E69R)。
1.3 水稻种植与样本采集
试验水稻品种为G19号,健康种子在70%酒精中浸泡20 min,采用无菌水重复冲洗,冲洗后的种子分别在100 mL不同芽胞杆菌发酵液(1×108CFU/mL)中浸泡30 min,对照在无菌水中浸泡30 min,所有浸种后的水稻种子放置在28 ℃人工气候箱中,2 d后播种于塑料杯中(底部直径5.3 cm×上部直径9.5 cm×高11.5 cm)。每个塑料杯里播种5粒种子,每个塑料托盘里放6个塑料杯,每个处理种植24个塑料杯。
水稻种植20 d后采集样本,分别采集完整根系、茎基部2 cm的茎部组织和叶片中部大约10 cm的叶段。
1.4 抽提水稻内生细菌的基因组DNA
先用蒸馏水冲洗根系表面,直至肉眼所见异物完全洗掉。所有样本在1%次氯酸钠溶液中浸泡10 min,然后在70%酒精中浸泡1 min,最后用无菌水反复清洗,最后一次冲洗液在NA固体培养基上涂平板,30 ℃培养48 h后,NA平板上未长出菌落视为样本表面无菌。提取所有表面无菌样本的基因组总DNA,进行1%琼脂糖凝胶电泳检测。
1.5 16S rDNA测序
对水稻内生细菌的16S rRNA基因V5-V7高变区进行PCR扩增,扩增引物是799F:5′-barcode-AACMGGATTAGTAGATACCCKG-3′,1193R:5′-ACGTCATCCCCACCTTCC-3′[22],特异性引物需要包含barcode,由上海美吉生物医药科技有限公司合成。PCR反应体系(20 μL)包括2 μL的10×PCR Buffer,2 μL的2.5 mmol/L dNTPs,0.8 μL的5 μmol/L正向引物,0.8 μL的5 μmol/L反向引物,0.2 μL的rTaq Polymerase,0.2 μL的BSA,10 ng的Template DNA,补ddH2O至20 μL。反应条件包括95 ℃ 3 min;循环数×(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s);72 ℃ 10 min,10 ℃直到反应结束。第二轮PCR扩增产物采用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对PCR产物进行检测定量、按照一定比例混合,最后利用Illumina公司的Miseq 2×300平台测序。
1.6 数据处理与分析
选用Chao作为评价群落丰富度的指标、Shannoneven作为评估群落均匀度的指标、Shannon作为衡量群落多样性的指标、Coverage作为反映覆盖度的指标。Shannon的数值越高,表明微生物的群落多样性越高;Shannoneven数值越高,表明微生物的群落均匀度越高;Coverage的数值越高,表明样本序列检测出的概率越高,能够真实反映样本序列的检出情况。微生物群落Alpha多样性数据采用mothur (version v.1.30.1 http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)进行统计分析。
使用DPS15.0软件完成统计分析,显著性分析采用单因素方差分析中的最小极差法(Least significant ranges,LSD)(P<0.05),数据为平均值±标准误。
2 结果分析
2.1 芽胞杆菌浸种后水稻样本内生细菌序列统计和多样性
采用Flash软件,原始序列数据通过拼接、质控过滤和聚类分析去除嵌合体,从而获得优化序列用于进一步分析。12组处理36个样本共获得786298个有效序列,每个样本平均21842个序列。所有样本的序列通过聚类分析,序列相似的划分为一个小组,称之为分类单元(Operational Taxonomic Units,OTU)。一般情况下,对相似水平在97%的OTU数量和多样性指数进行生物信息学统计分析,36个样本共获得1576个OTU。根部组织的OTU范围是64—123,茎部组织的OTU范围是67—93,叶部组织的OTU范围是8—12。芽胞杆菌浸种后对水稻根部和茎部内生细菌的OTU影响显著(P<0.05),对叶部内生细菌的OTU没有显著影响(P>0.05)。
Alpha多样性可以评估微生物群落的物种丰富度、多样性、均匀度和覆盖度等指标。本研究通过Alpha多样性数据剖析芽胞杆菌浸种处理对水稻不同组织内生细菌群落多样性、丰富度、均匀度的影响,结果见表1。水稻根系、茎部和叶片内生细菌群落的丰富度指数Chao指数呈现一致的变化趋势:R>S>L,其中S9R>E69R>S170R>CKR,S9S>S170S>CKS>E69S,E69L>S9L>S170L>CKL,芽胞杆菌浸种处理增加了水稻根系和茎部组织内生细菌群落的丰富度(P<0.05),对叶部组织内生细菌群落的丰富度没有显著影响(P>0.05)。水稻组织内生细菌的多样性指标(Shannon)变化特征差异较小:R≌S>L,芽胞杆菌浸种对水稻根部、茎部和叶部组织内生细菌群落的多样性有显著影响(P<0.05)。均匀度指标(Shannoneven):S>R>L,芽胞杆菌浸种可以增加水稻根部和茎部组织内生细菌群落的均匀度(P<0.05),降低叶部内生细菌群落的均匀度(P<0.05)。
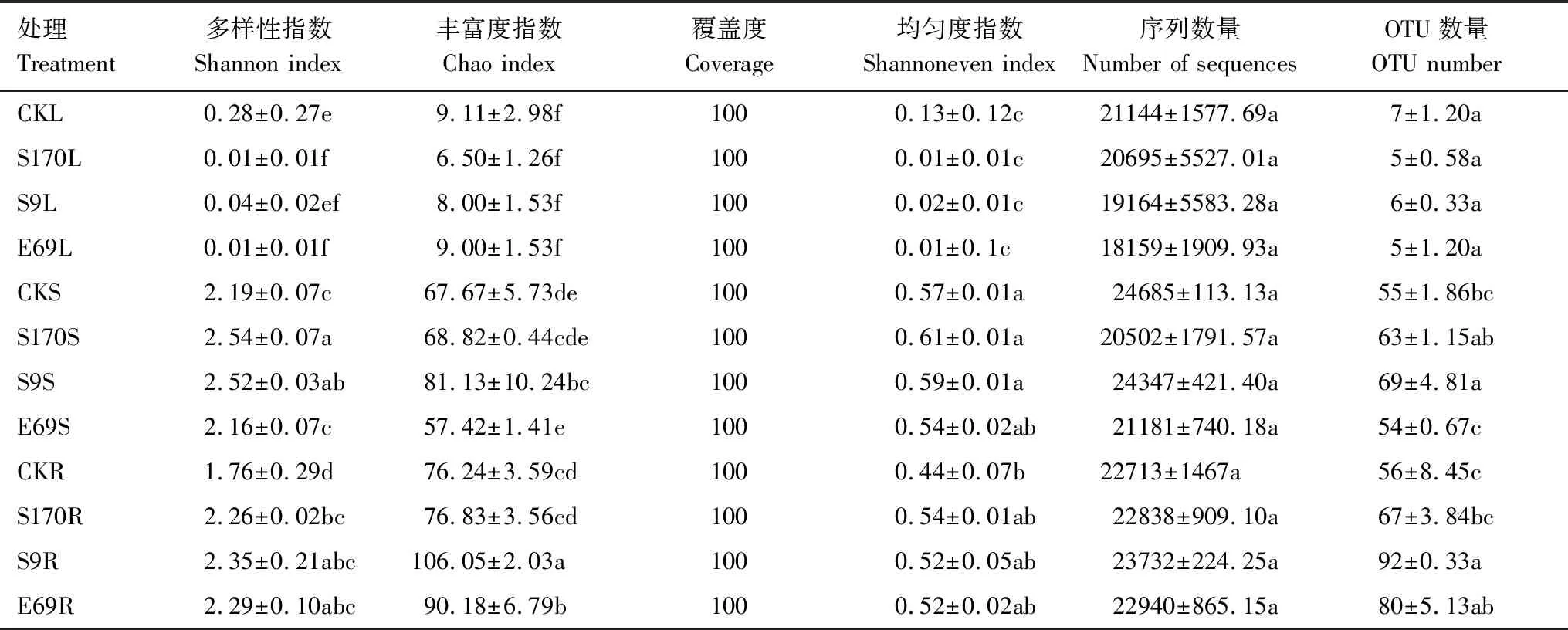
表1 芽胞杆菌浸种对水稻组织内生细菌群落多样性的影响Table 1 Impact of seed soaked by Bacillus on endophytic bacterial community diversity of rice
CKL:无菌水对照处理组的叶部样本;S9L:短小芽胞杆菌S9处理组的叶部样本;S170L:解淀粉芽胞杆菌S170处理组的叶部样本;E69L:贝莱斯芽胞杆菌E69处理组的叶部样本;CKS:无菌水对照处理组的茎部样本;S9S:短小芽胞杆菌S9处理组的茎部样本;S170S:解淀粉芽胞杆菌S170处理组的茎部样本;E69S:贝莱斯芽胞杆菌E69处理组的茎部样本;CKR:无菌水对照处理组的根部样本;S9R:短小芽胞杆菌S9处理组的根部样本;S170R:解淀粉芽胞杆菌S170处理组的根部样本;E69R:贝莱斯芽胞杆菌E69处理组的根部样本;不同字母代表显著性分析(最小极差法LSD,P≤0.05)

图1 芽胞杆菌浸种后水稻组织内生细菌群落的主坐标分析(OTU水平)Fig.1 Principal co-ordinates analysis (PCoA)of seed soaked by Bacillus on endophytic bacterial community of rice tissue (OTU level)表头“PCoA on OTU level”:在OTU水平上的主坐标分析;PC1代表第一主成分;PC2代表第二主成分;CKL:无菌水对照处理组的叶部样本;S9L:短小芽胞杆菌S9处理组的叶部样本;S170L:解淀粉芽胞杆菌S170处理组的叶部样本;E69L:贝莱斯芽胞杆菌E69处理组的叶部样本;CKS:无菌水对照处理组的茎部样本;S9S:短小芽胞杆菌S9处理组的茎部样本;S170S:解淀粉芽胞杆菌S170处理组的茎部样本;E69S:贝莱斯芽胞杆菌E69处理组的茎部样本;CKR:无菌水对照处理组的根部样本;S9R:短小芽胞杆菌S9处理组的根部样本;S170R:解淀粉芽胞杆菌S170处理组的根部样本;E69R代表贝莱斯芽胞杆菌E69处理组的根部样本。不同字母代表显著性分析(最小极差法LSD,P≤0.05±标准误)
Beta多样性主要用于比较微生物群落间的差异,主坐标分析(Principal Co-ordinates Analysis,PCoA分析)是最常见的评估方法。通过PCoA分析,发现不同处理之间多样性差异较明显(图1)。PCoA的前2个主成分轴解释了67.79%的群落差异,其中轴Ⅰ和轴Ⅱ分别是56.89%和10.90%,贝莱斯芽胞杆菌E69、解淀粉芽胞杆菌S170和短小芽胞杆菌S9浸种处理后叶部的细菌群落非常相似。CK、S170和S9处理的根部内生细菌群落聚合在一个象限内,其他处理内生细菌群落明显分开。Beta分析结果说明芽胞杆菌浸种处理对水稻根内生细菌群落影响较大,对水稻茎部内生细菌群落影响较小,对叶部内生细菌的影响不明显。
2.2 芽胞杆菌浸种对水稻组织内生细菌群落结构的影响
2.2.1芽胞杆菌浸种对内生细菌OTU的影响
芽胞杆菌浸种处理对水稻G19根部组织内生细菌群落的影响趋势一致,显著增加了OTU(序列数≥5)的数量(P<0.05),S9R(92±0.33)>E69R(80±1.53)>S170R(67±3.84>CKR(56±8.45)。根部内生细菌群落至少属于5个门,9—11个纲,13—18个目,22—34个科,36—57个属,65—123个OTU。芽胞杆菌浸种处理对水稻G19茎部组织内生细菌群落的影响趋势一致,显著降低了OTU(序列数≥5)的数量(P<0.05),S9S(69±4.81)>S170S(63±1.15)>E69S(55±0.67)>CKS(54±1.86);增加了细菌目和科的数量。茎部内生细菌群落至少属于4—5个门,9—11个纲,15—18个目,25—28个科,36—49个属,67—93个OTU。芽胞杆菌浸种处理对水稻G19叶部组织内生细菌群落的影响趋势不一致,对OTU(序列数≥5)的数量没有显著影响(P>0.05):S9L(7±1.21)>S9L(6±0.33)>S170L(5±0.58)=E69L(5±1.21);S170浸种处理降低了叶部内生细菌门、纲、属的数量;E69浸种处理增加门、目、科和属的数量;S9浸种处理降低了纲、目和科的数量,增加了细菌属的数量。水稻品种G19叶部组织的内生细菌群落隶属于2—4个门,4—6个纲,6—8个目,6—9个科,8—11个属,8—12个OTU。
2.2.2芽胞杆菌浸种对水稻内生细菌门水平丰度的影响
根部内生细菌中相对丰度≥1%的门有3个,主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),其余2个门所占比例均低于1%(图2)。芽胞杆菌浸种处理对水稻根部内生细菌的变形菌门丰度影响不显著(P>0.05),E69R(75.13%±3.31%)>CKR(71.65%±9.23%)>S9R(69.65%±1.26%)>S170R(64.21%±3.20%);增加拟杆菌门的丰度,S170R(27.19%±0.52%)>S9R(24.82%±3.77%)>E69R(18.08%±3.32%)>CKR(11.91%±9.68%);降低厚壁菌门的丰度,CKR(16.16%±9.34%)>S170R(8.05%±3.01%)>E69R(6.46%±0.71%)>S9R(5.25%±2.57%)。
茎部的优势内生细菌菌群主要是变形菌门、厚壁菌门和拟杆菌门,芽胞杆菌浸种处理对细菌门丰度影响显著(P<0.05),拟杆菌门的丰度增加,厚壁菌门的丰度下降(图2)。变形菌门的丰度变化趋势是:E69S(85%±3.69%)>S9S(76.32%±0.48%)>CKS(75.51%±4.32%)>S170S(69.45%±6.31%);厚壁菌门的丰度变化趋势是:CKS(20.34%±3.66%)>S9S(7.22%±4.55%)>S170S(7.64%±1.07%)>E69S(6.84%±5.11%);拟杆菌门的丰度趋势是:S170S(22.43%±1.29%)>S9S(16.13%±1.56%)>E69S(7.86%±1.96%)>CKS(1.8%±0.69%)。
图2显示芽胞杆菌浸种后显著影响了叶部内生细菌群落的优势菌群(P<0.05):增加了厚壁菌门的相对丰度,E69L(99.97%±0.01%)>S170L(99.96%±0.01%)>S9L(99.61%±0.11%)>CKL(74.20%±0.58%);降低了变形菌门的丰度,CKL变形菌门(25.79%±0.17%),芽胞杆菌浸种处理后变形菌门的相对丰度范围是0.02%—0.39%。

图2 芽胞杆菌浸种对水稻组织内生细菌菌群组成的影响(门水平)Fig.2 Impact of seed soaked by Bacillus on endophytic bacterial community structure of rice tissue (phylum level)
2.2.3芽胞杆菌浸种对水稻内生细菌纲水平丰度的影响
芽胞杆菌浸种处理后水稻组织内生细菌隶属于11个纲(图3),有6个纲的相对丰度≥1%。芽胞杆菌浸种处理对水稻根部组织内生细菌纲的影响趋势一致,增加了根部组织中γ-变形菌纲(Gammaproteobacteria)、黄杆菌纲(Flavobacteriia)、梭菌纲(Clostridia)和α-变形菌纲(Alphaproteobacteria)的相对丰度,E69R>S170R>S9R>CKR;降低了β-变形菌纲(Betaproteobacteria)和芽胞杆菌纲(Bacilli)的相对丰度,CKR>S170R>E69R>S9R。其中γ-变形菌纲(39.31%—69.17%)、α-变形菌纲(0.62%—6.29%)和β-变形菌纲(3.42%—31.69%)隶属于变形菌门,芽胞杆菌纲(2.21%—15.91%)和梭菌纲(0.25%—3.43%)属于厚壁菌门,黄杆菌纲(11.63%—24.50%)属于拟杆菌门。
芽胞杆菌浸种处理对水稻茎部组织内生细菌纲的影响趋势不一致,增加了黄杆菌纲、β-变形菌纲、α-变形菌纲的相对丰度,S170和S9增加了γ-变形菌纲和芽胞杆菌的相对丰度,E69降低了γ-变形菌纲和芽胞杆菌的相对丰度;3株芽胞杆菌浸种处理降低了水稻茎部梭菌纲的相对丰度。
水稻叶部内生细菌纲主要包括γ-变形菌纲和芽胞杆菌纲,芽胞杆菌浸种处理对细菌纲的影响趋势一致,降低了γ-变形菌纲的相对丰度,增加了芽胞杆菌纲的相对丰度。清水对照CK叶部的γ-变形菌纲和芽胞杆菌纲丰度分别是25.78%±0.83%和74.21%±0.58%,芽胞杆菌浸种后叶部的芽胞杆菌纲丰度达到99.64%以上,S170和E69处理组分别达到99.97%±0.05%和99.93%±0.01%。

图3 芽胞杆菌浸种对水稻组织内生细菌菌群组成的影响(纲水平)Fig.3 Impact of seed soaked by Bacillus on endophytic bacterial community structure of rice tissue (Class level)
2.2.4芽胞杆菌浸种对水稻内生细菌属水平丰度的影响
相对丰度≥5%为水稻组织的优势菌属,芽胞杆菌浸种处理对水稻组织优势菌属影响趋势一致(图4)。清水对照根部内生细菌优势菌属是肠杆菌属(Enterobacter)、单胞菌属(Stenotrophomonas)、成团泛菌属(Pantoea)、马赛菌属(Massilia)、伯克霍尔德菌(Burkholderia-Paraburkholderia)、黄杆菌属(Flavobacterium)和鲁梅尔芽胞杆菌属(Rummeliibacillus);芽胞杆菌浸种处理组的优势菌属是柠檬酸杆菌属(Citrobacter)、金黄杆菌属(Chryseobacterium)、肠杆菌属、单胞菌属和克雷伯菌属(Klebsiella)。成团泛菌属(10.93%±5.51%)、马赛菌属(23.05%±7.54%)、伯克霍尔德菌(8.21%±5.34%)、黄杆菌属(7.07%±6.41%)和鲁梅尔芽胞杆菌属(8.79%±6.49%)是清水对照独有的优势菌属,柠檬酸杆菌属(2.05%—31.44%)、金黄杆菌属(17.25%—26.18%)和克雷伯菌属(5.66%—21.06%)是芽胞杆菌处理组独有的优势菌属。试验结果表明芽胞杆菌浸种处理显著增加柠檬酸杆菌属、金黄杆菌属、克雷伯菌属的丰度,显著降低肠杆菌属、成团泛菌属、马赛菌属、伯克霍尔德菌、黄杆菌属、鲁梅尔芽胞杆菌属的相对丰度。
清水对照茎部内生细菌优势菌属是假单胞菌属(Pseudomonas)、柠檬酸杆菌属、肠杆菌属、克雷伯菌属、毛螺菌属(Lachnospiraceae)。芽胞杆菌浸种处理优势菌属是假单胞菌属、金黄杆菌属、肠杆菌属、单胞菌属和丛毛单胞菌属(Comamonas)。其中柠檬酸杆菌属(23.91%±2.84%)、克雷伯菌属(7.82%±0.83%)和毛螺菌属(18.44%±3.79%)是清水对照茎部独有的优势菌属,金黄杆菌属(6.26%—15.42%)、单胞菌属(5.49%—9.10%)和丛毛单胞菌属(3.30%—8.31%)是芽胞杆菌浸种处理组独有的优势菌属。试验结果证实芽胞杆菌浸种处理增加了金黄杆菌属、单胞菌属、丛毛单胞菌属的相对丰度,显著降低丛毛单胞菌属、克雷伯菌属、成团泛菌属、毛螺菌属的相对丰度。
芽胞杆菌浸种后对水稻叶部内生细菌的优势菌属影响显著(P<0.05),显著增加内生芽胞杆菌属的相对丰度,S170L(99.96%±0.01%)>E69L(99.93%±0.04%)>S9L(99.64%±0.24%)>CKL(74.21%±1.17%);降低成团泛菌属的相对丰度,CKL的丰度是 23.58%±9.84%,芽胞杆菌浸种后叶片内部未检测出成团泛菌属。芽胞杆菌浸种处理后叶部组织的内生芽胞杆菌属与接种芽胞杆菌的16S序列的相似性需要通过传统培养法进一步验证。

图4 芽胞杆菌浸种对水稻组织内生细菌菌群组成的影响(属水平)Fig.4 Impact of seed soaked by Bacillus on endophytic bacterial community structure of rice tissue (Genus level)
2.3 芽胞杆菌浸种后水稻组织内生细菌的共有和独有物种
Venn图可以用于比较样本中共有和独有的OTU数量情况。芽胞杆菌浸种处理后显著影响水稻根部、茎部和叶部内生细菌群落中的OTU数量(P<0.05),芽胞杆菌种类不同,对内生细菌OTU影响也不相同,几个处理之间既有共有OTU,又有独有OTU。
图5显示4个处理根部内生细菌的共有OTU物种是64个,不同处理之间也具有相同的OTU物种。CK的独有OTU数量是6个,S170、E69和S9独有的OTU数量分别是1个、11个和13个。
图6显示4个处理茎部内生细菌的共有OTU物种是55个,CK独有OTU数量是3个,S170、E69和S9独有的OTU数量分别是4个、2个和9个。
图7显示4个处理叶部内生细菌共有的OTU只有4个,CK独有OTU数量是4个,S170、S9和E69浸种后叶部独有的OTU数量分别是2个、4个和5个。
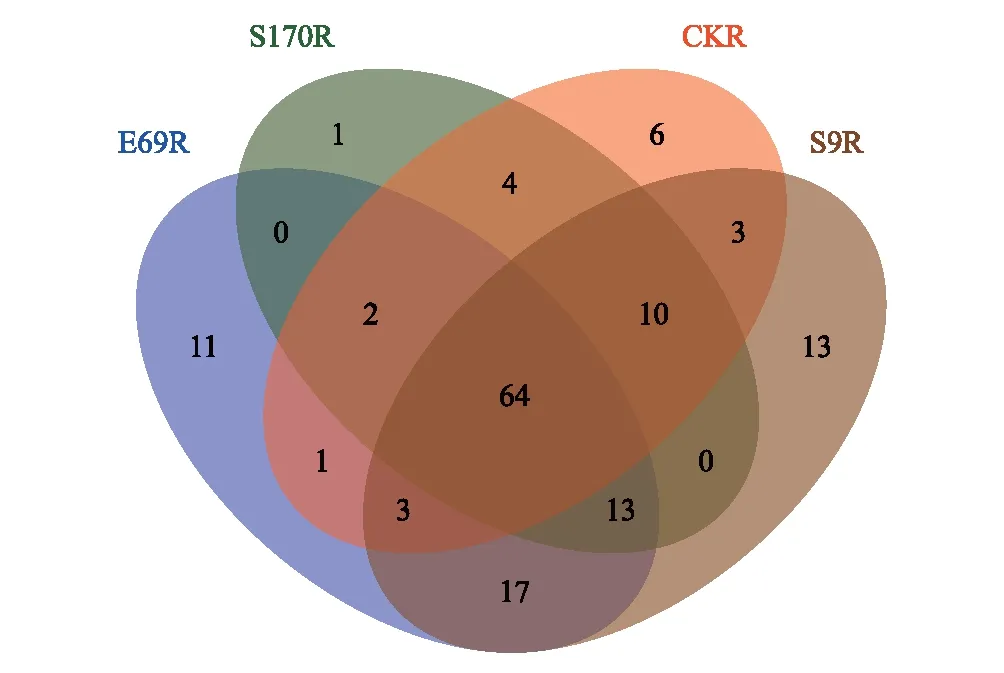
图5 芽胞杆菌浸种对水稻根部组织内生细菌OTU的影响(Venn分析)Fig.5 Impact of seed soaked by Bacillus on endophytic bacterial community OTU of rice root (Class level)(Venn analysis)

图6 芽胞杆菌浸种对水稻茎部组织内生细菌OTU的影响(Venn分析)Fig.6 Impact of seed soaked by Bacillus on endophytic bacterial community OTU of rice stem (Class level)(Venn analysis)

图7 芽胞杆菌浸种对水稻叶部组织内生细菌物种的影响(Venn分析)Fig.7 Effect on species of bacterial endophytes in rice leaf sewed in Bacillus (Venn analysis)
3 讨论
本研究通过高通量测序的方法检测芽胞杆菌浸种后水稻不同组织内生细菌群落的多样性,研究结果表明芽胞杆菌浸种后水稻根系和茎部内生细菌具有丰富的多样性,叶部内生细菌多样性明显降低。水稻内生细菌群落包括可培养和不可培养内生菌,采用微生物纯培养方法只能获得部分内生细菌群落结构信息,大部分不可培养内生菌的信息无法在平板上获得。近些年高通量测序技术因其自身的优点广泛应用到微生物多样性研究中[23-24]。
水稻组织内生细菌群落结构受品种基因型、栽培条件、气候特点和土壤性质等多种因素的影响。本研究中,采用贝莱斯芽胞杆菌E69、解淀粉芽胞杆菌S170和短小芽胞杆菌S9对水稻品种G19浸种处理,种植20 d后水稻根系、茎部和叶部内生细菌群落的多样性显著变化。崔凯等[22]研究表明吡虫啉、噻虫嗪和苯醚甲环唑对水稻根系和叶部内生细菌群落的多样性影响不显著,但毒死蜱在低浓度的条件下对水稻根系内生细菌群落的多样性影响明显,在高浓度条件下抑制根系内生细菌群落多样性。这与本研究结果差异较大,说明化学农药与生防菌剂对水稻内生细菌群落的影响显著不同,也说明地理环境、栽培条件、品种特性、药剂喷施或者浸种都会影响水稻内生细菌群落的多样性[25-26]。分析原因,芽胞杆菌一方面可能促进了水稻组织中一些内生细菌的生长,另一方面抑制了部分有害菌的生长。因此,导致了根系、茎部和叶部内生细菌群落多样性发生变化。
已有的研究报道中,变形菌门、放线菌门(Actinobacteria)、拟杆菌门和厚壁菌门是水稻根系和茎部主要的细菌门。芽胞杆菌浸种处理后水稻根系和茎部内生细菌的优势菌群是变形菌门、拟杆菌门和厚壁菌门,其中变形菌门的丰度没有发生显著变化,但是拟杆菌门的丰度明显提高,厚壁菌门的丰度显著降低,叶部内生细菌的优势菌门是厚壁菌门。崔凯等[22]研究发现吡虫啉、毒死蜱、噻虫嗪和苯醚甲环唑施用后,水稻根系和叶部内生细菌的优势菌群均是变形菌门。本研究采用Illumina MiSeq测序技术检测出芽胞杆菌浸种后水稻根系的优势菌属是柠檬酸杆菌属、金黄杆菌属、肠杆菌属、单胞菌属和克雷伯菌属。与清水对照的优势菌属差异较大,但是又有一些共有的优势菌属。但是由于种植在土壤中,土壤中一些优势菌属进入水稻根系,对根系内生细菌优势菌属影响较大,因此产生共有菌属。芽胞杆菌浸种处理刺激了根系内一部分内生细菌的生长,产生了独有的优势菌属。芽胞杆菌浸种后水稻茎部的优势菌属是假单胞菌属、金黄杆菌属、肠杆菌属、单胞菌属和丛毛单胞菌属,根系中的部分内生细菌扩展到茎部组织成为优势菌属。芽胞杆菌浸种后水稻叶部的优势菌属是只有芽胞杆菌属,丰度达到99.61%以上,其中短小芽胞杆菌S9浸种后叶部还有0.39%的假单胞菌属。芽胞杆菌能够在水稻组织中稳定定殖,而且吸收寄主营养,不断在水稻植株体内繁殖,最终叶片内接种芽胞杆菌菌株数量远远超过其他菌属,成为了叶部的优势菌群,导致叶部内生细菌群落多样性较低。另外,测序样本是水稻种植后20 d,此时叶片内菌属的丰度普遍较低,接种芽胞杆菌也会抑制部分内生细菌的生长。据推测,测序样本如果是水稻孕穗期,有可能叶片内生细菌种类会比较丰富。在实践证明,芽胞杆菌属的细菌广泛具有防病促生效果[27-28],本研究说明芽胞杆菌浸种处理可以提高水稻叶部的抗性。本研究只检测了芽胞杆菌浸种对水稻内生细菌群落多样性的影响,未检测对内生真菌和内生放线菌群落多样性的影响,需要将三项检测结果结合起来进一步剖析芽胞杆菌浸种对水稻品种抗性的影响。
化学农药的残留不仅容易污染生态环境和威胁人类健康[29],对水稻内生细菌群落具有一定抑制作用[22,26]。本研究中的芽胞杆菌通过实验室研究和田间试验证实对水稻稻瘟病具有较明显的生防效果,而且对生态环境没有污染。本研究结果也说明贝莱斯芽胞杆菌E69、解淀粉芽胞杆菌S170和短小芽胞杆菌S9可以在水稻产业可持续发展中推广应用。
4 结论
芽胞杆菌浸种可以显著增加水稻根系和茎部内生细菌群落的丰富度和均匀度,降低叶部的丰富度和均匀度;显著提高水稻根系内生细菌群落的多样性,对茎部和叶部的多样性没有显著影响。芽胞杆菌浸种后,水稻G19根系和茎部的变形菌门丰度没有显著变化,拟杆菌门的丰度显著增加,厚壁菌门的丰度显著降低。浸种后根系独有的优势菌属是柠檬酸杆菌属、金黄杆菌属和克雷伯菌属,茎部独有的优势菌属是金黄杆菌属、单胞菌属和丛毛单胞菌属,叶部内生细菌优势菌群是厚壁菌门(99.61%以上)和芽胞杆菌属(99.64%以上)。试验结果表明芽胞杆菌浸种可以显著增加水稻根、茎和叶中芽胞杆菌属的丰度。因此,芽胞杆菌浸种处理可以在水稻产业可持续发展中推广应用。

