β-甘露聚糖产酶菌株ZMD13的紫外线诱变选育
许晓敬 郭传滨 禹宝成 唐培培 杨立均 孙会忠

摘 要:以从烟草根际土壤中分离到的具β-甘露聚糖酶活性菌株ZMD13为出发菌株,对其开展了紫外线诱变选育研究。结果表明,出发菌株ZMD13在功率15W,紫外灯距离30cm,照射时间1.5min的诱变条件下的致死率达到75%,确定为适宜剂量;试验获得的产β-甘露聚糖酶正突变菌株(编号为ZMD13-2)的最高酶活性达到了32.0U/mL,是出发菌株ZMD13最高酶活性(6.0U/mL)的5.3倍。突变菌株ZMD13-2可作为烟草土壤保育制剂开发的备用菌株。
关键词:烟草;β-甘露聚糖酶;诱变选育
中图分类号 S-3文献标识码 A文章编号 1007-7731(2019)22-00012-03
Ultraviolet Mutagenesis and Breeding of the Strain ZMD13 Producing β-mannanase
Xu Xiaojing1 et al.
(1Zhumadian branch of Henan provincial tobacco company,Zhumadian Henan 463000,China)
Abstract:The strain ZMD13 with beta manganase activity isolated from tobacco rhizosphere soil was used as the starting strain to carry out UV mutagenesis and breeding. The results showed that the mutagenesis rate of ZMD13 strain was 75% under the condition of 15 W power, 30 cm distance of uv lamp and 1.5 min exposure time, and the appropriate dose was determined. The positive mutant strain producing β-mannanase (numbered ZMD13-2) had the highest enzyme activity of 32.0 U/mL, 5.3 times that of the original strain ZMD13 with the highest enzyme activity of 6.0 U/mL. The mutant ZMD13-2 could be used as a reserve strain for tobacco soil conservation preparation.
Key words:Tobacco;β-mannanase;Mutation breeding
甘露聚糖是由β-1,4-D-吡喃甘露糖連接而成的线状多聚体,是半纤维素的第二大组分,广泛存在于生物有机体中,尤其是植物细胞壁的核心结构成分[1,2]。β-甘露聚糖酶是水解以β-1,4-D-吡喃甘露糖为主链的甘露寡糖、甘露多糖的内切水解酶,其在动物、植物和微生物中均有所发现,自然界中分布较为广泛,但得到实际应用的β- 甘露聚糖酶主要来自微生物[3,4]。因为β-甘露聚糖酶在高分子化合物纤维素的降解过程中起重要作用,所以β-甘露聚糖酶有利于加速土壤中的作物秸秆降解,调控耕作层土壤的碳素循环,是土壤保育剂和益生菌制剂开发重要的靶标物质之一[5]。本研究在前期研究中获得1株具有β-甘露聚糖酶活性菌株,编号为ZMD13,为了进一步提高其开发应用价值,笔者以改土著菌株作为出发菌株,进行了紫外线诱变选育,以期获得产酶能力强的菌株。
1 材料与方法
1.1 试验材料 出发菌株ZMD13:分离于烟草根际土壤,保存于驻马店市烟草公司生产技术中心实验室实验室。魔芋粉鉴别培养基:魔芋精粉5g,硫酸镁5g,硝酸钠3g,磷酸钾1g,硫酸铁0.01g,琼脂粉20g,蒸馏水1000mL,自然pH[2]。活化和保藏培养基:LB斜面培养基[6]。
1.2 出发菌株的紫外线诱变选育 首先利用LB培养基将出发菌株ZMD13进行活化培养,收集菌体,并用灭菌生理盐水水洗3次,在显微镜下借助于血球计数板统计菌体数,将菌体浓度调制成108个/mL,然后分别吸取3mL菌悬液,滴加到直径为90mm灭菌培养皿中,之后再用照功率为15W的紫外灯进行照射,紫外灯与培养皿中菌液之间的距离定为30cm,照射时间设定0.5、1、1.5、2和2.5min4个梯度。将紫外线照射处理过的菌悬液用生理盐水进行10倍梯度稀释,选取10-4、10-5、10-6 3个梯度分别涂布于魔芋粉鉴别培养基,30℃条件下避光恒温培养48h。设未照射紫外线的对照处理。
紫外线诱变的致死率计算公式如下[6]:
致死率(%)[对照毫升菌数-处理后每毫升菌数对照毫升菌数]×100
1.3 β-甘露聚糖酶活性评估 初步评估:采用魔芋粉鉴别培养基培养突变株,观察水解圈的大小。定量评估:DNS法测定菌株发酵液中的β-甘露聚糖酶活性。操作过程:将魔芋粉调制成0.5%作为底物,在0.9mL底物中加入0.1mL粗酶液(待测菌株在不加琼脂的魔芋粉鉴别培养基中发酵培养液),置于55℃的水浴锅中反应10min,之后加入2.0mLDNS试剂,煮沸5min以终止魔芋粉在β-甘露聚糖酶催化下的水解反应,快速冷却后用蒸馏水定容至25mL,用空白液将分光光度计归零,在波长540nm处测吸光度,设ZMD13的对照组。酶活力计算:在上述反应条件下,用0.5%浓度的魔芋胶作为底物,1min时段内释放1μmol相当于D-甘露糖的还原糖所需的酶量为1个酶活单位(U)[2,7]。
2 结果与分析
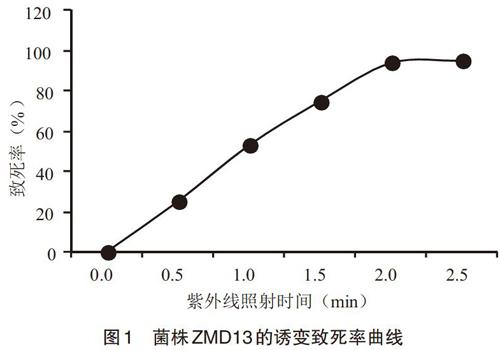
2.1 诱变致死率 以诱变的照射时间为横坐标,菌体致死率为纵坐标绘制致死率曲线(图1)。由致死率曲线可知,在功率15W、紫外灯距离30cm、照射时间1.5min条件下,致死率达到75%,故确定为出发菌株ZMD13的诱变试验剂量。
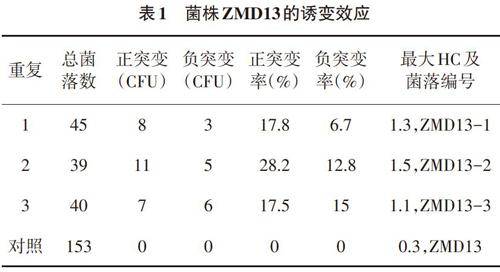
2.2 诱变效果 在功率15W、紫外灯距离30cm、照射時间1.5min诱导条件下对出发菌株ZMD13进行诱变,将诱变处理在魔芋粉鉴别培养基上进行37℃恒温避光培养,48h后染色,依据水解圈直径与菌落直径比值(HC)大小,确定ZMD13的诱变效果,结果见表1。选取不同平板中正向突变菌落中HC比最大的3株正突变菌株并依次编号为ZMD13-1、ZMD13-2和ZMD13-3,见图2。为了考察3株菌正向突变遗传稳定性,在魔芋粉鉴别培养基上连续进行了5次传代培养,见表2,判断依据是HC值的大小。结果显示,正突变株ZMD13-1、ZMD13-2和ZMD13-3的β-甘露聚糖酶活性在五代平板培养结果之间区别不明显,方差分析结果差异未达显著水平,故ZMD13-1、ZMD13-2和ZMD13-3 3株正突变株产β-甘露聚糖酶活性的遗传稳定性较好。
2.3 3株正突变菌株的产酶能力 以出发菌株ZMD13作为对照,对诱变效果最好的3个正向突变菌株ZMD13-1、ZMD13-2和ZMD13-3的β-甘露聚糖酶活性进行定量测定(图3)。结果显示,ZMD13-1、ZMD13-2和ZMD13-3 3个突变菌株在摇瓶发酵培养的过程中,β-甘露聚糖酶活性均比对照出发菌株要高,其中突变株ZMD13-2的β-甘露聚糖酶活性最高,发酵6h时达到峰值32.0U/mL,是出发菌株RYXP最高值6.0U/mL的5.3倍。本实验通过紫外线对出发菌株ZMD13进行诱变处理,结果明显提高了土著菌株RYXP产β-甘露聚糖酶活性,ZMD13-1、ZMD13-2和ZMD13-3等3个突变菌株丰富了备选菌株资源库,扩大了产酶条件优化、功能菌剂开发等下游研究的选择空间。
3 讨论
土壤中的微生物种类繁多,通过各种技术手段获得的土著功能微生物资源的产酶活性往往较低,很多时候功能菌株无法达到或满足实际开发应用的水平[4,5,8]。为此,积极开展土著微生物资源的诱变选育成了功能菌资源开发必然选项。在此背景下,本文对烟草根际土壤中获得的产β-甘露聚糖酶活性菌株ZMD13进行紫外线诱后,获得ZMD13-1、ZMD13-2和ZMD13-3活性较强的正突变株,通过平板鉴别初评和DNS法定量测定,明确了ZMD13-1、ZMD13-2和ZMD13-3各自的基本产酶活性特征,其中突变株ZMD13-2的最高酶活性达到了32.0U/mL,与出发菌株相比优势明显,最具开发潜力。但菌株的产酶活性受复杂因素的影响[9],故本试验获得的ZMD13-1、ZMD13-2和ZMD13-3突变株仍需要后期进行大量的复合诱变、产酶条件优化等基础工作。
参考文献
[1]杨先芹,孙丹,杨文博,等. 地衣芽孢杆菌 NK-27 菌株β-甘露聚糖酶的产酶条件及粗酶性质[J].南开大学学报:自然科学版,2002,35(2):117-122.
[2]李长影,孔雯,王家昕,等. β-甘露聚糖酶产生菌的分离鉴定和酶学性质[J].华中农业大学学报,2011,30(2):138-142.
[3]徐扬,刘起丽,聂国兴,等.β-甘露聚糖酶的研究进展.河南农业科学,2011,40(4):34-37.
[4]张树飞,邬敏辰.酸性β-甘露聚糖酶高产菌株的诱变育种[J].农业生物技术学报,2008,16(2):346-350.
[5]罗强,孙启玲,张兴宇,等.β-甘露聚糖酶菌株的复合诱变选育及发酵条件的优化[J].四川大学学报:自然科学版,2003,40(1):44-48.
[6]蒋咏梅.微生物育种学实验[M].北京:科学出版社,2012:205,117-211.
[7]Akino T,Nakamura N,Horikoshi K. Production of β-mannosidase and β-mannanase by an alka1ophilic Bacillus sp[J].Appl Microbiol Biotech,1987,26:323-327.
[8]施巧琴,吴松刚.工业微生物育种学.北京:科学出版社,2009,88-90.
[9]曹茜,冯凤琴.产脂肪酶菌株的常压室温等离子体诱变及高通量筛选方法的建立[J].中国粮油学报,2016,31(2):52-57.
(责编:张 丽)

