急性心肌梗死发生的昼夜节律及其对12个月内预后的影响
曾浩炜,陈锐,陈维维,谭卜川,杨萍
同其他心血管疾病一样,急性心肌梗死(AMI)的发生也有其昼夜节律[1]。不同地区及不同种族AMI发生的昼夜节律也有区别[2-4],但更多的研究倾向于早晨为心梗发生的高峰期[1,5-7],有的研究甚至发现第二高峰[3,8]。研究进一步发现AMI的发生不仅有其昼夜节律,且昼夜节律和预后密切相关。Henriques等研究发现18:00~08:00期间发生的AMI较08:00~18:00之间发生的AMI有更高的30 d死亡率[9];Bae等则研究发现18:00~23:59发生的AMI患者有更高的12个月死亡率,考虑与18:00~23:59发生的AMI患者有较高的肌酐水平、更多患者其Killip分级≥Ⅲ级、更多患者应用了利尿剂,且有较低的左室射血分数相关[6]。Mogabgab等研究发现,14:00~21:59期间发生的急性ST段抬高型心肌梗死(STEMI)其30 d内的全因死亡率、缺血复合终点、泵衰竭复合终点均较其他时间发生的STEMI明显升高[10]。而Nakashima等则研究发现06:00~11:59期间发生AMI的患者较其他时间发生AMI的患者有更高的再发急性冠脉综合征(ACS)、主要不良心脏事件(MACE)的风险,且因进展性病变再次行经皮冠状动脉介入治疗(PCI)的比例较高[6]。国内关于AMI发生的昼夜节律描述的研究不少见,但关于AMI昼夜节律和预后的研究较少。本研究主要目的在于探索中国人AMI发生的昼夜节律和预后的关系。
1 资料与方法
1.1 研究对象与分组回顾分析2015年1月1日~2016年10月25日就诊于吉林大学中日联谊医院诊断为AMI且AMI发生时间明确的患者467例,其中男性343例,女性124例,年龄58.6±11.1岁。AMI的诊断按照WHO的诊断标准[11]:典型的临床表现:至少持续30 min且不能被硝酸酯类药物缓解的胸痛;特征性心电图表现:至少2个相邻导联示病理性Q波或持久的ST段抬高或压低>0.1 mV;血清心肌标志物水平动态改变:肌酸磷酸激酶(CK)或其同工酶(CK-MB)或心肌肌钙蛋白(cTn)高于正常上限的2倍;3项中具备2项,特别是后2项即可确诊。排除标准:无胸痛症状的AMI;胸痛开始时间不明确;既往心肌梗死(心梗)、心力衰竭(心衰)病史;既往冠状动脉(冠脉)支架植入、冠脉旁路移植术病史;既往严重肺部疾病、肝、肾功能不全者及其他严重影响寿命的疾病。心梗发生时间以患者及其家属自述开始胸痛的时间为依据。将患者按AMI发生时间分为2组:早晨组(定义为06:00~11:59期间发生的AMI)和其他时间组。
1.2 方法
1.2.1 住院期间临床基本资料收集回顾分析其基本临床资料、在院期间发生的心衰、全因性死亡。心衰指听诊闻及肺部啰音或静脉应用利尿剂、或静脉应用强心药物。其中排除因高血压、肾功能不全、电解质紊乱而应用利尿剂者。
1.2.2 随访期间资料收集随访时间>1年,随访MACE事件的发生情况,包括全因性死亡、再发急性冠脉综合征(ACS)、因心衰再次住院。ACS指冠心病中急性发作的类型,包括不稳定型心绞痛和AMI。患者预后结果主要取自患者门诊随访时的医疗记录或患者再次住院时住院病历。当缺乏以上两种途径时,同患者或了解其病情的患者家属通过电话沟通。
1.2.3 随访期间复查造影结果在随访的过程中104例患者复查冠脉造影,PCI不良事件主要包括靶病变血运重建(TLR)、靶血管血运重建(TVR)及非靶血管血运重建(NON-TVR)。
1.3 统计学方法采用SPSS 20.0统计软件进行分析。计量资料以(±s)表示,组间比较采用t检验; 计数资料以例数(构成比)表示,组间比较采用χ2检验。AMI发生的昼夜节律分布采用χ2拟合优度检验;再发ACS、因心衰再次住院、全因死亡及MACE事件的累计发生率以Kaplan-Meier生存曲线表示,组间比较用Log-rank检验;多因素COX回归分析影响出院后因心衰再次住院、MACE、NON-TVR的独立预测因子。采用双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 AMI发生的昼夜节律AMI发生的昼夜节律在图1中显示,将24 h按每2 h划分,在06:00~07:59期间出现一个高峰(13.27%),χ2拟合优度检验示分布具有统计学差异(P<0.001);按每6 h划分,在06:00~11:59期间出现一个高峰(34.69%),χ2拟合优度检验示分布具有统计学差异(P<0.001)。
2.2 两组患者的临床资料特点两组患者的年龄、性别、既往高血压病、糖尿病、高脂血症病史、入院肌钙蛋白(TNi)、随机血糖、肌酐(CREA)、收缩压、心率、EF值、Killip分级≥Ⅱ级的比例、平均住院时间、首次经皮冠状动脉腔内成形术(PTCA)的有效性、NSTEMI的比例、心梗部位、多支血管病变的比例、平均植入支架数及出院后药物治疗等方面均无统计学差异(P均>0.05);但早晨组的患者较其他时间组患者有较低的BMI、较高的中性粒细胞/淋巴细胞比值(NLR),较短的医院大门到球囊扩张时间(DtoB),更少的既往吸烟史,且均具有统计学差异(P均<0.05)(表1)。
2.3 两组患者住院期间发生心力衰竭及死亡的比较早晨组患者住院期间有44例发生心衰,其他时间发生的AMI有62例发生心衰,两者间无统计学差异(27.2%vs. 20.3%,P=0.093);早晨组患者住院期间有7例死亡,其他时间发生的AMI患者住院期间有13例死亡,两者之间亦无统计学差异(4.3%vs. 4.3%,P=0.976)。
2.4 两组患者出院后MACE发生率的比较所有患者平均随访时间22.56±8.92个月,应用Kaplan-Meier生存曲线,早晨组和其他时间组患者因发生心衰而住院的Kaplan-Meier生存曲线交叉,故以交叉点12个月为界,单独分析12个月之内两组患者MACE、全因死亡、因心衰再次住院、再发ACS的Kaplan-Meier生存曲线。12个月之内两组患者MACE的Kaplan-Meier生存曲线(图2A)示早晨组的患者12个月之内MACE的累计发生率较其他时间组患者高,具有统计学差异(76.3%vs.50.3%,P=0.041)。各种不良心血管事件单独分析:早晨组的患者出院12个月之内有较高的因心衰再次住院(图2C)的累计风险,且具有统计学差异(53.5%vs. 39.3%,P=0.032);而全因死亡(图2B)和再发ACS的累计风险(图2D)的比较中,两组患者无统计学差异(45.3%vs. 48.5%,P=0.884;35.7%vs. 34.7%,P=0.978)。
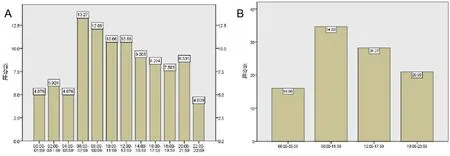
图1 AMI发生的昼夜节律 A将24 h按每2 h划分;B将24 h按每6 h划分

表1 两组患者临床基线资料的比较结果
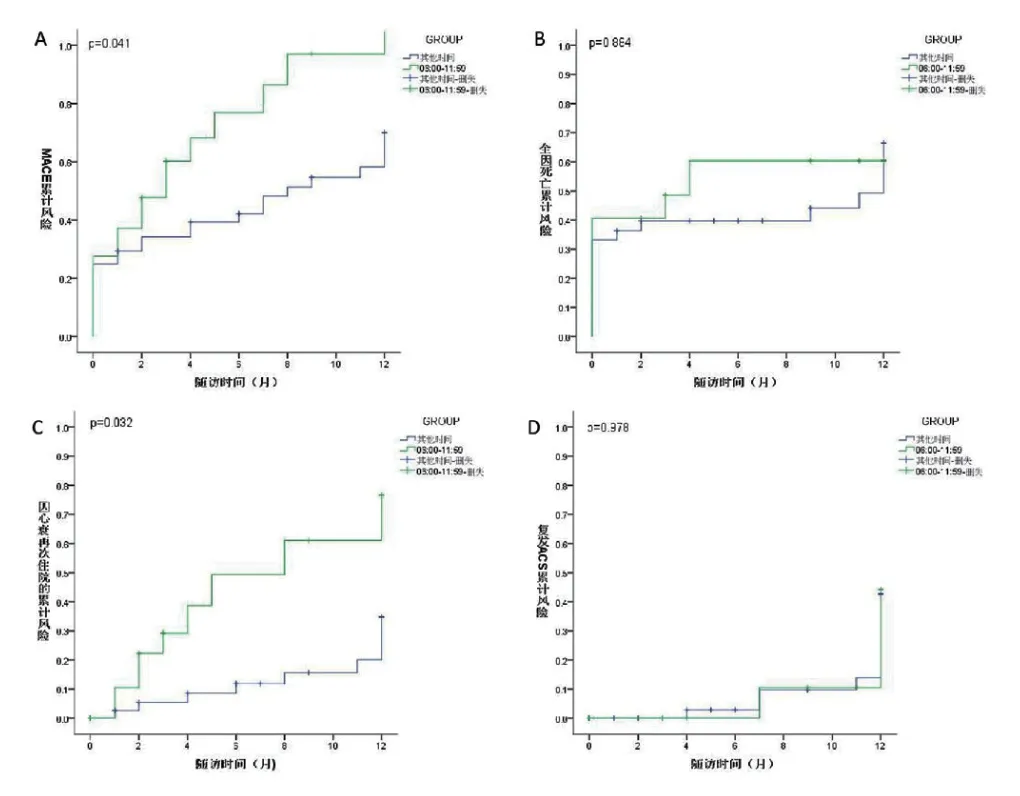
图2 Kaplan-Meier生存曲线(A)出院后12个月之内MACE(B)出院后12个月之内全因死亡(C)出院后12个月之内因心衰再次住院(D)出院后12个月之内再次发作的ACS
2.5 COX回归出院后MACE事件的多因素COX回归分析,在调整性别、DtoB时间、高血压、糖尿病、肌酐水平、Killip分级、EF值、BMI、吸烟史、多支血管病变等因素后,AMI发生在06:00~11:59期间不是出院后MACE的一个独立危险因素(表2)。
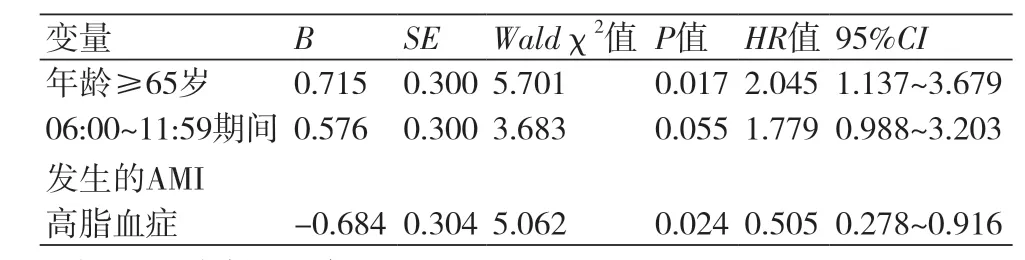
表2 出院后MACE的多因素Cox回归分析结果
出院后因心衰再入院的多因素COX回归分析,在调整性别、年龄、BMI、高血压、糖尿病、高脂血症、吸烟史、肌酐水平、Killip分级、多支血管病变等因素后,AMI发生在06:00~11:59期间、DtoB时间>90 min、EF值<50%均为患者出院后发生心衰的危险因素(表3)。
2.6 两组患者复查造影结果的比较随访过程中有104例复查造影,其中早晨组41例,其他时间组63例。早晨组中2例行TLR,6例行TVR,而其他时间组中7例行TLR,12例行TVR,两组间无明显统计学差异(4.9%vs. 11.1%,P=0.269;14.6%vs. 19.0%,P=0.561)。但早晨组有12例行NONTVR,而其他时间组7例行NON-TVR,两者间具有统计学差异(29.3%vs. 11.1%,P=0.019)。应用多因素COX回归分析,调整年龄、性别、DtoB时间、BMI、高血压、高脂血症、糖尿病、肌酐水平、Killip分级、EF值等因素后,AMI发生在06:00~11:59期间不是NONTVR的一个独立危险因素,而吸烟史和多支血管病变为NONTVR的危险因素(表4)。
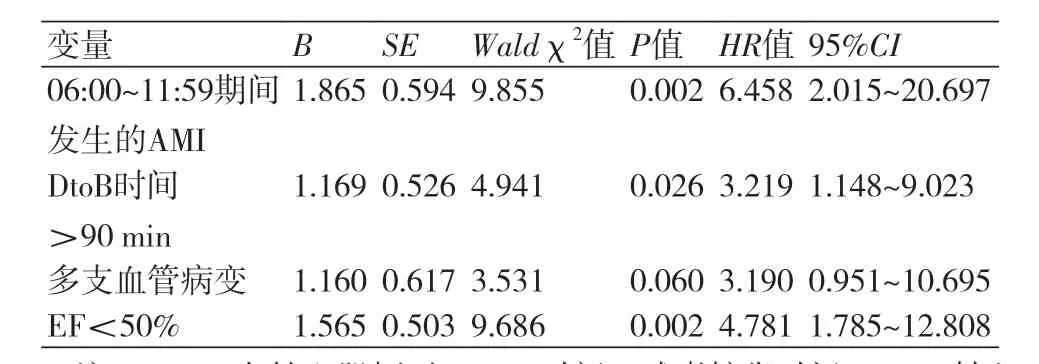
表3 出院后因心衰再次住院的多因素Cox回归分析结果
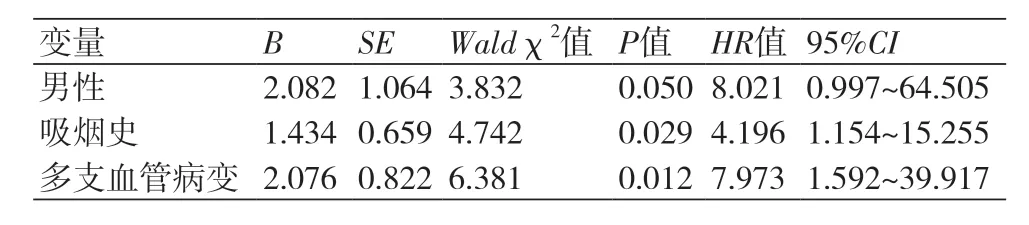
表4 NONTVR的多因素Cox回归分析结果
3 讨论
同既往研究[1,5-7],本研究发现将24 h按每2 h划分,在06:00~07:59期间出现AMI发生的一个高峰(13.27%);按每6 h划分,在06:00~11:59期间出现AMI发生的一个高峰(34.69%)。Kaplan-Meier生存曲线示出院后12个月内早晨组患者有更高的MACE累计风险,因心衰再次住院的累计风险,以及更高的NON-TVR发生率,多因素COX回归分析显示,AMI发生在06:00~11:59期间是AMI患者出院后12个月内因心衰再次住院的独立危险因素。
3.1 AMI的发生以早晨为高峰的机制AMI的昼夜节律以06:00~11:59为高峰,其可能的发生机制如下:血压的升高[12]、斑块破裂[13]、体内激素水平的昼夜变化[14]、纤维蛋白溶解活性的变化[15]、血小板聚集功能的变化[16]、血管内皮细胞的功能的变化等[17]。
3.2 两组患者临床基本资料差异的可能机制及其对预后的影响本次研究中两组患者基线资料相比,早晨组患者具有更低的BMI、更高的NLR、更短的DtoB时间、更少比例的患者具有吸烟史的特点,其余均无明显差异。既往研究表明肥胖是心血管疾病的危险因素[18],然而更多的研究表明AMI后肥胖患者的死亡率较低[19-21],即所谓的“肥胖悖论”。Ikeda等[22]研究发现AMI患者中BMI<25 kg/m2患者较BMI>25 kg/m2的患者在长期随访中有较高的主要不良心脏和脑血管事件(MACCE)的发生率,该研究的临床预后包括由全因死亡、卒中、靶血管血运重建、非致死性心肌梗死、再次住院等组成的主要不良心脏和脑血管事件。Sohn等[23]用MRI评估行PCI的STEMI患者心肌梗死面积大小发现:BMI≥25 kg/m2的患者较BMI<25 kg/m2的患者有更小的梗死面积和缺血面积。本研究中06:00~11:59期间发生的AMI患者有更低的BMI,但出院后12个月之内具有更高的因心衰再次住院的累计风险、更高的MACE累计风险及更多的患者行NON-TVR。AMI的患者出院后因心衰再次住院发生率与BMI的关系值得进一步探究。近年来中性粒细胞/淋巴细胞比值(NLR)作为一个炎症反应的标志物在心源性及非心源性疾病中逐渐引起人们重视,也是STEMI患者行PCI之后远期预后的一个预测因素[24,25]。Ayca等发现较高的NLR与支架内血栓形成及住院期间死亡率相关[26],Karakas等研究发现升高的NLR同升高的红细胞体积分布宽度与急性前壁心肌梗死行PCI后心脏收缩功能不全相关[27],Shin等发现NLR连同C-反应蛋白和AMI患者行PCI术后的长期死亡率相关[28],而此次研究中发现06:00~11:59期间发生的AMI患者有较高的NLR,伴出院后12个月之内具有更高的因心衰再次住院的累计风险、更高的MACE累计风险及更多的患者行NON-TVR。06:00~11:59期间发生AMI的患者较其他时间发生AMI的患者相比有更低比例的吸烟史,这与既往研究相一致[6,8,29],考虑吸烟患者AMI发生的昼夜节律不同于不吸烟患者。既往研究表明较长时间的DtoB时间与更差的预后相关[30],而本次研究中06:00~11:59期间发生的AMI有较短时间的DtoB时间,却有相对较差的临床预后,说明其中还有其他机制影响预后,需进一步探索。
3.3 AMI的发生时间与出院12个月之内预后的关系及可能的机制此次研究发现06:00~11:59期间发生的AMI患者出院12个月之内有较高的因心衰再次住院的累计风险。出院后心梗后心衰的机制有心肌损伤导致炎性级联反应的激活,包括早期中性粒细胞浸润,随后单核-巨噬细胞浸润,心梗后3~5 d后伴随纤维母细胞的活化和进展性的瘢痕形成逐渐由炎症反应转向修复过程[31]。随着时间发展,代偿性的RAAS系统激活和交感神经兴奋,心肌重构,心室几何结构发生改变,室壁变薄,瓣膜反流和进一步的心肌细胞的丢失[32]。HORIZONS-AMI研究中发现AMI患者出院后2年之内发生心衰的危险因素有既往心梗、较低的EF值、女性、胰岛素治疗的糖尿病[33]。在 CARE和VALIANT研究中,AMI患者出院后发生心衰的危险因素有年龄、糖尿病、肾功能不全、较低的EF值及入院Killip分级≥Ⅱ级[34,35]。此次研究发现06:00~11:59期间发生的AMI患者出院12个月之内有较高的因心衰再次住院的累计风险,且AMI发生在06:00~11:59期间是AMI患者出院后因心衰再次住院的一个独立危险因素。Barneto和Suarez-Barrientos等研究发现发生在06:00~12:00期间的STEMI比其他时间发生的AMI有更大的心肌梗死面积[36,37]。由于AMI后心梗面积与临床不良结局密切相关,其中包括心梗后心衰[38],本研究发现06:00~12:00期间发生的AMI较其他时间发生的AMI有更高比例患者因心衰再次住院,考虑与06:00~12:00期间发生的AMI心梗面积较大有,其进一步机制需进一步探究。
同既往关于A M I 的昼夜节律与预后之间关系的研究相比:Nakashima等则研究发现06:00~11:59期间发生AMI的患者较其他时间发生AMI的患者有更高的ACS复发率[6],而本研究发现两组患者之间复发ACS的发生率无明显差异,Yudi等[39]在研究中发现AMI后再次发生ACS的独立预测因素有冠脉旁路移植术、心衰、女性、多血管病变、射血分数在30%~45%之间、既往PCI术后和糖尿病,而本次研究排除了既往冠脉旁路移植术后、既往PCI的患者,且两组患者在EF值、住院期间发生的心衰、多血管病变、糖尿病方面均无差异,可能导致此次研究发现患者出院后再次ACS的累积发生率无明显异常。
3.4 研究的局限性 此次研究主要发现06:00~11:59期间发生的AMI患者出院12个月之内有较高的因心衰再次住院的累计风险,且AMI发生在06:00~11:59期间是AMI患者出院后因心衰再次住院的一个独立危险因素。故AMI患者出院前应早期识别这些易发生心衰的危险人群,并给予全面的药物治疗及心脏康复治疗,加强随访,及时处理出现的不良事件。本研究的不足:本研究平均随访时间22.56±8.924个月,做整体Kaplan-Meier生存曲线分析时由于两组曲线交叉,以交叉点为界,仅做了12个月之内的临床结局的分析;样本量偏小,随访时间较短,失访率较高,研究结果有待大规模临床试验证实;本研究为单中心的研究,部分临床资料具有片面性,可能会影响结论;临床结局除了参考患者再次住院的病历资料,未再次住院的患者通过电话随访询问患者家属或本人,对于再发ACS、出院后发生心衰的定义等会产生偏差,导致结论的偏差。应完善随访系统,加强出院患者的随访,扩大样本量,以便以后的研究。

