血小板参数、血脂水平与冠心病PCI术后氯吡格雷抵抗的相关性
刘倩倩 王海明 瞿秀敏 韩书光 陈聚盛 鲁作华
上海市浦东新区公利医院检验科,上海 200135
双联抗血小板治疗是保障PCI术后血管再通效果的重要措施。但临床研究发现,采用双联抗血小板治疗的PCI术后患者发生栓塞事件或再缺血事件的占比仍高达20%~27%[1]。有研究发现氯吡格雷在部分患者中无法取得理想抗血小板效果,而该部分人群占比约为5%~35%[2]。Muller等[3]的研究将服用600 mg氯吡格雷4h后腺苷二磷酸诱导检测血小板抑制率<30%为氯吡格雷抵抗。氯吡格雷抵抗患者不良结局发生率高于非抵抗患者已得到临床证实[4]。而氯吡格雷抵抗的发生也被发现与遗传、基础疾病、肿瘤、药物作用等多种因素相关[5]。本次研究分析了包括血脂水平、血小板参数在内的多类临床资料对氯吡格雷抵抗的影响作用,以期为抗血小板治疗方案调整提供依据。
1 资料与方法
1.1 一般资料
选取医院2016年7月至2019年5月收治的行PCI术治疗的冠心病患者进行研究。入组标准:符合《中国经皮冠状动脉介入治疗指南(2016)》[6]诊断标准和介入指征;抗血小板治疗方案一致;依从性好;自愿入组参与研究;排除标准:合并血液系统疾病;NYHA分级为Ⅳ级;合并肝肾功能不全或急慢性肝肾功能疾病;入组前30 d内接受大手术或深部穿刺;入组前30 d内服用甾体或非甾体类抗炎药物;氯吡格雷过敏;哺乳期或妊娠期妇女;服用其他非研究相关口服抗凝药。最终共有168例患者纳入研究,男性患者113例,女性患者55例,年龄39~73岁,平均年龄(62.07±12.43)岁。
1.2 治疗方案
入组患者均采用双联抗血小板治疗,氯吡格雷(赛诺菲(杭州)制药有限公司,国药准字J20180029)75 mg/d,阿司匹林(拜耳医药保健有限公司,国药准字J20171021)100mg/d,连续服用5 d以上。术后继续服用两种药物治疗,剂量不变。
1.3 研究方法
考虑普通肝素、糖蛋白Ⅱb/Ⅲa受体拮抗剂等药物代谢规律,在术后36 h后采集5 mL外周静脉血进行检验。检验仪器为英诺华血凝分析仪,按仪器说明书分别添加腺苷二磷酸、花生四烯酸、凝血酶、纤维蛋白原并描述相应添加剂诱导凝血块强度。抑制率=(腺苷二磷酸诱导凝血块强度—纤维蛋白原诱导凝血块强度)/(凝血酶诱导凝血块强度—纤维蛋白原凝血块强度)×100.00%。参照文献报道,将血小板抑制率≤30%归为抵抗组,>30%归为敏感组。
1.4 统计学分析
数据采用SPSS18.0进行分析,计数资料以[n(%)]表示,并采用χ2检验,计量资料以(±s)表示,并采用t检验,有意义的因素采用Binary Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
抵抗组糖尿病患者占比高于敏感组,差异有统计学意义(P<0.05)。其余一般资料比较差异均无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
2.2 两组患者血小板参数比较
抵抗组PLT及MPV高于敏感组,差异有统计学意义(P<0.05)。PDW及PCT组间比较差异无统计学意义(P>0.05)。见表2。
表2 两组患血小板参数比较(±s)
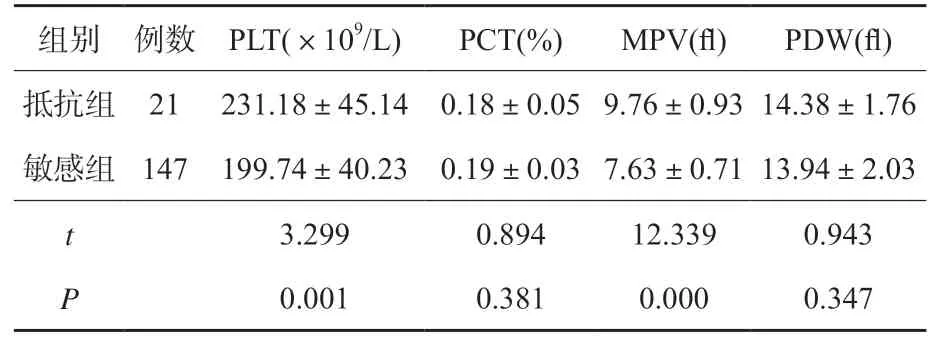
表2 两组患血小板参数比较(±s)
2.3 两组患者血脂水平比较
抵抗组LDL-C高于敏感组,差异有统计学意义(P<0.05)。其余血脂指标比较差异无统计学意义(P>0.05)。见表3。
表3 两组患血脂水平比较(±s)

表3 两组患血脂水平比较(±s)

表4 影响氯吡格雷抵抗的多因素回归分析
2.4 影响氯吡格雷抵抗的多因素回归分析
Binary Logistic回 归 发 现,PLT、MPV及LDL-C是冠心病PCI术后氯吡格雷抵抗的独立危险因素(P<0.05)。见表4。
3 讨论
氯吡格雷具有耐受性强、起效迅速、药效好等优势,在临床抗血小板治疗中得到广泛应用。但氯吡格雷在部分患者中也被发现未能有效抑制血小板凝集。目前文献报道的氯吡格雷抵抗发生率为5%~35%[7]。本次研究中21例患者发生氯吡格雷抵抗,发生率为12.50%,与文献报道相符。多项研究显示,氯吡格雷抵抗患者心血管事件发生率高于非氯吡格雷抵抗患者,氯吡格雷抵抗是冠心病患者心血管事件的重要预测因素[8-9]。因此,早期筛查氯吡格雷抵抗、及时调整治疗方案有助于改善PCI术后患者预后。影响氯吡格雷抵抗的因素目前尚不明确,主要有竞争性代谢、剂量不足、依从性差、吸收障碍等方面影响机制[10]。本次研究主要观察血小板参数和血脂水平与氯吡格雷抵抗的相关性。他汀类药物是经CYP3A4途径竞争代谢的主要药物,本次研究中两组患者他汀类药物使用情况无明显差异,敏感组与抵抗组患者数据具有可比性。
数量及活性参数是影响血小板聚集功能的主要因素[11]。本次研究结果显示,PLT、MPV是冠心病PCI术后氯吡格雷抵抗的独立危险因素。PLT直接反应血小板数量,其表达水平增高直接影响血小板聚集功能,导致氯吡格雷抵抗的发生。MPV是指血小板平均体积,其水平越高表示患者血小板体积越大。而随着体积增大其包含的致密颗粒更多,血小板活性越强[12]。还有研究发现,Ⅱb/Ⅲa受体、血小板膜糖蛋白Ⅰb及血栓素A2等促血小板聚集因子水平随MPV水平增高而增高[13]。因此推测MPV可能通过影响促血小板聚集因子表达水平增高进而诱发氯吡格雷抵抗。PDW和PCT与PLT、MPV密切联系,其中PDW是血小板容积大小离散程度的体现,PCT是全血中血小板容积百分比[14]。但本次研究中未发现敏感组与抵抗组PDW和PCT水平存在差异,可以认为两者对冠心病患者PCI术后氯吡格雷抵抗无明显影响,但具体结论有待进一步大样本量研究加以明确。
研究结果显示,LDL-C是冠心病PCI术后氯吡格雷抵抗的独立危险因素。有研究发现,血小板表面具有特异性脂蛋白结合位点,而ox-LDL和LDL-C可与该位点特异性结合激活血小板[15]。LDL也被发现可作用于磷脂酶A2途径刺激血小板释放和诱导血小板聚集[16]。还有研究证实,单纯LDL-C浓度高水平刺激也可直接诱导血小板聚集作用增强,推测该过程由LDL-C作用于磷脂酶C途径实现[17]。本次研究中发现抵抗组患者LDL-C水平高于敏感组,回归分析也显示其表达水平与氯吡格雷抵抗的发生紧密相关。这可能与LDL-C水平增高后诱导血液呈现高凝状态有关,血管内皮功能损伤,抗血小板功能下降,进而诱发氯吡格雷抵抗。该结果提示对于冠心病PCI术后患者在采用氯吡格雷治疗时应密切关注LDL-C水平变化情况,并通过针对性治疗将患者血脂控制在合理水平,以有效改善患者血小板抑制率。
本次研究中抵抗组糖尿病患者占比高于对照组,可能对研究结果有一定影响,但回归分析并未发现其与冠心病PCI术后氯吡格雷抵抗相关。糖尿病是血栓前状态,可通过P2Y12途径影响胰岛素对血小板活化的抑制作用,导致患者对氯吡格雷抵抗性增强[18]。同时,糖尿病的慢性炎症和氧化应激反应长期刺激损伤血管内皮细胞,进而导致抗血小板药物作用下降。本次研究结果可能与样本量较小有关,无法体现统计学意义。综上所述,PLT、MPV及LDL-C与冠心病PCI术后氯吡格雷抵抗紧密相关,可作为初步筛查氯吡格雷抵抗的参考。

