铜胁迫对黄芪幼苗的生理学毒性与凹凸棒黏土的缓解作用
赛闹汪青,冉瑞兰,张牡丹,曹佳鑫,冯汉青,庞海龙,贾凌云
铜胁迫对黄芪幼苗的生理学毒性与凹凸棒黏土的缓解作用
赛闹汪青,冉瑞兰,张牡丹,曹佳鑫,冯汉青*,庞海龙,贾凌云
(西北师范大学生命科学学院,甘肃 兰州 730070)
为探究黄芪幼苗对铜离子(Cu2+)胁迫的耐性机理以及凹凸棒黏土对Cu2+污染的缓解作用,研究了不同浓度CuSO4(2~20mmol/L)胁迫对黄芪幼苗的生理学毒性与凹凸棒黏土的缓解作用.结果表明,2mmol/L CuSO4胁迫使得根系Cu2+含量、H2O2(过氧化氢)含量、MDA(丙二醛)含量分别较对照显著上升1.82倍、1.04倍、2.14倍. CuSO4胁迫浓度达8mmol/L时,根系SOD(超氧化物歧化酶)活性、根尖膜损伤程度和叶片Cu2+含量分别较对照显著上升1.13倍、1.12倍和2.62倍;同时,叶片PS Ⅱ(光系统II)实际光化学效率[Y(II)]、光化学淬灭系数(qP)、PS Ⅱ电子传递速率(ETR)和叶绿素含量较对照分别显著降低22.88%、24.44%、21.49%和28.31%,而NPQ和qN (非光化学荧光猝灭系数)则较对照分别显著上升2.35倍和1.58倍.根系 POD(过氧化物酶)和 CAT(过氧化氢酶)活性、可溶性糖和可溶性蛋白含量在8mmol/L CuSO4处理下达到最高值后呈下降趋势. CuSO4浓度为15~20mmol/L时,根系APX活性和叶片光适应下PS II潜在最大光化学效率(v¢/m¢),以及幼苗全株鲜重、全株干重、地下部鲜重、地下部干重较对照显著下降.在非CuSO4胁迫条件下,基质中凹凸棒黏土的存在使得幼苗根系MDA含量较对照显著降低15.93%,但未对其它所测生理学指标产生显著影响;在20mmol/LCuSO4胁迫条件下,基质中凹凸棒黏土的存在使得幼苗根系和叶片中Cu2+含量分别显著下降30.78%和23.12%;同时显著缓解了20mmol/LCuSO4胁迫对根系活性氧水平、抗氧化酶活性、膜脂质过氧化程度、根尖膜损伤程度、可溶性蛋白和可溶性糖含量,叶片PS II光化学活性和叶绿素含量的不良影响,以及对幼苗生长的抑制作用.研究结果表明,培养基质中凹凸棒黏土的存在能够显著降低幼苗组织中Cu2+的生物有效性,继而缓解CuSO4胁迫对黄芪幼苗的生理学毒性作用.
铜离子;黄芪幼苗;凹凸棒黏土;缓解
随着工业含铜离子(Cu2+) “三废” 和垃圾排放量的增加,以及含Cu2+饲料添加剂和杀菌剂在农业生产中的广泛使用,使得环境Cu2+污染问题日益严重.已有研究表明,Cu2+胁迫会诱导植物体内活性氧(ROS)过量积累,破环植物体内活性氧代谢动态平衡,损伤光合细胞器,影响植物原初光化学反应和PS II光合电子传递,进而导致植物体水分代谢,光合作用,呼吸作用等各种生理代谢发生紊乱[1-4].
黄芪(.)为我国主要常用药用植物之一;近年来,黄芪人工栽培量不断增加,但农药残留、重金属含量超标等问题严重限制黄芪产量的提高和品质的绿色发展[5].目前,尽管针对单一黄芪产地土壤Cu2+污染和黄芪药用部分Cu2+含量超标的报道极少,但是研究指出我国甘肃等 27省、自治区和直辖市道地药材产地中黄芪等8种中药材Cu2+超标率达11.10%,而且Cu2+污染情况因产地不同而呈现一定的差异[6];现有药用植物栽培基地多数都是在传统农田基础上改造形成,这些农田在传统的生产中存在使用污水灌溉和施用 Cu2+基农药等现象[7].当植物体病害发生时,农民可能通过提高重金属基农药如波尔多液(Cu2+浓度达1.5g/L[8])等的施加量和施用次数来缓解和控制病害对植物的不良影响,这导致植物处于一种短期高浓度重金属离子胁迫状态[4].此外,研究指出在某些重金属污染区域如遇暴雨等极端天气将会导致大量Cu2+等重金属离子通过水体等媒介进入植物体培养基质,继而使植物体处于一种短期高浓度重金属离子胁迫状态[9].因此,控制栽培基质中Cu2+的生物有效性,最大程度减少其向植物药用部分转移是一个亟待解决的问题.
凹凸棒黏土(Attapulgite,APT)为具独特层链状多孔结构的天然非金属黏土矿物(图1),其储量丰富、价格低廉[10-11].研究发现, APT作为植物栽培基质外源添加剂能够有效改善基质团粒结构、提高持水量,优化植物体生长,并且对作物连作诱发的自毒作用具有良好的修复作用[12-14].此外,因APT优越的胶体和吸附性质,能够诱导环镜中重金属离子发生水解沉淀,通过正负电荷胶体颗粒的相互作用等途径吸附和络合基质中的重金属离子[15-16];在受重金属污染的栽培基质中添加APT能够显著提高栽培基质 pH 值、阳离子交换量和基质细颗粒含量,并且显著减少植物对重金属离子的富集程度,同时抑制植物对Zn和Ni等重金属的吸附[17].因此, APT有望作为栽培基质的外源添加剂,进一步优化植物体的生长,并且在栽培基质受到重金属污染时减少重金属污染对药用植物生长的不良影响.
本文探究了不同浓度CuSO4胁迫对黄芪幼苗生理学特性和生长的影响,以及培养基质中APT的存在对缓解黄芪幼苗受CuSO4胁迫的影响,以期丰富Cu2+对黄芪幼苗作用机理研究,拓展APT在药用植物栽培领域的应用,为预防黄芪苗期遭受重金属污染提供一定的借鉴和参考.
1 材料与方法
1.1 植物材料的培养
取健康饱满的种子,浓硫酸处理[90%(/),浸泡2min],蒸馏水冲洗(30min)至表面无残留浓硫酸溶液,置于蒸馏水中浸泡12h,继而将种子置于90mm培养皿(铺有多层纱布且用蒸馏水浸湿,每皿放置50粒种子)中,在28℃、黑暗条件下进行萌发并观察萌发状况.选择萌发状态一致的种子(胚根突破种皮),点播至塑料盆钵[内为蛭石或APT:蛭石=1:80(/),盆钵外径90mm、高80mm]中,每盆点播6~7粒种子,然后置于培养室(昼夜温度:27℃/23℃,湿度:(40±3)%,光照强度:(150±5)μmol/(m2·s),光照周期:12h光照/ 12h黑暗)进行培养;待幼苗长至两叶一芯时开始每周施加(根施)一次1/2Hoagland营养液,其余时间施加蒸馏水以确保幼苗生长所需的水肥充足.幼苗生长至四叶一芯时(自培养皿移栽至盆钵30d),选取长势基本一致幼苗进行实验.
1.2 材料处理及方法
第一组实验:选取生长于蛭石中的黄芪幼苗,分别用2,8,15,20mmol/L的CuSO4溶液施加于培养基质中,对照组施加等量蒸馏水,在培养室培养24h后进行生理学指标的测量.
第二组实验:选取生长于蛭石或APT:蛭石=1:80(/)中的黄芪幼苗,用20mmol/L的CuSO4溶液施加于基质中,对照组施加等量蒸馏水,继而在培养室培养24h后进行生理学指标的测量.

图1 APT扫描电镜成像
1.3 Cu2+ 含量的测定
黄芪幼苗根系与叶片分离,将根系置于10mmol/L乙二胺四乙酸(EDTA)中15min,用去离子水将根系表面杂质洗净,用滤纸吸干表面水分,继而将根系和叶片在70℃烘干48h至恒重,最后将植物样品用70%(/) HNO3消解,通过电感耦合等离子体—原子发射光谱法测定Cu2+含量[18].
1.4 生长指标测定
取不同处理组植株,用蒸馏水反复冲洗3次,然后用滤纸吸干水分,测定全株鲜重(根茎叶混合)、地下部(根系)鲜重;同时,拍照记录,用ImageJ 2.1.4.7软件测量根长及株高.然后将鲜植株置于烘箱105℃杀青20min,75℃烘干至恒重,称全株干重和地下部干重[19-20].
1.5 可溶性蛋白、可溶性糖含量的测定
用去离子水将黄芪幼苗根系表面杂质洗净,用滤纸吸干表面水分,继而置于研钵中加入3mL蒸馏水研磨成匀浆,离心(8000r/min,10min),静置1h,取1mL上清液,加入5mL考马斯亮蓝G-250试剂充分混匀,静置2min后,记录595nm处吸光值,根据标准曲线计算蛋白含量,单位为mg/gFW[4].
黄芪幼苗根系(鲜样)加入4mL 80%(/)乙醇,研磨至匀浆,80℃水浴30min,离心(5000r/min,10min),取上清液(1mL)与5mL蒽酮(将150mg蒽酮溶于100mL 80%(/)硫酸中)混合,沸水浴中10min,记录620nm处吸光值,根据标准曲线测定可溶性糖的含量,单位为mg/gFW[21].
1.6 过氧化氢(H2O2)含量的测定、抗氧化酶(SOD、POD、CAT、APX)活性与丙二醛(MDA)含量的测定
参照文献[22]所报道方法,取黄芪幼根加入1mL 0.1%(/)的三氯乙酸(TCA),研磨至匀浆,离心(12000r/min,10min);取0.7mL上清液,加入0.7mL磷酸缓冲液(PBS,10mmol/L, pH值7.0)和1.4mL碘化钾[KI, 1mol/L,用PBS (10mmol/L、pH值7.0)配制],记录390nm处吸光值,并根据标准曲线计算过氧化氢含量,单位为μmol/gFW.
SOD(超氧化物歧化酶)活性的测定采用氮蓝四唑(NBT)法进行,SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位(U/mg FW·min); POD(过氧化物酶)活性测定采用愈创木酚法进行,POD活性以每分钟内A470变化0.01为1个POD活性单位[U/(mgFW·min)];CAT(过氧化氢酶)活性采用紫外分光光度法进行,CAT活性以1min内A240减少0.1为1个CAT活性单位[U/(mgFW·min)]; APX(抗坏血酸过氧化物酶)活性的测定采用紫外分光光度法进行,以2min内A290的变化计算APX活性[U/(mgFW·min)][23].
参照文献[24]所报道的硫代巴比妥酸法进行MDA含量的测定,如式(1):
MDA(μmol/L)=6.45×(A532-A600)-0.56×A450 (1)
再将样品提取液中MDA浓度换算为植物单位质量中MDA的含量,单位为μmol/g FW.
1.7 根尖膜损伤程度的测定
根尖膜损伤程度的测定参照文献[25]等报道的伊文思蓝染色法进行.
1.8 叶片叶绿素荧光参数与叶绿素含量的测定
采用叶绿素荧光成像仪(PAM-2500Waltz, Germany),参照文献[4]所报道的方法进行叶绿素荧光参数的测定:v¢/m¢为光适应下PS II潜在最大光化学效率;Y(II)为PS II实际光化学量子效率,反映PS II反应中心的原初光能捕获效率;qP为光化学淬灭系数,反映PS II反应中心的开放程度和电子传递活性;ETR为PS II的相对电子传递速率;NPQ为非光化学淬灭系数,表征PS II反应中心吸收过量光能后的热耗散能力以及光合机构的损伤程度.
取剪碎的黄芪去叶脉叶片,加入3mL 80%(/)的丙酮,于4℃冰箱密闭遮光放置24h以上,待叶片完全变白为止,于663、645nm下测定吸光值,计算叶绿素浓度,再换算成质量(mg/gFW)[4].
1.9 统计学分析
以上测量取3次以上独立实验结果的平均值,并将数值表示为平均值±标准偏差(SD).使用Origin 9.0数据统计软件进行双总体检验和图表的绘制(差异显著,<0.05).
2 结果与分析
2.1 CuSO4胁迫下黄芪幼苗根系和叶片中Cu2+含量的变化
由表1可见,随着CuSO4胁迫浓度的增加,黄芪幼苗根系与叶片中Cu2+含量逐渐升高,并且呈现一定的剂量效应关系.此外,根系中Cu2+含量明显高于叶片.与对照相比,20mmol/LCuSO4胁迫24h后,根系和叶片中Cu2+含量相较对照分别显著提高了12.83倍和6.11倍.
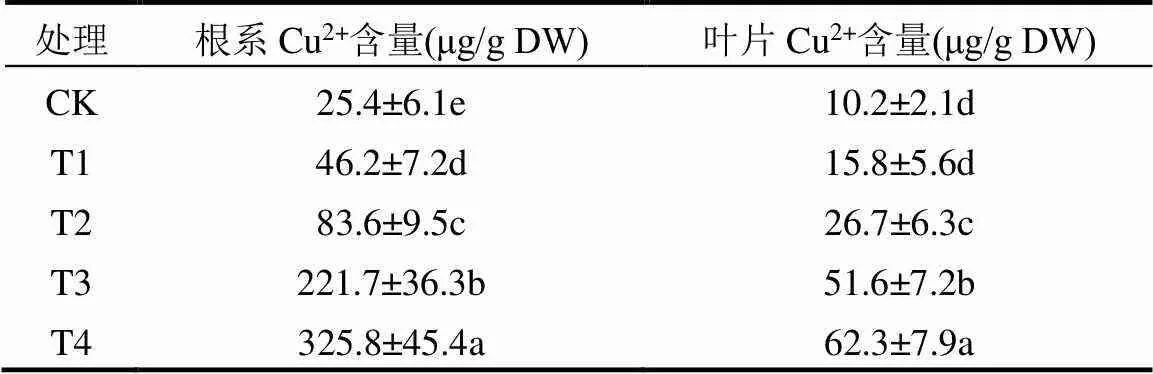
表1 CuSO4胁迫下黄芪幼苗根系与叶片中Cu2+ 含量的变化
注:数值为至少3次独立实验的平均值±标准差,不同字母表示每列各处理数值间在<0.05水平上存在显著性差异;CK:对照,T1: 2mmol/L CuSO4处理,T2:8mmol/L CuSO4处理,T3:15mmol/L CuSO4处理,T4:20mmol/L CuSO4处理,下同.
2.2 CuSO4胁迫对黄芪幼苗根系活性氧水平、抗氧化酶活性和膜损伤程度的影响
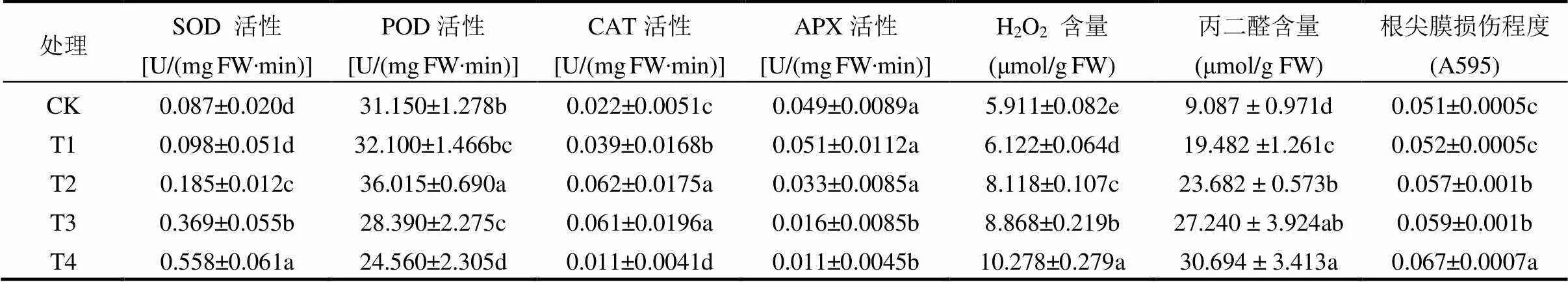
表2 CuSO4胁迫对黄芪幼苗根系过氧化氢含量、抗氧化酶活性、膜脂质过氧化程度及膜损伤程度的影响
与对照相比(表2),2mmol/L CuSO4胁迫处理未对黄芪幼苗根系SOD活性、POD活性、APX活性和根尖膜损伤程度造成显着影响,但是显著提高了CAT活性、H2O2和MDA含量.当CuSO4浓度达8mmol/L时,根系SOD活性、POD活性、CAT活性、H2O2含量、MDA含量和根尖膜损伤程度显著上升,但未对APX活性产生显著影响.随着CuSO4浓度的进一步升高,根系SOD活性、H2O2含量、MDA含量和根尖膜损伤程度进一步提高,而POD,CAT和APX活性则显著降低.与对照相比,20mmol/L CuSO4胁迫处理24h后,根系SOD活性、H2O2含量、MDA含量和根尖膜损伤程度较对照分别显著提高了6.41倍、1.73倍、3.37倍、1.31倍,而POD、CAT和APX活性则分别显著降低了21.15%、50.00% 和77.55%.
2.3 CuSO4胁迫对黄芪幼苗叶片PS II光化学活性和叶绿素含量的影响
与对照相比(表3),2mmol/L CuSO4处理未对黄芪幼苗叶片叶绿素荧光参数v'/m'、Y(II)、qP、ETR、NPQ和qN以及叶绿素含量造成显著影响.当CuSO4胁迫浓度达8mmol/L时,Y(II)、qP、ETR和叶绿素含量较对照显著降低,而叶片NPQ和qN水平则显著升高.随着CuSO4处理浓度进一步增加,叶片PS II 光化学活性和叶绿素含量进一步降低.相较对照组,20mmol/L CuSO4处理 24h 后,叶片v'/m'、Y(II)、qP、ETR和叶绿素含量较对照分别显著下降了13.04%、49.88%、43.76%、48.32%和46.98%,而NPQ 和 qN则分别显著提高了3.18倍和1.89倍.
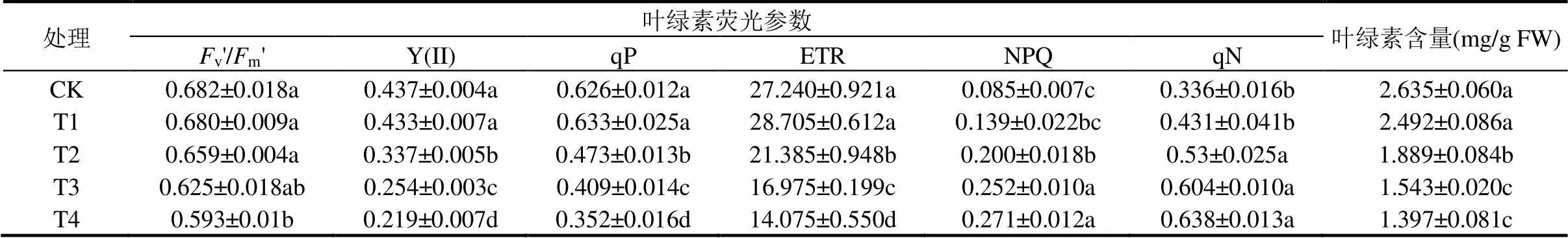
表3 CuSO4胁迫对黄芪幼苗叶片 PS II 光化学活性和叶绿素含量的影响
2.4 CuSO4胁迫对黄芪幼苗生长、根系可溶性蛋白和可溶性糖含量的影响
由表4可见,15~20mmol/L CuSO4处理使得黄芪幼苗全株干重和鲜重较对照显著降低;与对照相比,8~20mmol/L CuSO4处理使得地下部干重和鲜重显著降低;20mmol/L CuSO4胁迫24h后,黄芪幼苗全株干重、全株鲜重、地下部干重、地下部鲜重较对照分别显著下降了64.15%、61.19%、59.53%、71.42%;此外,与对照相比,2~ 20mmol/L CuSO4处理未引起幼苗株高和根长的显著变化.
相较对照组,2~8mmol/L CuSO4处理使得黄芪幼苗根系可溶性蛋白和可溶性糖含量显著上升,且在8mmol/L CuSO4处理下达最大值;其后随CuSO4胁迫浓度的进一步提高,可溶性蛋白和可溶性糖含量低于对照水平.20mmol/L CuSO4胁迫24h后,根系可溶性蛋白和可溶性糖含量较对照分别显著降低了71.67%和71.91%(表4).
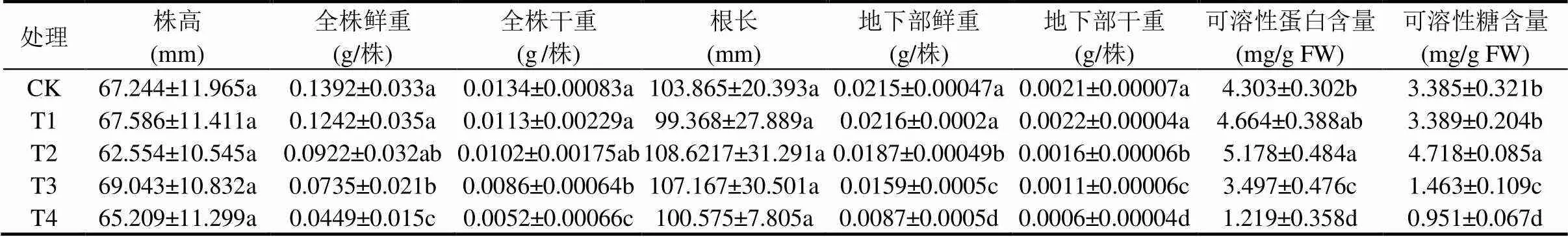
表4 CuSO4胁迫对黄芪幼苗生长、根系可溶性蛋白和可溶性糖含量的影响
2.5 CuSO4胁迫下APT对黄芪幼苗根系和叶片中Cu2+含量的影响
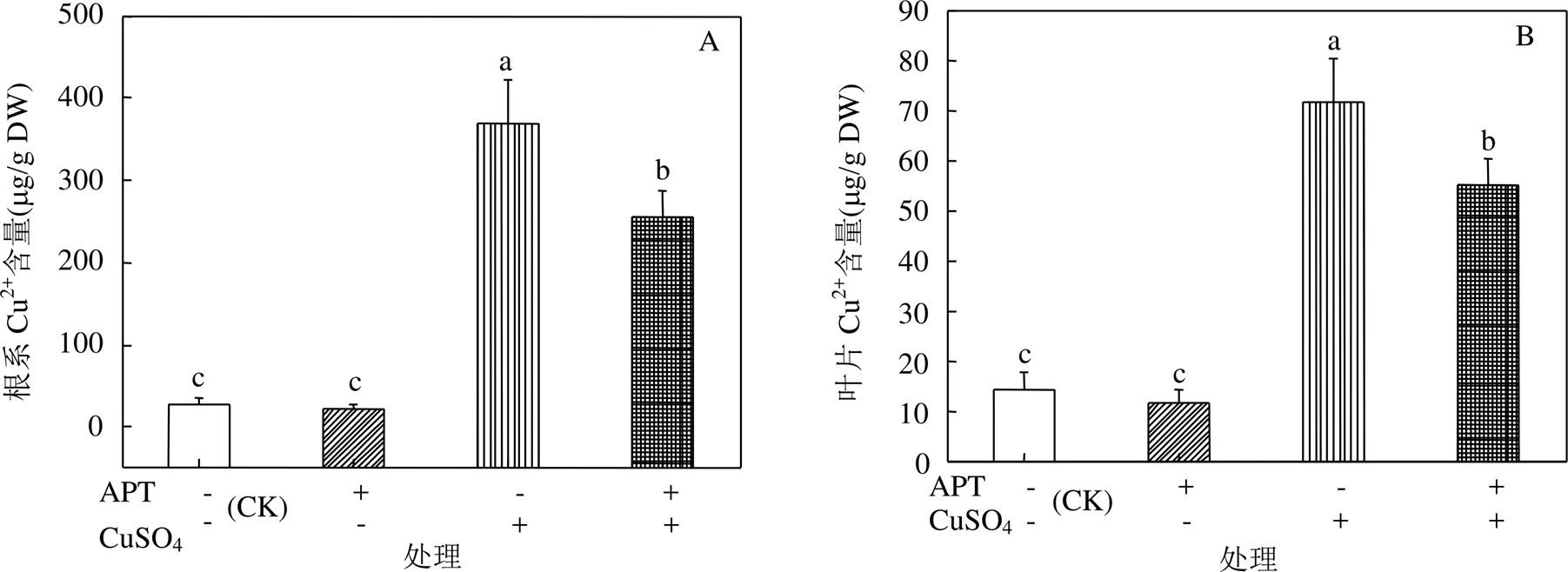
图2 CuSO4胁迫下APT对黄芪幼苗根系与叶片中Cu2+含量的影响
数值为至少3次独立实验的平均值±标准差,不同字母表示各处理数值间在<0.05水平上存在显著性差异;+或–表示基质中有无APT或CuSO4;下同
由图2A~B可见,20mmol/L CuSO4胁迫24h后,黄芪幼苗根系和叶片中Cu2+含量较之对照显著上升.与对照相比,基质中APT的存在未对幼苗根系和叶片中Cu2+含量造成显著影响;CuSO4胁迫条件下,基质中APT的存在则使得幼苗根系和叶片中Cu2+含量显著降低了30.78%和23.12%.
2.6 CuSO4胁迫下APT黄芪幼苗根系活性氧水平、抗氧化酶活性和质膜损伤程度的影响
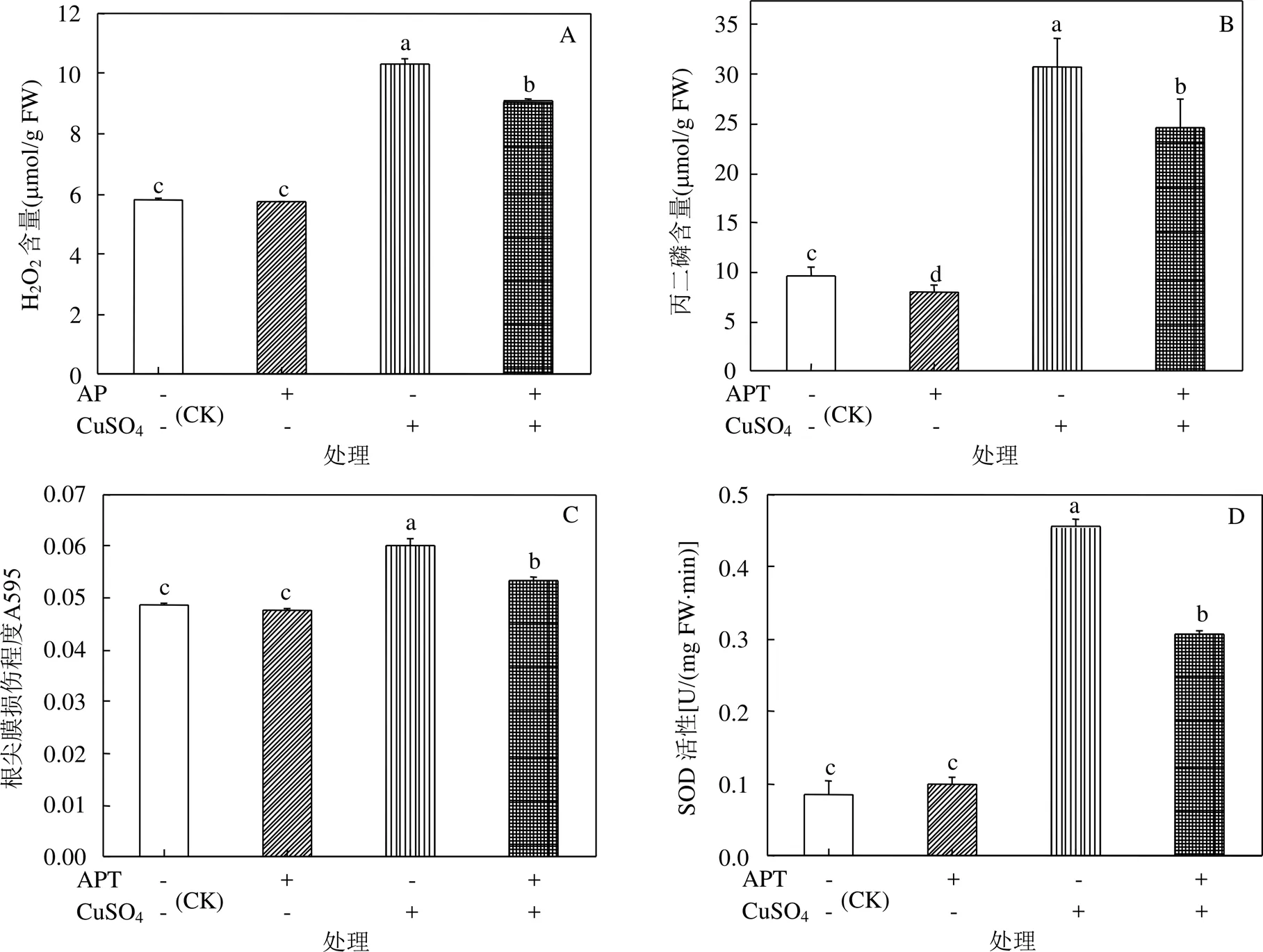
由图3A-G可见,与对照相比,基质中APT的存在未对黄芪幼苗根系H2O2含量,SOD、POD、CAT和APX活性以及根尖质膜损伤程度造成显著影响,但使得MDA含量显著降低了15.93%. 20mmol/L CuSO4胁迫条件下,基质中APT的存在使得幼苗根系H2O2含量、MDA含量、根尖质膜损伤程度和SOD活性分别显著降低了12.07%、19.74%、11.62%和32.79%,而POD、CAT和APX活性则分别显著提高了1.26倍、3.33倍和2.25倍.
2.7 CuSO4胁迫下APT对黄芪幼苗叶片PS II光化学活性和叶绿素含量的影响
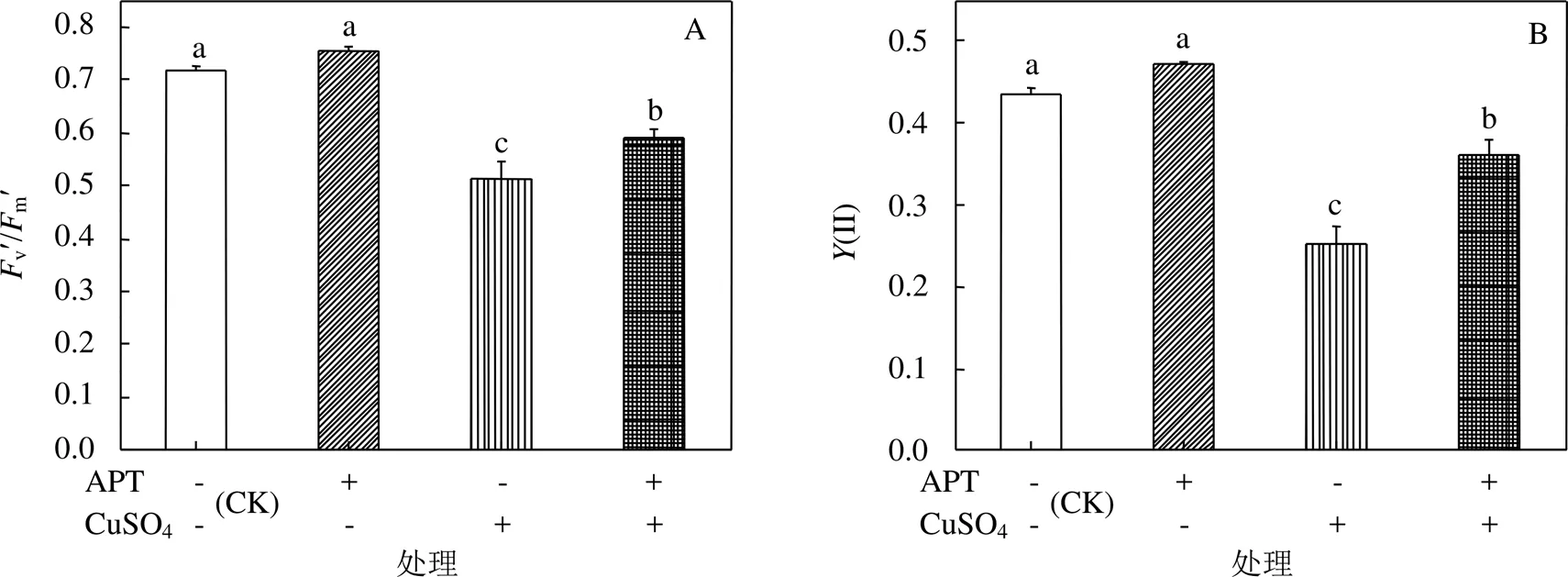
由图4A~G可见,基质中APT的存在未对黄芪幼苗叶v'/m'、Y(II)、qP、ETR、qN、NPQ及叶绿素含量造成显著影响.20mmol/L CuSO4胁迫下,基质中APT的存在使得叶片v'/m'、Y(II)、qP、ETR、叶绿素含量分别显著提高了1.15倍、1.43倍、1.28倍、1.49倍和1.28倍,而qN和NPQ则分别显著下降了12.77%和27.59%.
2.8 CuSO4胁迫下APT黄芪幼苗生长、根系可溶糖和可溶性蛋白含量的影响
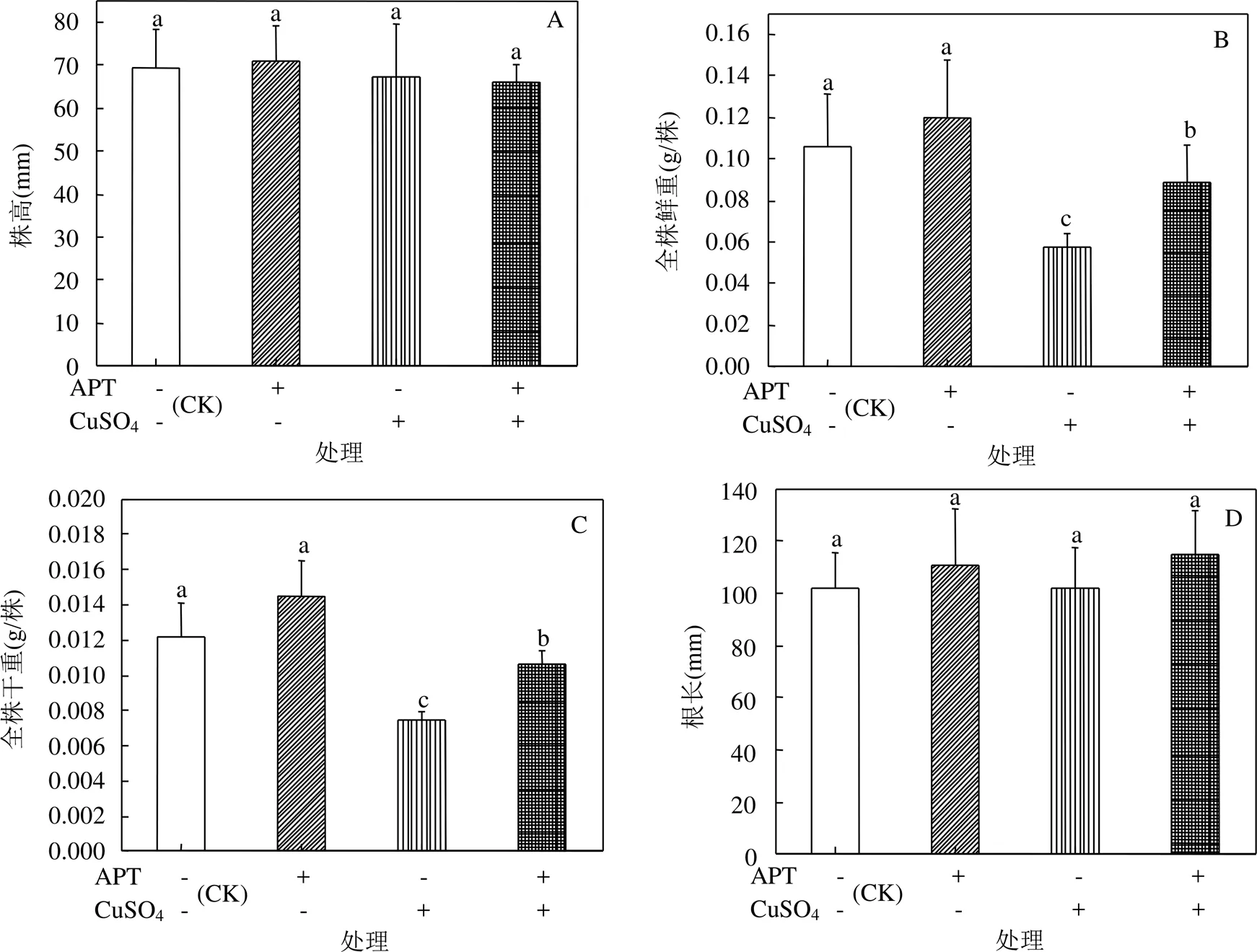
与对照相比,基质中APT存在使得幼苗全株鲜重、全株干重、地下部鲜重、地下干重、根系可溶性蛋白和可溶性糖含量虽有一定程度的提高,但影响不显著(图5B-C, E-H).20mmol/L CuSO4胁迫条件下,基质中APT的存在使得幼苗全株鲜重、全株干重、地下部鲜重、地下部干重、根系可溶性蛋白和可溶性糖含量分别显著提高了1.53倍、1.42倍、1.63倍、1.37倍、2.34倍和1.50倍(图 5B-C, E-H).然而,不同处理之间黄芪幼苗株高和根长较对照组未发生显著变化(图5A,D).
3 讨论
Cu2+作为植物体必需的微量元素和许多生化酶的组成成分,低浓度下有利于植物体的生理代谢,而高浓度Cu2+对植物体具有一定的毒性[26].已有研究表明,Cu2+对植物体的毒害作用主要表现为通过Fenton或Haber-Weiss反应或刺激NAPDH氧化酶诱导ROS的产生[27],ROS的过量积累,会对植物体产生氧化胁迫,继而造成细胞膜质过氧化,生物膜透性增大,甚至生长抑制;而SOD,POD,CAT,APX作为植物体活性氧清除系统中的关键酶,能防止ROS引起的膜脂质过氧化,保护细胞膜系统免受氧化胁迫的损伤;同时,其活性的变化也是表征植物氧化胁迫的重要指标[28].在本实验中,随着CuSO4胁迫浓度的增加,幼苗根系(植物体接触环境胁迫因素的最初器官,也是黄芪主要的药用部位)Cu2+含量显著上升并呈现一定的剂量效应关系(表1);同时,根系H2O2含量、MDA含量、根尖膜损伤程度和SOD活性逐渐升高;POD和CAT活性随着CuSO4胁迫浓度的增加呈现先升高后降低趋势,其活性在8mmol/L CuSO4胁迫处理下达最大值;APX活性则随着CuSO4胁迫浓度的提高而降低(表2).这表明:1)幼苗根系Cu2+含量的提高,使得H2O2过量积累,对幼苗根系造成了氧化胁迫,继而导致根系细胞膜透性增大;2)H2O2的过量积累使得幼苗通过启动体内抗氧化酶防御系统来提高对Cu2+胁迫环境的抗性.研究表明,Cu2+对抗氧化酶活性的影响可能同时表现为促进和抑制两个方面[29].一方面,Cu2+通过提高抗氧化酶在转录水平的表达,诱导同工酶的表达,以及对酶蛋白结构进行加工与修饰等途径,提高酶的活性;另一方面,Cu2+胁迫下ROS的过量积累会通过破坏DNA、RNA和蛋白质的结构,继而破坏抗氧化酶的表达系统和结构,造成酶活性降低.因此,推测本实验中SOD,POD,CAT活性的提高可能与幼苗根系适应Cu2+诱导ROS增加有关,而随着CuSO4胁迫浓度的提高POD,CAT以及APX活性下降则可能是细胞中过量Cu2+可能直接作用于酶蛋白或影响基因表达的结果.此外,可溶性蛋白和可溶性糖作为植物体的主要构成组分之一,是植物体进行新陈代谢的主要原料和贮存物质,其含量是评价植物总代谢水平的重要指标;同时,可溶性蛋白和可溶性糖也是植物体应对逆境的重要渗透调节物质[30-31].研究发现,逆境条件下植物体内可溶糖和可溶性蛋白含量的提高与其参与ROS 清除有关[32-33],而在本实验中我们发现其含量的变化并未与ROS变化趋势保持一致,具体表现为幼苗根系可溶性蛋白与可溶性糖含量在CuSO4胁迫为8mmol/L时达最大值,其后随着CuSO4胁迫浓度的上升,可溶性蛋白与可溶性糖含量下降至低于对照水平(表4).这表明当CuSO4胁迫浓度低于8mmol/L时,幼苗通过调节根系可溶性蛋白与可溶性糖含量来维持幼苗根系细胞渗透浓度和保水力,继而提高幼苗对Cu2+胁迫环境的抗性,而当CuSO4浓度超过8mmol/L时,CuSO4胁迫可能造成了对可溶性蛋白与可溶性糖合成部位的不可逆损伤.
研究表明,根系中过量的H2O2会被转移至叶片中,对叶片造成氧化胁迫,继而导致光合作用能力下降[29],而PS II光化学活性的变化可以积极反映环境因素对植物体光合作用内在过程造成的影响[4].因此,本研究探究了CuSO4胁迫对黄芪幼苗叶片PS II光化学活性和叶绿素含量的影响.研究发现,随着幼苗叶片中Cu2+水平的提高,叶片PS II光化学活性被显著抑制,具体表现为随CuSO4胁迫浓度的升高,叶片v'/m'、Y(II)、qP 和 ETR 显著降低,而qN和NPQ则显著升高(表1,3),表明CuSO4胁迫使黄芪幼苗叶片PS Ⅱ容量下降,对光能的吸收和运行效率降低,PS Ⅱ接受和传递电子的能力下降,同时用于光化学反应的光能比例减少,而以热的形式耗散掉的比例显著增加.前人的研究表明,过量的Cu2+会通过改变植物体PS II氧化侧或PS II还原侧一些电子传递相关蛋白的结构,破环PS II电子正常传递[34-36],继而导致PS II光化学活性降低.因此,CuSO4胁迫可能通过上述机制引起了幼苗叶片叶绿素荧光参数的变化.此外,研究发现[1,37]过量的 Cu2+会干扰与叶绿素生物合成有关的酶活性,造成叶绿体内膜结构遭破坏,叶绿素氧化分解加快,从而降低植物PS II光化学活性;研究指出,Cu2+能够取代叶绿体中蛋白质上的Fe2+或Mg2+来破坏叶绿体的结构和功能,造成叶绿素的降解,从而导致PS II对光能利用率的降低,造成光抑制的发生[38].本研究结果表明,随着CuSO4胁迫浓度的提高,幼苗叶片叶绿素含量显著下降(表3),这说明CuSO4胁迫下幼苗叶片PS II光化学活性降低是Cu2+对PS II中电子传递体的功能以及叶绿素含量综合作用的结果.
植物幼苗期生物量的变化是判断种苗生长状况的重要指标,而Cu2+胁迫对幼苗产生的氧化压力以及对光合作用的抑制,最终将引起幼苗生长抑制.本实验发现,15~20mmol/LCuSO4胁迫24h后,黄芪幼苗全株鲜重和干重以及地下部干重和鲜重显著下降,说明该浓度范围内CuSO4胁迫引起了黄芪幼苗的生长抑制;而在受试CuSO4胁迫浓度范围(2~20mmol/L),黄芪幼苗生长指标(株高和根长)未受明显影响,推测可能与CuSO4胁迫时间过短有关(表4).
上述研究结果表明,CuSO4胁迫提高了黄芪幼苗根系和叶片中Cu2+含量,诱导了幼苗根系ROS过量积累,干扰了根系抗氧化酶正常活性水平,破环了根系细胞膜系统完整性,降低了叶片PS II光化学活性和叶绿素含量,最终影响了幼苗生长.已有研究表明, APT能够有效改善基质团粒结构,增加基质保水透水能力,并且能够通过阳离子交换、表面络合、静电作用等多种形式吸附环境中游离的Cu2+[12-17].本实验结果表明,非CuSO4胁迫条件下,基质中APT的存在显著降低了根系膜脂质过氧化程度(图3B),但未对其它所测生理学指标产生显著影响,推测这可能是APT优异的物理化学性质使得黄芪在幼苗生长阶段的代谢废物被有效吸附且在一定程度上增强了栽培基质的通气性和透水性所致;在20mmol/LCuSO4胁迫下,基质中APT的存在使得黄芪幼苗根系和叶片中的Cu2+含量显著降低,继而缓解了CuSO4胁迫对黄芪幼苗的生理学毒性作用(图2-5),这表明CuSO4胁迫下APT对黄芪幼苗生理学代谢的保护作用归因于其降低了组织中Cu2+的生物有效性.
4 结论
4.1 2mmol/L CuSO4胁迫24h后显著提高了黄芪幼苗根系Cu2+水平,并且使得根系H2O2含量和丙二醛含量也显著上升,说明Cu2+胁迫对黄芪幼苗的早期毒害响应主要为诱导ROS的过量积累.在CuSO4胁迫浓度达8mmol/L,根尖膜损伤程度、根系抗氧化酶(SOD、CAT、POD)活性以及可溶性蛋白和可溶性糖含量显著上升;同时,8mmol/LCuSO4胁迫下叶片Cu2+水平显著上升,并且使得叶片PS II光化学活性和叶片叶绿素含量开始显著下降;说明该浓度对幼苗形成了氧化胁迫,并引起了光合抑制.在CuSO4胁迫浓度高达15~20mmol/L时,显著降低了根系APX活性,并且引起了幼苗生长抑制.综上,短期高浓度Cu2+胁迫环境对黄芪幼苗生理学代谢的主要毒害机制为引起ROS的过量积累,继而使其生理学代谢反应发生紊乱,最终影响幼苗生长,并且CuSO4胁迫浓度为20mmol/L时对幼苗生理学反应和生长的影响最显著.
4.2 基质中APT的存在通过降低幼苗组织中Cu2+的生物有效性缓解了CuSO4对幼苗的生理学胁迫作用.此外,APT作为一种天然的非金属黏土矿物,储量丰富,价格低廉,且本身就是生态系统中的自身组分而不具有毒性,因此其有望作为一种植物栽培基质的外源添加剂,应用于黄芪等药用植物的生态种植中.
[1] Vinit-Dunand F, Epron D, Alaoui-Sosse B, et al. Effects of copper on growth and on photosynthesis of mature and expanding leaves in cucumber plants [J]. Plant Science, 2002,163(1):53-58.
[2] Alaouisosse B, Genet P, Vinitdunand F, et al. Effect of copper on growth in cucumber plants (Cucumis sativus) and its relationships with carbohydrate accumulation and changes in ion contents [J]. Plant Science, 2004,166(5):1213-1218.
[3] Zhao S L, Liu Q, Qi Y T, et al. Responses of root growth and protective enzymes to copper stress in turfgrass[J]. Acta Biologica Cracoviensia, 2010,52(2):7-11.
[4] Zhang M D, Ran R L, SaiNao W Q, et al. Physiological effects of short-term copper stress on rape (Brassica napus L.) seedlings and the alleviation of copper stress by attapulgite clay in growth medium [J]. Ecotoxicology and Environmental safety, 2019,171(30):878-886.
[5] 姜志艳,王建英,杨雪梅.铜、铅、锌对黄芪生长及其DNA损伤的影响[J]. 南方农业学报, 2013,44(2):205-209. Jiang Z Y, Wang J Y, Yang X M. Effect of copper, lead and zinc on growth of(Fisch.) Bge.Varmongholicus (Bge.) Hsiao and its DNA damage [J]. Journal of Southern Agriculture, 2013,44(2):205-209.
[6] 赵 蓉.我国8种中药材重金属污染的系统评价[D]. 北京:北京中医药大学, 2016. Zhao R. Systematic evaluation of heavy metal pollution of eight chinese herbal medicines in china [D]. Beijing: BeiJing University of Chinese Medicine, 2016.
[7] 武 征.重金属胁迫对夏枯草主要生理特性和内在品质的影响[D]. 南京:南京农业大学, 2009. Wu Z. Effects of heavy metals stress on primary physiological characteristics the internal quality of Prunella vulgaris L [D]. Nanjing: Nanjing Agricultural University, 2009.
[8] Baurand P E, Capelli N, De V A. Genotoxicity assessment of pesticides on terrestrial snail embryos by analysis of random amplified polymorphic DNA profiles [J]. Journal of Hazardous Materials, 2015, 298:320-327.
[9] Liu H, Cao Y, Li W, et al. The effects of cadmium pulse dosing on physiological traits and growth of the submerged macrophyte Vallisneria spinulosa and phytoplankton biomass: a mesocosm study [J]. Environmental Science and Pollution Research, 2017,24(18): 15308-15314.
[10] Rafiq M K, Joseph S D, Li F, et al. Pyrolysis of attapulgite clay blended with yak dung enhances pasture growth and soil health: characterization and initial field trials [J]. Science of Total Environment, 2017,607-608(31):184-194.
[11] 黎 珊,戴红旗,孔 泳,等.凹凸棒土的应用研究进展[J]. 化工进展, 2013,32(12):2934-2939. Li S, Dai H Q, Kong Y, et al. Research progress of attapulgite's application [J]. Chemical Industry and Engineering Progress, 2013, 32(12):2934-2939.
[12] 范如芹,罗 佳,高 岩,等.凹凸土对无土栽培基质性能及番茄育苗的影响[J]. 江苏农业学报, 2015,31(4):792-797. Fan R J, Luo J, Gao Y, et al. Effects of attapulgite on the properties of soilless substrate and performance of tomato seedling [J]. Jiangsu Journal of Agricultural Sciences, 2015,31(4):792-797.
[13] 任旭琴,高 军,陈伯清,等.凹土对辣椒自毒作用修复的生理生化机制研究[J]. 土壤, 2014,46(5):908-912. Ren X Q, Gao J, Chen B Q, et al. Physiological and biochemical mechanisms of attapulgite clay on alleviation to autotoxicity in pepper [J]. Soils, 2014,46(5):908-912.
[14] 刘左军,陈正宏,袁惠君,等.凹凸棒石黏土对土壤团粒结构及小麦生长的影响[J]. 土壤通报, 2010,41(1):142-144. Liu Z J, Chen Z H, Yuan H J, et al. Effects of attapulgite clay on soil aggregate and wheat growth [J]. Chinese journal of Soil Science, 2010, 41(1):142-144.
[15] Xu Y, Liang X F, Xu Y M, et al. Remediation of heavy metal-polluted agricultural soils using clay minerals: a review [J]. Pedosphere, 2017, 27(2):193-204.
[16] 陈 浩.凹凸棒黏土改性及其吸附性能研究[D]. 兰州:中国科学院兰州化学物理研究所, 2007. Chen H. Study on modification of palygorskite clay and relevant absorption property [D]. Lanzhou: Lanzhou Institute of Chemical Physics, 2007.
[17] 任静华,廖启林,范 健,等.凹凸棒黏土对镉污染农田的原位钝化修复效果研究[J]. 生态环境学报, 2017,26(12):2162-2168. Ren J H, Liao Q L, Fan J, et al. Effect of in-situ stabilizing remediation of Cd-polluted soil by attapulgite [J]. Ecology and Environment Sciences, 2017,26(12):2162-2168.
[18] Yang W D, Wang Y Y, Zhao F L, et al. Variation in copper and zinc tolerance and accumulation in 12willow clones: implications for phytoextraction[J]. Journal of Zhejiang University Science B, 2014, 15(9):788-800.
[19] Lin Y R, Schertz K F, Paterson A H. Comparative analysis of QTLs affecting plant height and maturity across the Poaceae, in reference to an interspecific sorghum population[J]. Genetics, 1995,141(1):391- 411.
[20] Elise S, Etienne-Pascal J, Fernanda C N D, et al. The medicago truncatula SUNN gene encodes a CLV1 -like leucine-rich repeat receptor kinase that regulates nodule number and root length[J]. Plant Molcular Biology, 2005,58(6):809-822.
[21] Anjorin F B, Adejumo S A, Agboola L, et al. Proline, soluble sugar, leaf starch and relative water contents of four maize varieties in response to different watering regimes[J]. Cercetari Agronomice in Moldova, 2016,49(3):51-62.
[22] Sergiev I, Alexieva V, Karanov E. Effect of spermine, atrazine and combination between them on some endogenous protective systems and stress markers in plants [J]. Compt Rend Acad Bulg Science, 1997, 51(3):121-124.
[23] Li X N, Yang Y L, Jia LY, et al. Zinc-induced oxidative damage, antioxidant enzyme response and proline metabolism in roots and leaves of wheat plants[J]. Ecotoxicology and Environmental Safety, 2013,89(11):150-157.
[24] Dogan M, Yumrutas O, SaygiDeger S D, et al. Effects of bisphenol A and tetrabromobisphenol A on chickpea roots in germination stage [J]. American-Eurasian Journal of Agricultural and Environmental Sciences, 2010,9(2):186-192.
[25] Hung W C, Huang D D, Chien P, et al. Protein tyrosine dephosphorylation during copper-induced cell death in rice roots [J]. Chemosphere, 2007,69(1):55-62.
[26] Thounaojam T C, Panda P, Mazumdar P, et al. Excess copper induced oxidative stress and response of antioxidants in rice [J]. Plant Physiology and Biochenmisry, 2012,53:33-39.
[27] Bai J Y, Feng H Q, Guan D D, et al. Extracellular ATP affects the copper-induced cell death and H2O2production [J]. Journal of East China Normal University (Natural Science), 2016,2016(3):103-113.
[28] Zhang F Q, Wang Y S, Lou Z P, et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (Kandelia candel and Bruguiera gymnorrhiza) [J]. Chemosphere, 2007,67(1):44-50.
[29] 胡筑兵,陈亚华,王桂萍,等.铜胁迫对玉米幼苗生长、叶绿素荧光参数和抗氧化酶活性的影响[J]. 植物学通报, 2006,23(2):129-137. Hu Z B, Chen Y H, Wang G P, et al. Effects of copper stress on growth chlorophyll fluorescence parameters and antioxidant enzyme activities of zea mays seedlings [J]. Chinese Bulletin of Botany, 2006, 23(2):129-137.
[30] Chai M W, Shi F C, Li R L, et al. Growth and physiological responses to copper stress in a halophyte Spartina alterniflora (Poaceae) [J]. Acta Physiologiae Plantarum, 2014,36(3):745-754.
[31] 杜 晓,申晓辉.镉胁迫对珊瑚树和地中海荚蒾生理生化指标的影响[J]. 生态学杂志, 2010,29(5):899-904. Du X, Shen X H. Effects of cadmium stress on physiological and biochemical indices ofandseedlings [J]. Chinese Journal of Ecology, 2010,29(5):899-904.
[32] Hanson J, Smeekens S. Sugars perception signaling- an update [J]. Current Opinion in Plant Biology, 2009,12(5):562-567.
[33] Wang H, Shan X Q, Wen B, et al. Responses of antioxidative enzymes to accumulation of copper in a copper hyperaccumulator of[J]. Archives of Environmental Contamination and Toxicology, 2004,47(2):185-192.
[34] Bohner H, Bohme H, Boger P. Reciprocal formation of plastocyanin and cytochrome c-553 and the influence of cupric ions on photosynthetic electron transport [J]. Biochimica Et Biophysica Acta, 1980,592(1):103-112.
[35] Hsu B D. Toxic effects of copper on photosystem II of spinach chloroplasts [J]. Plant Physiology, 1988,87(1):116-119.
[36] Samuelsson G, Oquist G. Effects of copper chloride on photosynthetic electron transport and chlorophyll-protein complexes of Spinacia oleracea [J]. Plant and Cell Physiology, 2012,21(3):445-454.
[37] Singh D, Nath K, Sharma Y K. Response of wheat seed germination and seedling growth under copper stress [J]. Journal of Environmental Biology, 2007,28(2):409-14.
[38] Abadia J, Morales F, Abadía A. Photosystem II efficiency in low chlorophyll, iron-deficient leaves [J]. Plant and Soil, 1999,215(2): 183-192.
Physiological toxicity of copper stress onseedlings and mitigation of attapulgite clay.
SAINAO Wang-qing, RAN Rui-lan, ZHANG Mu-dan, CAO Jia-xin, FENG Han-qing*, PANG Hai-long, JIA Ling-yun
(College of Life Sciences, Northwest Normal University, Lanzhou 730070, China)., 2019,39(12):5273~5284
In order to explore the mechanism of the resistance ofseedlings to stress of copper ion (Cu2+) and the mitigative effects of attapulgite clay on Cu2+pollution, the physiological toxicity of CuSO4(2~20mmol/L) toseedlings and the alleviative effects of attapulgite clay on such physiological toxicity were investigated. The results showed that, after treatment with 2mmol/L CuSO4, the Cu2+content, H2O2(hydrogen peroxide) content, and MDA (malondialdehyde) content of roots were significantly increased by 1.82, 1.04 and, 2.14 folds, respectively, compared to the controls. After treatment with 8mmol/L CuSO4, the SOD (superoxide dismutase) activity in the roots,the degree of damages on root apical membrane, and leaf Cu2+content were significantly increased by 1.13, 1.12, and 2.62 folds, respectively, compared to the controls. Under the stress of 8mmol/L CuSO4, the Y(Ⅱ) (photochemical quantum yield of PS Ⅱ), qP (photochemical quenching coefficient), ETR (the rate of non-cyclic electron-transport through PS Ⅱ), and chlorophyll content of the leaves significantly decreased by 22.88%, 24.44%, 21.49%, and 8.31%. While the NPQ and qN (non-photochemical quenching) of the leaves was significantly increased by 2.35 and 1.58 fold, respectively, compared with controls. The POD (peroxidase) activity, CAT (catalase) activity, and soluble protein and sugar content of roots reached maximum at 8mmol/L CuSO4and decreased afterwards. CuSO4at the concentrations as high as 15~20mmol/Lcaused the significant decreases of the APX (ascorbate peroxidase) activity of roots, maximum photochemical efficiency of PS II under light adaptation (v¢/m¢) of leaves, and fresh or dry weight of whole seedlings and below-ground parts. Under the condition without CuSO4stress, the presence of attapulgite clay in the growth substrate made the MDA content of roots significantly decreased by 15.93% but did not affect other physiological indicators. Under the stress of 20mmol/LCuSO4, attapulgite clay made the Cu2+content in roots and leaves significantly decreased by 30.78% and 23.12%, respectively. In addition, it alleviated the effects of CuSO4on the production of reactive oxygen species antioxidant enzyme activities, membrane lipid peroxidation, the degree of damage on root apical membrane, and the content of soluble protein and sugar of roots. The presence of attapulgite clay in the growth also effectively alleviated the inhibition ofPS II photochemical activity, chlorophyll content, and growth of the seedlings under CuSO4stress. These results suggested thatattapulgite clay in the growth medium could effectively alleviate the CuSO4- induced physiological toxicity toseedlings through reducing the bioavailability of Cu2+in seedlings.
copper ion;seedlings;attapulgite clay;alleviation
X53
A
1000-6923(2019)12-5273-12
赛闹汪青(1993-),男,藏族,甘肃迭部人,西北师范大学生命科学学院硕士研究生,研究方向为逆境植物生理生态.
2019-05-10
国家自然科学基金资助项目(31870246,31560070);甘肃省重点研发计划项目(17YFINA064,18YF1NA051);甘肃省高校基本科研业务费;西北师范大学青年创新团队项目
* 责任作者, 教授, 博导, fenghanq@nwnu.edu.cn

