白菊米多糖大孔树脂脱色工艺研究
沈 锦,刘钰梅,李 洁,潘依雯,彭小羽,陈艳丽
(盐城师范学院 药学院,江苏 盐城 224007)
白菊(White Chrysanthemum.)属菊科,多年生草本,又名甘菊、杭白菊、茶菊。白菊米是小白菊含苞待放的花蕾经科学方法加工而成,外形似半粒绿豆大,黄绿色轻圆微扁。白菊具有养肝明目、清心补肾、健脾和胃、润喉生津等功效[1]。药理研究表明,菊花活性成分具有免疫调节、抗病毒、抗氧化、降血脂等生物活性[2]。但目前对菊花化学成分的研究多集中在萜类、黄酮类、酚类等小分子化合物,对菊花多糖等大分子活性物质研究鲜有报道[3]。
传统提取工艺获得的粗多糖往往含有杂蛋白、色素等杂质,进一步纯化前需将这些杂质去除,提高多糖纯度。目前常用的多糖脱色方法有活性炭法、双氧水法、大孔树脂脱色法等[4-5],每种脱色方法都有各自特点。
本文以多糖脱色率和保留率为评价指标,采用单因素和正交实验方法,优选出白菊米多糖最佳脱色工艺并进行大量制备。为白菊米多糖的进一步开发提供实验依据。
1 材料与方法
1.1 材料与仪器
白菊米,产自江苏射阳;D3520、AB-8、DM-13、D101大孔树脂、732#强酸型阳离子交换树脂,葡萄糖、半乳糖醛酸,牛血清白蛋白标准品;无水乙醇、丙酮、浓硫酸、苯酚等均为分析纯。
扣压摇摆式小型粉碎机,循环水真空泵,高速台式离心机,恒温水浴锅,紫外-可见分光光度计,移液器,旋转蒸发仪等。
1.2 实验方法
1.2.1 白菊米多糖的制备
将粉碎白菊米以料液比1∶30的比例加入无水乙醇,90℃回流脱脂2 h。脱脂后以料液比1∶30的比例加入去离子水,80℃水浴提取2.5 h,抽滤后滤渣在相同条件下二次提取并抽滤。合并两次提取滤液浓缩至200 mL,以1∶4的体积比加入无水乙醇,置入冰箱过夜。抽滤后分别以无水乙醇、丙酮洗涤脱水,60℃干燥得白菊米粗多糖。
1.2.2 脱色评价指标[6]
取1.2.1项下白菊米粗多糖,加去离子水溶解配制成5 mg/mL浓度,在200~750 nm范围内进行紫外-可见光全波长扫描。结果显示,多糖溶液在450 nm处有最大吸光度,故确定此波长为色素最大吸收波长。
(1) 脱色率的测定:取1 mL白菊米多糖溶液,加水稀释至5 mL,混匀后在450 nm处测定吸光度值,计算脱色率。
脱色率(%)=A脱色后/A脱色前× 100%
(2) 多糖保留率测定:以葡萄糖为标准品,采用苯酚-硫酸法[7]测定白菊米多糖含量。
多糖保留率(%)=M脱色前-M脱色后/M脱色前×100%
1.2.3 树脂预处理
采用95%乙醇浸泡大孔树脂24 h后,乙醇洗至无色,水洗至不再有乙醇味。732#阳离子树脂用蒸馏水浸泡24 h,水洗至溶液澄清,过滤后用1 mol/L NaOH溶液浸泡24 h,水洗至pH值到7.0左右,过滤后再用1 mol/L HCl溶液24 h浸泡,水洗至pH值达到7.0左右。
1.2.4 树脂选择
分别称取经预处理后的D3520、AB-8、DM-130、D101和732#强酸型阳离子树脂各12 g,置于100 mL具塞锥形瓶中,加入30 mL白菊米多糖溶液,25℃下恒温振荡24 h。结束后静置取上清液2 mL,进行白菊米多糖脱色率和多糖保留率测定。
1.2.5 树脂脱色工艺单因素考察
1.2.5.1 树脂用量对脱色率、多糖保留率的影响
固定脱色温度50℃,脱色时间2 h,分别取3、6、9、12、15、18 g大孔树脂于具塞锥形瓶中,加入5 mg/mL白菊米多糖溶液30 mL,振荡脱色,计算多糖脱色率和保留率,绘制树脂用量对多糖脱色率和保留率曲线。
1.2.5.2 时间对脱色率、多糖保留率的影响
固定树脂用量12 g,脱色温度50℃,分别设置脱色时间0.5、1、2、3、4、5 h。在具塞锥形瓶中加入5 mg/mL白菊米多糖溶液30 mL,振荡脱色,计算多糖脱色率和保留率,绘制脱色时间对多糖脱色率和保留率曲线。
1.2.5.3 温度对脱色率、多糖保留率的影响
固定树脂用量12 g,脱色时间2 h,分别设置脱色温度20、30、40、50、60、70℃。在具塞锥形瓶中加入5 mg/mL白菊米多糖溶液30 mL,振荡脱色,计算脱色率和多糖保留率,绘制脱色温度对多糖脱色率和保留率曲线。
1.2.6 白菊米多糖脱色正交试验
在单因素实验基础上,对树脂用量、脱色时间、脱色温度进行3因素3水平的L9(3)3正交实验设计[8],实验因素水平如表1所示。
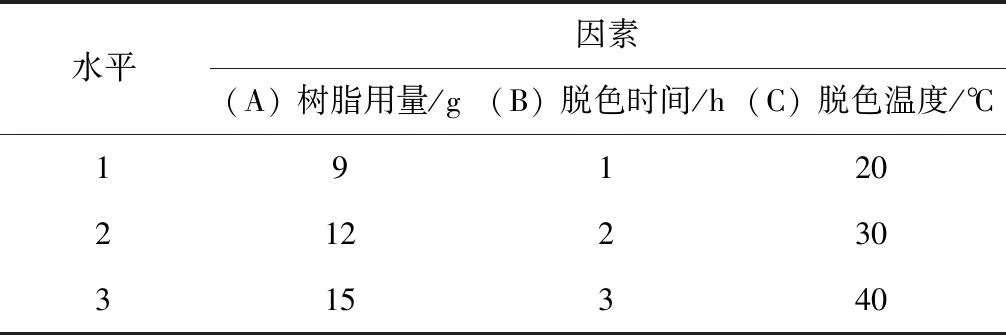
表1 正交实验因素水平表
1.2.7 验证性实验
以正交实验结果中的最佳脱色工艺,平行实验测定3次,计算脱色率和多糖保留率。
2 结果与讨论
2.1 脱色树脂筛选
五种不同型号树脂脱色结果见表2。D101大孔树脂脱色中,白菊米多糖保留率达64.48%,脱色率达51.41%,与其他树脂相比,脱色率较高且对多糖保留率的影响较小。因此选择其进行进一步脱色工艺优化。

表2 五种不同型号树脂脱色率、多糖保留率结果
2.2 单因素实验结果
2.2.1 树脂用量对脱色率、多糖保留率的影响
图1所示,随着树脂用量的增加,多糖脱色率逐渐增加,但多糖保留率在降至60%左右时基本保持不变。当树脂用量为12 g/100 mL多糖溶液时,多糖脱色率为40.69%,多糖保留率为62.21%。继续增加树脂用量,多糖脱色率增加不大,综合考虑选择12 g/100 mL树脂用量作为本实验最佳树脂量。
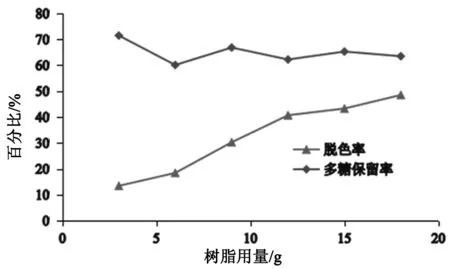
图1 树脂用量对多糖脱色率和保留率的影响
2.2.2 时间对脱色率、多糖保留率的影响
由图2可知,随脱色时间增加,多糖保留率先增后减,脱色率呈上升趋势。当脱色时间为2 h时,多糖保留率为68.66%,此时脱色率为45.66%。在2 h之前,脱色时间过短导致脱色率不高,而2 h之后,脱色率增加并不明显但多糖保留率呈明显下降趋势,故选择2 h为最佳脱色时间。
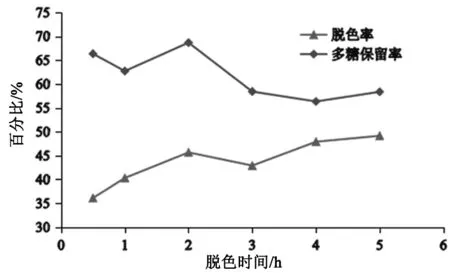
图2 脱色时间对多糖脱色率和保留率的影响
2.2.3 温度对脱色率、多糖保留率的影响
从图3可知,多糖脱色率随时间的延长呈下降趋势,多糖保留率受温度影响变化不大。当脱色温度为30℃时,脱色率为44.98%,多糖保留率为60.25%,温度继续升高,脱色率明显下降,可能高温影响树脂结构使脱色率下降。综合考虑,选择30℃为最佳脱色温度。
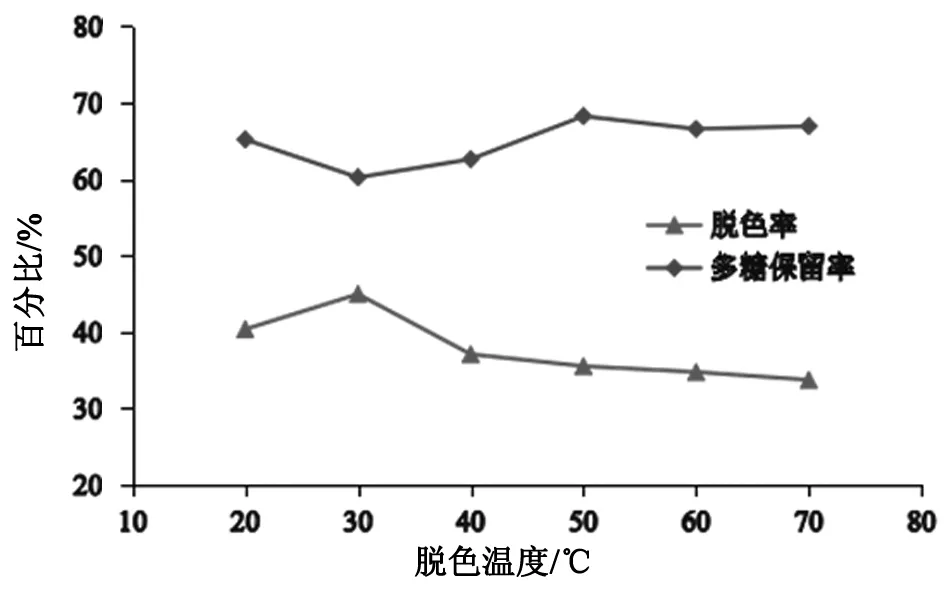
图3 脱色温度对多糖脱色率和保留率的影响
2.3 正交实验结果分析
以脱色率和多糖保留率为考察指标,对白菊米多糖脱色树脂用量、脱色时间和脱色温度进行3因素3水平的 L9(3)3正交实验设计(表1)。从表3实验结果可知,3个因素对实验结果的影响顺序分别为 A > B > C,即脱色树脂用量>脱色时间>脱色温度,在实验考察范围内,最优组合为A1B2C2,即树脂用量9 g/100mL多糖溶液,脱色时间2 h,脱色温度30℃时脱色效果和多糖保留率综合为最佳。从表4方差分析可知,树脂用量对实验结果有显著性影响(P < 0.05)。在此最优工艺条件下,对白菊米多糖大孔树脂脱色进行3次重复验证性实验,得到多糖脱色率为45.72%,多糖保留率为64.28%。
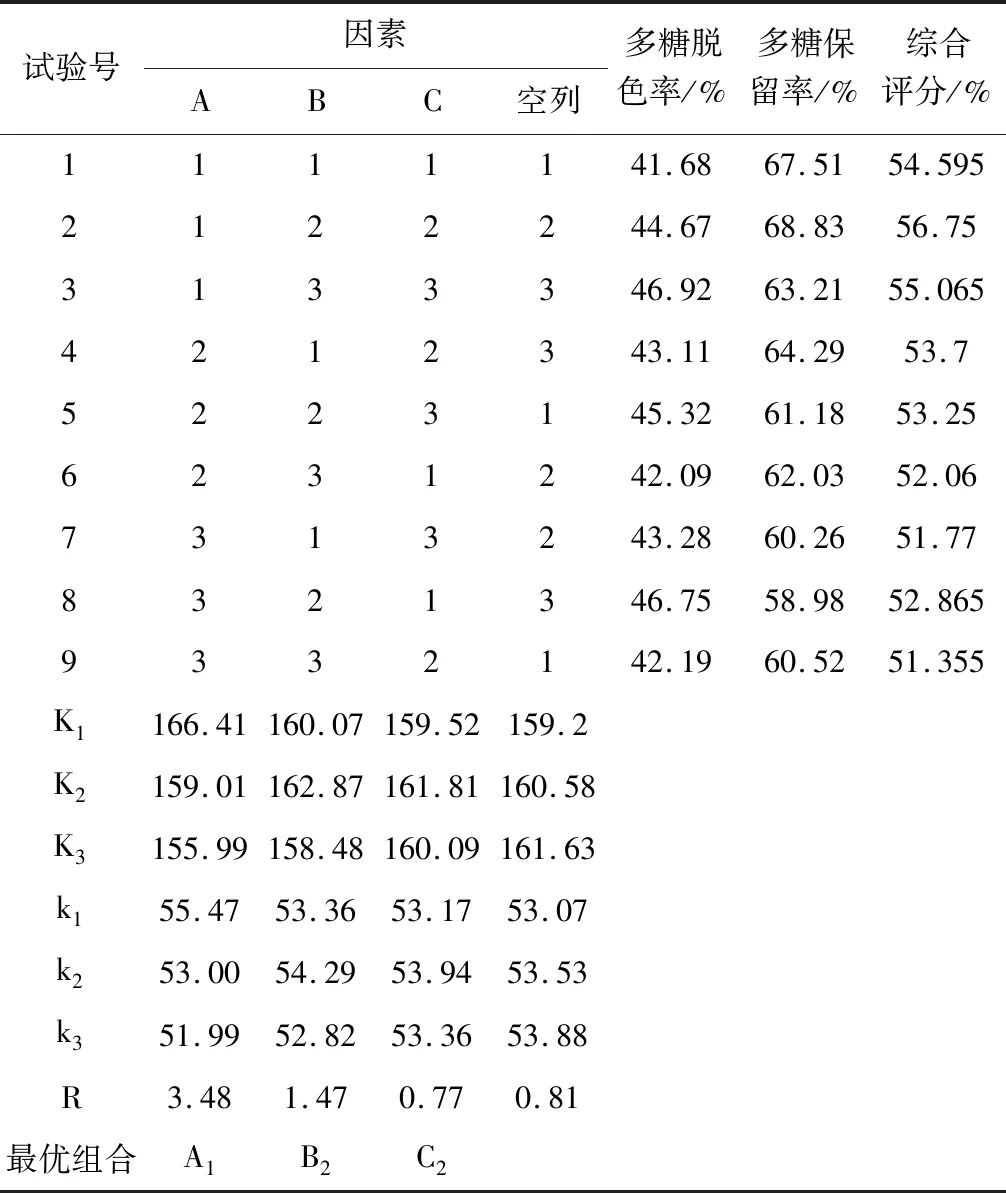
表3 大孔树脂脱色正交实验结果分析
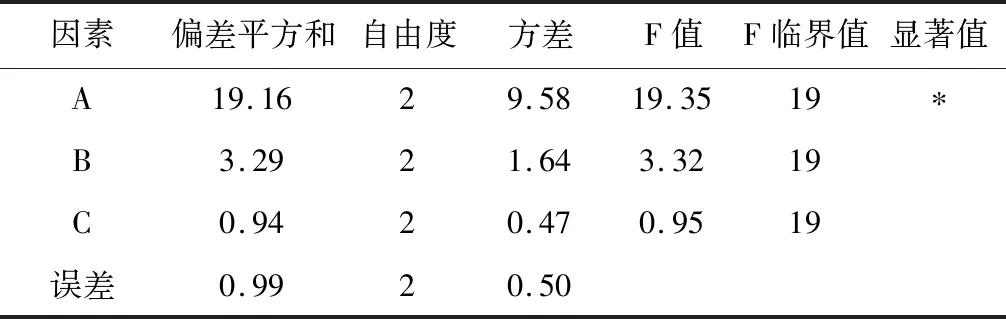
表4 大孔树脂脱色正交实验方差分析
3 结论
本文通过单因素和正交实验设计,对白菊米多糖大孔树脂脱色工艺进行优化。得到最佳脱色工艺为:D101大孔树脂用量9 g/100mL多糖溶液,脱色时间2 h,脱色温度30℃。在此工艺条件下对白菊米多糖进行脱色,计算得到脱色率为45.72%,多糖保留率为64.28%,脱色后白菊米颜色明显变浅。白菊米多糖的结构及生物活性还需进一步研究,该实验为白菊米多糖的综合开发利用提供依据。

