重组人骨形态发生蛋白10的表达纯化及其心脏保护功能
王若璋, 金 坚
(江南大学 药学院, 江苏 无锡, 214122)
2003年的流行病学统计结果[1-3]显示,中国成人(35~74岁)的心力衰竭(心衰)患病率约为0.9%, 已成为65岁以上患病人群住院的首要原因。病毒性心肌炎、高血压、缺血性心脏病、使用具有心脏毒性的药物等因素均可导致心衰的发生。心衰的病理进展包括心肌细胞的死亡、成纤维细胞的募集和细胞外基质的沉积,最终可导致心脏功能的严重损伤[4-7]。目前研究[4-5, 8]认为,心肌细胞的死亡对心力衰竭的发展具有关键的影响。采取措施预防或拮抗心肌细胞死亡是阻止或减慢心力衰竭进展的关键。
多柔比星(DOX)是一种经典的蒽环类抗肿瘤化疗药物,可用于治疗实体瘤和血液系统肿瘤[6]。20世纪60年代,随着蒽环类抗生素在肿瘤临床治疗中的使用,人们第一次意识到化疗过程可能对心脏功能产生影响[9-11]。DOX介导的心脏毒性的机制被认为主要与自由基产生、线粒体功能障碍、DNA损伤和肌原纤维变性等因素有关[12]。DOX的使用可引起充血性心力衰竭、左室射血分数的下降、高血压、心律失常、QTC期延长以及心肌缺血等现象,造成可逆或不可逆的心脏损伤[13]。
骨形态发生蛋白10(BMP10)是一种肿瘤坏死因子-β(TGF-β)超家族的分泌型细胞外信号多肽,在哺乳动物胚胎心脏发育过程中起到关键作用[14-16]。BMP10的表达可以在特定的心脏病理情况下被重新激活[16]。为了研究BMP10在成年动物心脏中的作用,作者前期研究构建了条件型转基因小鼠模型,发现BMP10在成年动物心脏中的过表达可以有效降低β-肾上腺素类似物长期过度刺激引起的心肌细胞死亡,并保护受损心脏。此外,BMP10通过旁分泌的方式来发挥其作用,这一特性赋予了其全身给药的能力。
在这项研究中,作者制备了一种关键的心源性生长因子BMP10, 并测试其是否可以减轻由DOX诱导的心脏损伤。作者研究证明,在注射DOX后,与使用生理盐水处理的野生型小鼠相比, BMP10处理小鼠具有更好的心脏功能,证明BMP10可以有效地保护心脏免受DOX介导的心脏毒性影响,现将结果报告如下。
1 材料与方法
1.1 材料与设备
CHO-S细胞株为本实验室留存细胞株, C2C12细胞株购自ATCC。高保真酶, Takara; DMEM/F12培养基,胎牛血清, G418, DMEM等, Gibco; M2/M4 CHO无血清培养基, Feed4补料培养基,苏州康聚生物有限公司; anti-BMP10 antibody, R&D; Dual luciferase reporter assay system, Promega。
1.2 实验方法
1.2.1 表达质粒构建: 通过融合PCR的方法除去重组人BMP10(rhBMP10) cDNA序列中的EcoRI识别位点(GAATTC), 突变后的序列为GAGTTC, 不影响其编码的氨基酸序列和翻译效率。修改后的cDNA被EcoRI和Not I酶切,并使用T4连接酶插入到pMH3质粒中。融合PCR所使用的引物和PCR程序见表1。
1.2.2 CHO-BMP10细胞株构建: 取悬浮培养的状态良好的CHO-S细胞,计数,取约3.0×106cells/mL细胞,离心,用200 μL PBS重悬,加入40 μg质粒和10 μg Salmon sperm混匀,将电转体系加入预冷的2 mm电击杯中,置冰上5 min, 160 V, 15 ms电击共3次。取2个100 mm dish, 分别加入10 mL D/F完全培养基,将电击后的体系均匀分至2个dish中,置于湿式二氧化碳培养箱静置培养(37 ℃, 5% CO2)。

表1 融合PCR引物
CHO-S转染第2天,换液,加入终浓度为4.5 mg/mL的G418进行压力筛选,静置培养约10 d。取96孔板,每孔加入200 μL D/F完全培养基。取压力筛选后,生长出克隆的dish, 用10 μL tip挑取克隆,并转移至96孔板中。约1周后,镜检可观察到明显克隆,弃上清,加入100 μL D/F基础培养基, 2 d后取上清,Dot blot检测BMP10表达水平,选取高表达的3个克隆,使用dish扩大培养后,再挑去克隆至96孔板中,重复上述步骤,共3次。最后,取表达量最高的1株细胞,稀释至约3.5 cells/mL, 每孔200 μL铺96孔板,选择单克隆,扩大培养并冻存,命名为CHO-BMP10细胞系。
1.2.3 CHO-BMP10流加培养: 将CHO-BMP10细胞株悬浮驯化,将生长状态良好的种子接种于250 mL摇瓶中,密度为1.0×106cells/mL, 体积150 mL, 100 转/min, 37 ℃培养。至密度为(5.0~6.0)×106cells/mL时,将二级种子接入3 L摇瓶中, 100转/min, 37 ℃培养。根据生长情况将培养体积逐渐补充至1.5 L, 停止补加培养基后,待细胞密度上升至(9.0~10.0)×106cells/mL时,降温至34 ℃培养。根据葡萄糖浓度添加Feed 4补料培养基,维持体系中葡萄糖的浓度在3 g/L左右。至细胞直径≥16 μm时,密切关注细胞活率,当活率突然下降时(90%左右),结束培养。
1.2.4 纯化: 将5 L培养上清8 000转/min离心30 min。用0.22 μm微孔滤膜过滤上清,然后使用Millipore Pellicon超滤系统和10 kDa膜包进行缓冲液置换。将体积超滤浓缩至500 mL, 然后加入50 mmol/L苯丁酸钠(NaPB) 4.5 L , 超滤浓缩至500 mL, 然后再加入50 mmol/L NaPB 4.5 L , 超滤浓缩至500 mL。
将3个5 mL HiTrap Q HP柱串联,接入AKTA avant 25。所使用的流动相中, A液为50 mmol/L NaPB, B液为1 mol/L 氯化钠(NaCl), 系统流速为1 mL/min。用A液冲平UV280, 调零后上样,然后用A液淋洗,直至冲平UV280, 用25% B液洗脱并收集洗脱峰。
用10 kDa超滤管将Q柱纯化产物浓缩。Loop环上样至采用50 mmol/L NaPB+150 mmol/L NaCl平衡过的Superdex 200 10/300色谱柱上,并收集洗脱峰。所使用的流动相为50 mmol/L NaPB+150 mmol/L NaCl, 系统流速为0.5 mL/min。
1.2.5 蛋白电泳: CHO细胞的培养上清或纯化后的蛋白,适当稀释后,加入不含还原剂的5× Loading Buffer, 常规制样,并使用4%~20%梯度胶板进行电泳。根据需要进行考马斯亮蓝染色或Western blot。
1.2.6 荧光素酶报告检测: 取C2C12细胞铺24孔板,每孔7×104cells。培养过夜后,转染pGL6质粒, 6 h后换液,每孔加入适当稀释的BMP10标准品或样品,培养12 h, 用PBS洗涤1次,弃上清,按照试剂盒说明书进行检测。
1.2.7 动物模型构建: 70只雄性健康C57BL/6J小鼠被随机分为4组,其中2组为每组15只(Saline组, rhBMP10组),其他2组为每组20只(DOX组, DOX +rhBMP10组)。在实验开始前3 d, Saline组、DOX组每天注射PBS 200 μL; rhBMP10组、DOX+rhBMP10组每天注射200 μL rhBMP10 (2 μg), 直至第5周结束。Saline组、rhBMP10组每周注射1次PBS,共5次; DOX组、DOX+rhBMP10组每周注射1次DOX(5 mg/kg), 共5次[17]。第5周结束后,每组随机选取4只动物检测超声心动图; 随后处死动物,分离血清检测血清心肌肌钙蛋白和肌红蛋白水平; 取心脏组织切片并使用TUNEL法检测心肌细胞凋亡水平。
1.2.8 超声心动图: 采用Visual Sonics公司的Vevo 2100小动物超声系统,在第5周实验结束后进行超声心动图检测。使用Vaporizer雾化罐,将小鼠置于密闭透明亚克力箱中,使其吸入异氟烷麻醉,在小鼠左胸涂抹适量脱毛膏,稍等片刻后用湿棉球擦去毛发。采用仰卧位将小鼠固定至恒温手术台,套上异氟烷呼吸面罩。固定四肢以采集心电及呼吸信号,待心率稳定后在左胸涂抹耦合剂,接入探头采集数据。选取短轴切面进行采集。自B mode超声心动图中截取M mode超声,并以此为基础计算短轴缩短率(FS)。
1.2.9 TUNEL: 取小鼠心脏组织,常规脱水包埋,并切片。常规脱蜡至水,用索莱宝TUNEL试剂进行检测。
1.3 统计学分析
数据以均数±标准差表示,行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 CHO-BMP10细胞株的构建
将构建好的pMH3质粒电转染至CHO-S空细胞,并加入终浓度为4.5 mg/mL的G418压力筛选。约10 d后,可在dish底部观察到肉眼可见的白色半透明细胞克隆。将克隆挑至96孔板并培养至圆形克隆长出后,换用D/F基础培养基培养2 d, 并用Dot blot检测上清中rhBMP10的表达水平。第1次克隆检测中(图1A), 背景较深,一方面说明rhBMP10的表达水平较低,另一方面说明单孔中的细胞为非单一来源细胞,有一定比例的细胞不能表达rhBMP10。第2次克隆中(图1B), rhBMP10的表达水平呈上升趋势。选取第2次克隆中表达最高的3个孔,将细胞消化、扩大培养后,用有限稀释法接种至96孔板,待克隆长出后再次进行Dot blot检测(图1C)。选取表达量最高的孔,扩大至24孔板培养并再次检测,将表达量最高的细胞株扩大培养并冻存,得到稳定表达rhBMP10的CHO-S工程细胞株CHO-BMP10。
2.2 rhBMP10的流加培养
细胞在0~3 d呈现快速增长状态,此时细胞处于对数增长期,细胞增殖旺盛,存活率高且细胞直径小。在4 d开始进行补料,同时将培养温度下调至34 ℃, 以延长平台期,维持细胞的高密度生长状态。由于养分的消耗和空间的挤占,细胞生长速度下降,活率也缓慢下降,最终在8 d达到最大密度(9.1×106cells/mL)。从第3天开始,细胞直径逐步增大,到第9天达到16.4 μm, 提示细胞衰老,同时存活率下降至94.0%, 故选择在第10天结束培养。见图2。
取样进行Western blot, 由图3可以看出, rhBMP10随着培养时间的增加逐步积累,同时呈现多条带的特征。其中116 kDa的条带在1~2 d较少,随后逐渐增多; 68 kDa和55 kDa的条带则在3 d开始积累,而位于26 kDa的成熟rhBMP10生长因子结构域二聚体则在7 d开始出现,表明CHO表达体系缺乏相关的酶切体系,不足以处理rhBMP10中存在的RIRR↓316酶切位点。
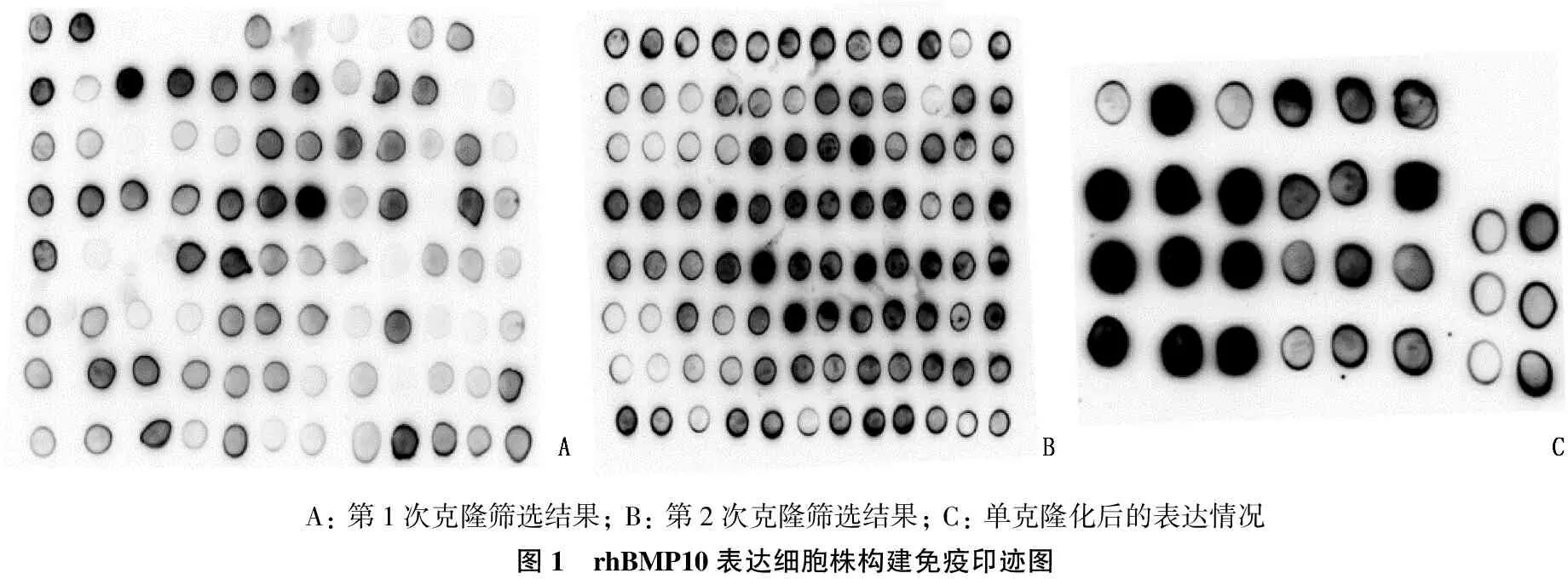
A: 第1次克隆筛选结果; B: 第2次克隆筛选结果; C: 单克隆化后的表达情况图1 rhBMP10表达细胞株构建免疫印迹图

A: 细胞存活率; B: 细胞密度; C: 细胞直径图2 CHO-BMP10细胞株在3 L摇瓶流加培养过程中的生长情况
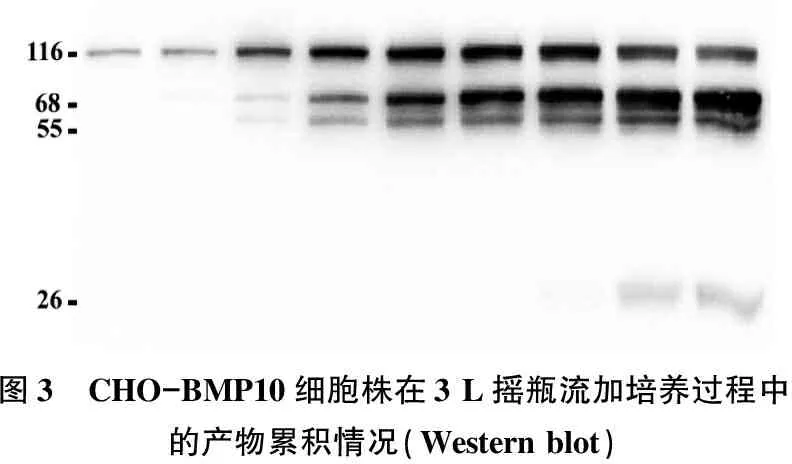
图3 CHO-BMP10细胞株在3 L摇瓶流加培养过程中的产物累积情况(Western blot)
对结束培养时的表达上清进行ELISA定量分析,结束培养时的rhBMP10产量为35.3 mg/L。
2.3 rhBMP10的纯化
本研究分别使用Q柱和分子筛对所表达的rhBMP10进行了纯化。Q柱纯化中,洗脱峰的考马斯亮蓝染色结果呈现多条带的特征,主要包括116 kDa、68 kDa、43 kDa、26 kDa这4个条带。在分子筛纯化中,上述4个条带亦未被分离。对纯化后的表达上清进行ELISA定量分析,获得的纯化rhBMP10纯度≥95%, 浓度为4.5 mg/mL, 体积为15.3 mL, rhBMP10总产量为68.85 mg, 收率为49.8%。见图4、5。
2.4 荧光素酶报告活性检测
能够被BMP家族成员特异性激活的核酸序列被称为BMP反应区段(BRE)。将BRE序列整合到Minimal TA promoter前,在BMP10的存在下,便可以特异性地启动其下游编码蛋白的转录。作者构建了包含BRE元件的pGL6萤火虫荧光素酶报告质粒,将其稳定转染至C2C12细胞中,并利用这种方法对BMP10的生物活性进行体外检测。
在作者构建的C2C12报告细胞株中,血清会对报告系统造成比较大的影响。培养基中0%、0.1%。1%、2%、5%、10%的胎牛血清(FBS)分别可以导致(1 326±200)、(3 495±270)、(10 692±1 414)、(21 933± 1 615)、(42 816±3 269)、(73 792±4 601)相对荧光素酶单位(RLU)的非特异性信号。因此将检测过程的培养基血清含量降低至0.1%, 以保证较高的信噪比。
检测过程中使用浓度10 ng/mL的rhBMP10来测定rhBMP10的生物活性。未转染质粒的空白对照、加入CHO-S空细胞培养上清、TGF-β或是PBS的C2C12细胞几乎不表达萤火虫荧光素酶,其信号值依次为(22±9)、(2 652±405)、(3 585±297)、(3 315±366) RLU,说明该检测系统的特异性较好,噪音值较低。从R&D购买的BMP10 GFD二聚体在10 ng/mL浓度时的信号值为(67 640±8 535) RLU。同等浓度下, CHO-BMP10表达并纯化的rhBMP10可以诱导表达(86 367±2 685) RLU, 证实CHO-BMP10表达并纯化的rhBMP10具有很好的生物活性。
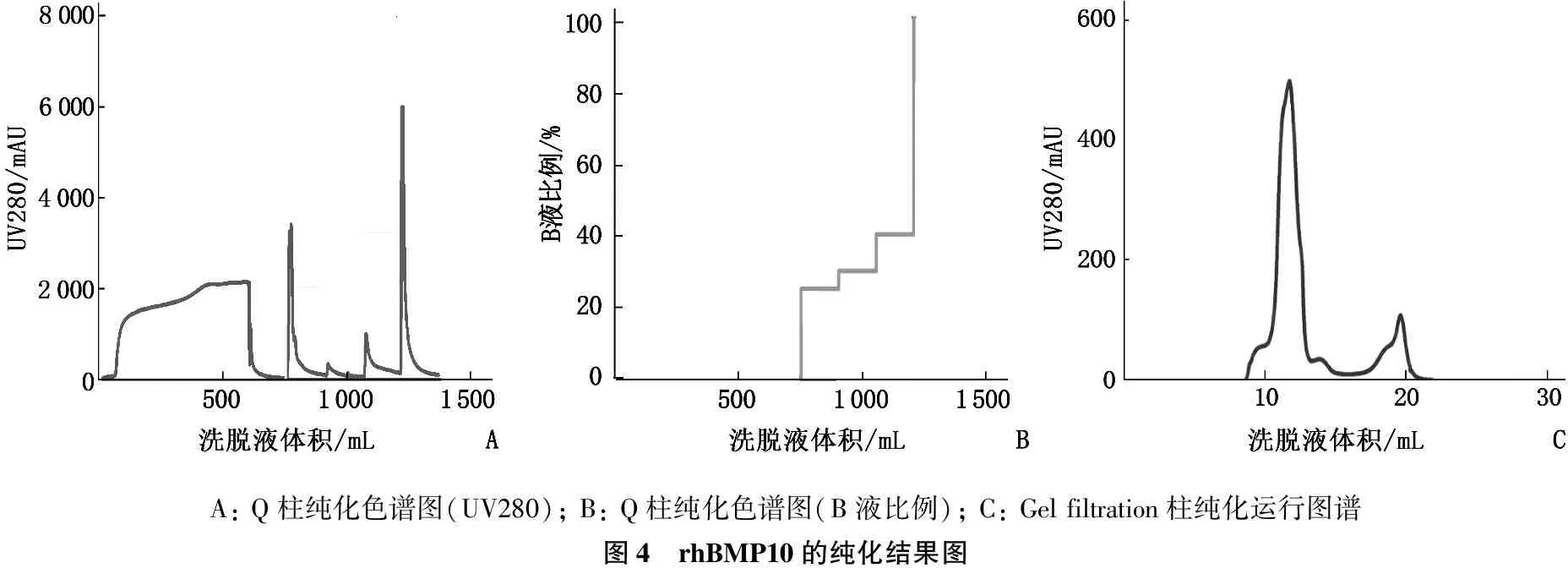
A: Q柱纯化色谱图(UV280); B: Q柱纯化色谱图(B液比例); C: Gel filtration柱纯化运行图谱图4 rhBMP10的纯化结果图
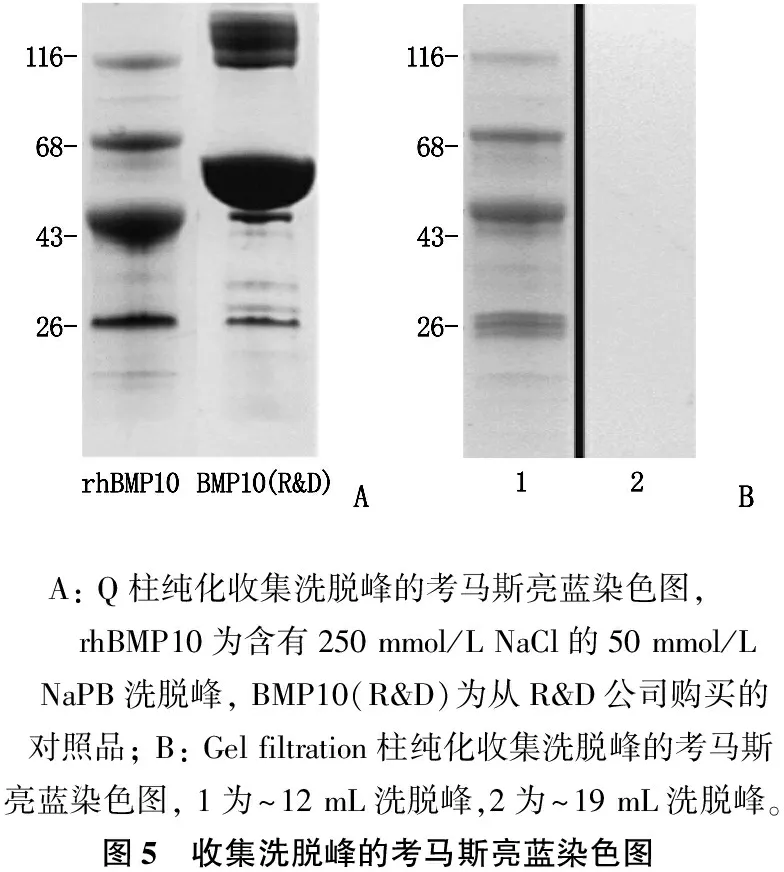
A: Q柱纯化收集洗脱峰的考马斯亮蓝染色图, rhBMP10为含有250 mmol/L NaCl的50 mmol/L NaPB洗脱峰, BMP10(R&D)为从R&D公司购买的对照品; B: Gel filtration柱纯化收集洗脱峰的考马斯亮蓝染色图, 1为~12 mL洗脱峰,2为~19 mL洗脱峰。图5 收集洗脱峰的考马斯亮蓝染色图
2.5 超声心动图
为了评价多柔比星对小鼠心脏收缩和舒张功能的损伤,作者使用经胸廓超声心动图来检测小鼠的心功能(n=4)。通过使用超高频率的超声探头,并配合M mode超声,可以无损地对小鼠的左室功能进行定量分析。与Saline组相比,DOX模型组的小鼠心脏功能出现了明显下降,其短轴缩短率为(40.4±2.8)%, 较Saline组(58.0±2.8)%出现了显著下降(P<0.01), 提示多柔比星模型组小鼠心肌的收缩功能受损,心功能下降。在rhBMP10组(52.7±2.9)%和DOX+rhBMP10联合给药组(52.6±4.1)%小鼠的超声结果中,小鼠的心脏功能与Saline组相比差异无显著性。见图6。
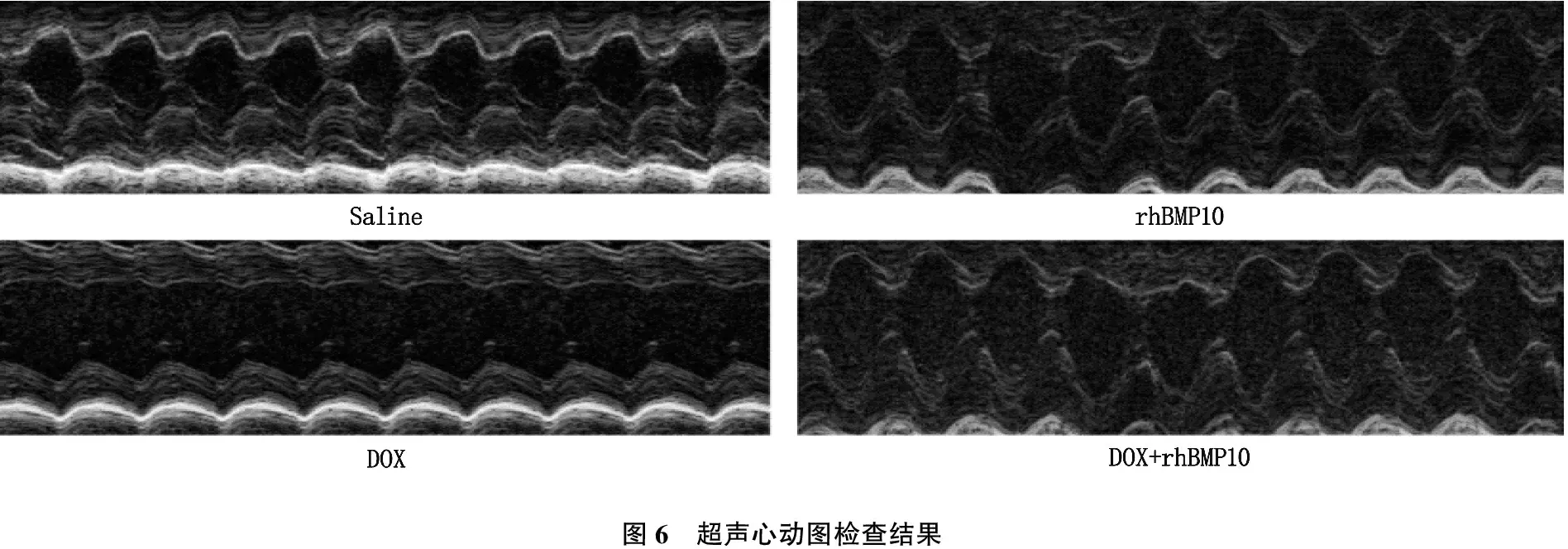
图6 超声心动图检查结果
2.6 血清心肌损伤标志物检测
在DOX处理组中,小鼠血清中的心肌肌钙蛋白I(cTnI)和肌红蛋白(Mb)水平分别为(138.5±23.8)、(292.2±20.4) ng/mL, 显著高于Saline组中的(98.8±5.9)、(157.9±19.2) ng/mL和rhBMP10组中的(112.3±5.8)、(150.9±40.3) ng/mL, 提示心肌细胞受损。而DOX+rhBMP10组小鼠中, cTnI和Mb水平分别为(106.7±8.0)、(175.4±21.8) ng/mL。见表2。

表2 各组血清心肌肌钙蛋白Ⅰ、肌红蛋白水平比较
cTnI: 心肌肌钙蛋白Ⅰ; Mb: 肌红蛋白。与DOX组比较, *P<0.05, **P<0.01。
2.7 TUNEL
TUNEL检测中, DOX组小鼠的心脏凋亡比例显著上升(P<0.01), 达到(0.236±0.082)%, 高于DOX+rhBMP10组(0.038±0.028)%和Saline组(0.011±0.020)%。在rhBMP10对照组中,心肌细胞的凋亡比例为(0.022±0.022)%。见图7。
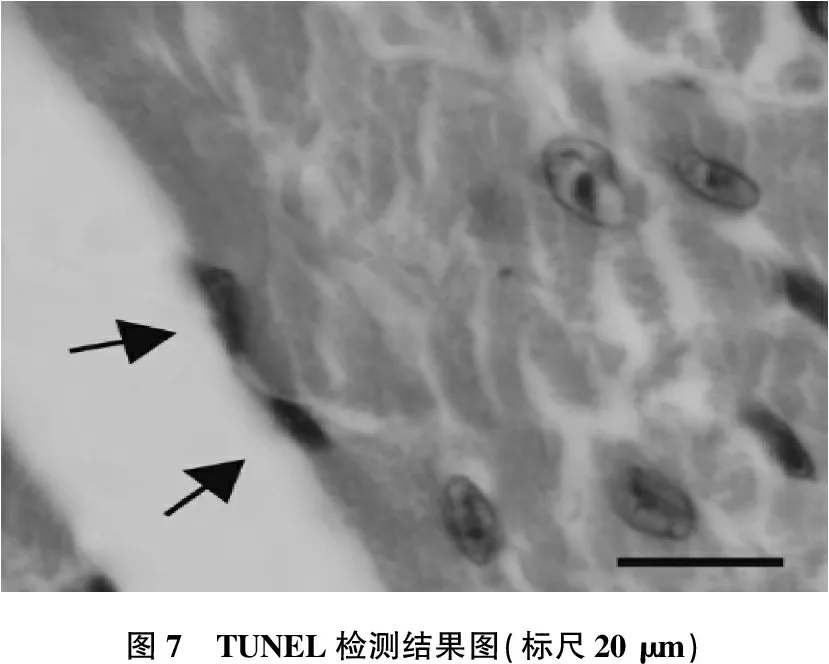
图7 TUNEL检测结果图(标尺20 μm)
3 讨 论
骨形态发生蛋白(BMP)属于TGF-β超家族。BMP的所有成员在蛋白质序列中具有独特的同一性,并且具有相似的蛋白质结构,但具有不同的组织分布和生物学功能。在心脏中发现了6个BMP成员的表达,其中包括BMP2、BMP4、BMP5、BMP6、BMP7和BMP10, 且已被证明参与了心脏发育的多个步骤。BMP10的表达主要存在于心脏[15]。BMP2和BMP4的表达较为广泛,并参与心源性诱导和心内膜垫形成[15, 18]。
研究[19]显示, BMP5、BMP6和BMP7在早期心脏发育中调节心室壁和腔室形成。已知BMP10可在某些心脏病发病条件下重新激活[16], 但BMP10在出生后心脏中的生物学功能尚不清楚。通常情况下, BMP通过与Ⅰ型和Ⅱ型丝氨酸/苏氨酸激酶受体结合,磷酸化Smad1/5/8蛋白并发挥其生物学活性[20-21]。作者的前期研究表明,出生后心脏中BMP10的转基因过表达显著降低了心肌细胞肥大性生长,同时不影响运动诱导的心脏肥大和对β-肾上腺素能激动剂异丙肾上腺素的肥大反应(即模拟病理性肥大)。这些研究表明BMP10可能是一种心脏保护试剂。
本研究中,作者制备了具有高生物活性的rhBMP10蛋白,通过高剂量、多次的多柔比星注射构建了多柔比星诱导的小鼠心脏病模型,并证明了rhBMP10的使用可以减轻多柔比星引起的心功能下降、心肌细胞损伤和凋亡。通过分析rhBMP10对多柔比星介导的心脏毒性的影响,进一步证实了BMP10在心脏保护方面的积极意义。

