东北雷公藤DXR HMGR基因克隆及生物信息学分析△
郭思远,闫琦,李佳
首都医科大学 中医药学院,北京 100069
东北雷公藤TripterygiumregeliiSpragus et Takeda系卫矛科Celastraceae雷公藤属植物,主要含有二萜类、三萜类、生物碱类等成分,具有免疫调节[1]、抗炎[2]、抗肿瘤[3]等作用。萜类化合物(如雷公藤红素等)是东北雷公藤主要生物活性物质之一[4],其分子结构以异戊二烯为基本单位,经由甲羟戊酸(mevalonate,MVA)途径和甲基赤藓醇4-磷酸(methylerythritol 4-phosphate,MEP)途径生物合成。研究表明[5],HMGR和DXR分别是MVA途径和MEP途径的关键酶,其基因表达水平可直接影响植物萜类物质的合成。
本研究克隆获得TrDXR、TrHMGR基因全长,并对其所编码的蛋白进行理化性质、信号肽、跨膜结构域、亚细胞定位、二三级结构预测及同源性和系统进化树分析,为鉴定TrDXR和TrHMGR基因功能、揭示雷公藤属植物萜类物质分子形成机制奠定基础。
1 材料与方法
1.1 材料
东北雷公藤采自吉林通化,经首都医科大学李佳教授鉴定为卫矛科植物东北雷公藤TripterygiumregeliiSpragus et Takeda。取其根、茎洗净后至于-80 ℃冰箱保存备用。
1.2 方法
1.2.1 RNA提取及反转录 以CTAB法提取东北雷公藤根和茎混合总RNA,使用1.0%琼脂糖凝胶电泳进行检测。参照SMARTer RACE 5′/3′ kit试剂盒(日本TaKaRa公司)说明书,将RNA反转录合成cDNA。
1.2.2 东北雷公藤TrDXR、TrHMGR基因克隆 分析东北雷公藤转录组数据,筛选得到TrDXR基因2条,TrHMGR基因4条,经分析其中1条TrDXR基因,1条TrHMGR基因为全长。使用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)在线软件对序列进行开放阅读框(open reading frame,ORF)分析,运用Primer Premier 5.0 软件在ORF两端设计引物(见表1)。引物序列委托北京睿博兴科生物技术有限公司合成。

表1 PCR引物
以东北雷公藤cDNA为模板进行PCR,50 μL反应体系包括:2×Phusion HF PCR Master Mix 25 μL,cDNA模板2 μL,正、反向引物各1.5 μL,ddH2O 20 μL。反应条件为:98 ℃预变性30 s;98 ℃变性10 s,58 ℃退火15 s,72 ℃延伸1 min,循环35次;72 ℃延伸5 min,4 ℃保存。
PCR产物经1.5%琼脂糖凝胶电泳后按DNA纯化回收试剂盒(天根生物公司)说明书纯化回收,并与Trans pEASY-βzero克隆载体连接。连接产物转化至大肠杆菌Trans1-T1感受态细胞,在含有氨苄的LB固体培养基上培养约14 h,挑取阳性单菌落于液体培养基培养约6 h,菌液PCR无误后送至北京睿博兴科生物技术有限公司测序。
1.2.3 东北雷公藤TrDXR、TrHMGR基因生物信息学分析 使用SeqMan软件对测序结果进行分析,使用Editseq软件将测序正确的核苷酸序列翻译成氨基酸序列。使用ExPASy中ProtParam工具(http://web.expasy.org/protparam)预测蛋白相对分子质量与理论等电点;TargetP 3.0 server(http://www.cbs.dtu. dk/services/TargetP/)进行信号肽分析;TRMHMM server v2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行跨膜结构分析;ProtComp Version 9.0(http://www.softberry.com/berry.phtml)分析亚细胞定位;PRABI-GERLAND(https://npsa-prabi.ibcp.fr/)进行二级结构预测;SWISS-MODEL(http://swissmodel.expasy.org/)进行三维模型预测。使用NCBI(http://www.ncbi.nlm.nih.gov)中蛋白-蛋白BLAST工具进行氨基酸序列比对,根据BLAST结果下载同源序列,使用DNAMAN进行多重比对,并根据多重比对结果用MEGA 6.0软件构建Neighbor-joining系统进化树。
2 结果
2.1 RNA提取及反转录结果
取东北雷公藤混合总RNA进行1.0%琼脂糖凝胶电泳检测(见图1),28 S和18 S条带清晰完整。经超微量分光光度计检测,总RNA质量浓度为300~400 ng·μL-1,A260 nm/A280 nm介于2.0~2.2,A260 nm/A230 nm>1.8,符合实验要求,可进行下步实验。cDNA能扩增出目的基因,说明反转录成功。

图1 东北雷公藤总RNA琼脂糖凝胶电泳图
2.2 东北雷公藤TrDXR、TrHMGR基因克隆结果
取PCR产物进行1.5%琼脂糖凝胶电泳检测(见图2),目的条带在1500~2000 bp,与预期长度一致。阳性菌液测序结果与预期序列对比,序列相似度99%,表明克隆成功。TrDXR基因ORF区长度为1410 bp,编码氨基酸469个;TrHMGR基因ORF区长度为1770 bp,编码氨基酸589个。

注:1~2泳道对应的基因为TrHMGR;3~4泳道对应的基因为TrDXR。图2 TrDXR、TrHMGR基因电泳图
2.3 理化性质预测
TrDXR蛋白的相对分子质量为51 126.87 kDa,理论等电点为5.94,为酸性蛋白。带正电残基为54,带负电残基为47;该蛋白的不稳定系数为41.37,属于不稳定蛋白;脂肪系数为97.76,亲水性系数为-0.044,预测该蛋白为亲水性蛋白。TrHMGR蛋白的相对分子质量为61 583.08 kDa,理论等电点为6.62,为酸性蛋白。带正电残基为57,带负电残基为56;该蛋白的不稳定系数为41.92,属于不稳定蛋白;脂肪系数为95.47,亲水性系数为0.130,预测该蛋白为疏水性蛋白。半衰期体外预测,两者均在哺乳动物的网织红细胞中为30 h,在酵母菌中>20 h,在大肠杆菌中>10 h。
2.4 转运肽分析
TrDXR叶绿体转运肽得分为0.905、线粒体转运肽得分为0.078、分泌途径转运肽得分为0.017,其他得分为0.083,定位于叶绿体,RC为1。TrHMGR叶绿体转运肽的分数是0.001 1、线粒体转运肽的分数是0.472、分泌途径转运肽的分数是0.047,其他的分数是0.041 3,无定位,RC为5。因此初步认定TrDXR存在转运肽,定位于叶绿体;TrHMGR不存在转运肽。
2.5 跨膜结构域与亚细胞定位分析
跨膜结构域分析显示,TrDXR为膜外蛋白,不存在跨膜结构;TrHMGR为跨膜蛋白,蛋白49~71和92~114氨基酸区域为跨膜结构区(见图3)。亚细胞定位预测显示,TrDXR定位于叶绿体,TrHMGR定位于内质网。研究认为MEP途径与MVA途径分别定位于质体和细胞质,亚细胞定位预测结果与研究结果相符[6]。

注:A.TrDXR;B.TrHMGR。图3 跨膜结构域分析
2.6 二级结构及三级结构模型预测分析
二级结构预测显示,TrDXR蛋白α螺旋占39.02%,延伸链占11.30%,随机卷曲占49.68%;TrHMGR蛋白α螺旋占42.67%,延伸链占2.67%,随机卷曲占54.67%(见图4)。三维模型预测分析显示,TrDXR以1jvs.1.B蛋白为模板进行同源建模,建模范围为73~462位氨基酸,序列同源性为43.38%。TrDXR的N-端和C-端在空间结构上折叠成V形,其内部含有多个氨基酸残基可与烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和硫酸根离子(SULFATE ION)结合。TrHMGR以1dq 9.1.C蛋白为模板进行同源建模,建模范围为171~555位氨基酸,序列同源性为55.64%。TrHMGR含有4个3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)结合域,由4个高度保守区域经折叠后两两组成(见图5)。
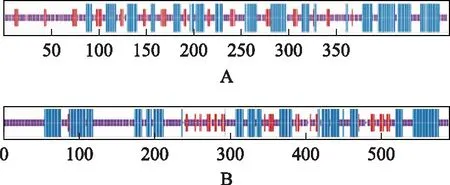
注:A.TrDXR;B.TrHMGR;蓝色:α螺旋;红色:延伸链;绿色:β转角;紫色:无规则卷曲。图4 TrDXR、TrHMGR蛋白二级结构预测
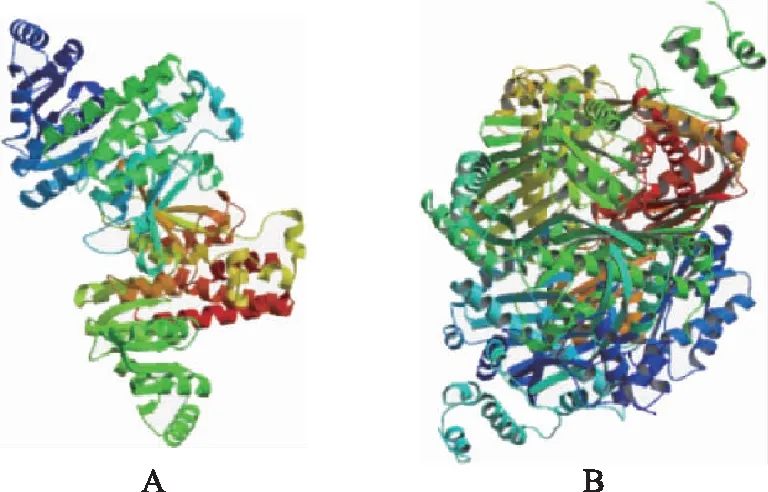
注:A.TrDXR;B.TrHMGR。图5 TrDXR、TrHMGR蛋白三维模型预测
2.7 多序列比对及系统进化树分析
选取不同物种已表征功能的DXR和HMGR构建系统进化树(见图6~7),结果显示TrDXR和TrHMGR编码氨基酸分别与雷公藤DXR和HMGR聚类为一支,置信度高达100,亲缘关系最近。根据系统进化分析结果选取亲缘关系较近的蛋白序列进行多序列比对(见图8~9),结果显示TrDXR与同源蛋白序列一致性为92.44%,TrHMGR与同源蛋白序列一致性为88.22%。由此可见东北雷公藤DXR和HMGR与不同物种同源序列的相似性高,保守性强。TrDXR在其N-端含有2个烟酰胺腺嘌呤二核苷酸磷酸(NADPH)结合功能域GSTGSIGT和LAAGSNV,在其肽链中间含有2个DXR活性位点PADSEHSAS和NKGLEVIEAHY;TrHMGR在其N-端含有2个3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)结合功能域EMPVGYVQIP和TTEGCLVA,在其C-端含有2个NADPH结合功能域DAMGMNM和GTVGGGT。这些结合功能域和活性位点对植物DXR和HMGR功能至关重要,因此在进化时高度保守。

图6 TrDXR的系统进化树

图7 TrHMGR的系统进化树

图8 不同植物DXR氨基酸序列的多重比对

图9 不同植物HMGR氨基酸序列的多重比对
3 讨论
雷公藤甲素和雷公藤红素等萜类化合物是雷公藤的主要活性成分,其在植物体内主要由MEP途径和MVA途径进行生物合成。HMGR和DXR分别是MVA途径和MEP途径的限速酶[7-8],研究表明,过表达TwHMGR基因可使雷公藤悬浮细胞中雷公藤甲素和雷公藤红素的含量显著上升[9],过表达TwHMGR基因和TwDXR基因可使雷公藤发状根中雷公藤内酯醇、雷公藤吉碱和雷公藤次碱的含量明显升高[10],而抑制雷公藤DXR基因的表达可使悬浮细胞中雷公藤红素和雷公藤内酯醇含量下降[11]。由此可见,DXR和HMGR基因在调控雷公藤甲素、红素等萜类物质的生物合成中发挥着重要作用。但也有文献指出,基因表达存在着复杂的调节机制[12-13],对途径上游基因的调节能否专一性改变特定化合物的产量还有待进一步研究[14]。
研究表明,雷公藤属植物中均含有雷公藤甲素和雷公藤红素[15],且东北雷公藤根中雷公藤红素的含量明显高于其他两个物种[16]。因此,本研究拟通过基因克隆及生物信息学分析初步探究东北雷公藤中萜类成分生物合成关键酶基因TrHMGR、TrDXR的生物功能,以挖掘更多具有相似功能的基因序列,丰富可用的基因资源。本研究获得东北雷公藤DXR、HMGR基因各1条,并对其理化性质、蛋白结构、亲缘关系及功能位点进行了预测,为下一步鉴定基因功能打下基础,为进一步通过基因改良手段提高东北雷公藤中萜类成分含量、利用合成生物学策略异源高产雷公藤红素甲素做出铺垫。

