干扰EZH2表达对B淋巴瘤Ramos细胞的辐射增敏作用及其机制研究
信 瑞,田建国,姜 民,曲丹华
(1.吉林大学第二医院 放射线科,吉林 长春130041;2.吉林省辐射环境监督站,吉林 长春130000;3.吉林大学公共卫生学院,吉林 长春 130021;4.吉林大学第二医院 呼吸与危重症医学科,吉林 长春130041)
淋巴瘤是起源于淋巴造血系统的恶性肿瘤,根据淋巴瘤的细胞起源可分为B细胞型、T细胞型和NK细胞型,其中70%患者为B细胞淋巴瘤[1]。长期以来,放射治疗是大部分惰性淋巴瘤和预后较好的早期淋巴瘤的主要治疗手段,对于部分化疗抗拒的侵袭性淋巴瘤,放疗也是其主要治疗手段。而对高度恶性的淋巴瘤,放射治疗仅能起到姑息治疗或降低局部复发率的效果[2],因此如何改善淋巴瘤的放疗抗性是淋巴瘤研究的热点之一。
Zeste同源物增强子2(enhancer of zeste homolog 2,EZH2)是多梳蛋白抑制复合体2(polycomb repressive complex 2,PRC2)家族的成员之一,能通过催化组蛋白H3第27位赖氨酸三甲基化(H3K27me3)抑制基因转录[3]。EZH2在包括淋巴瘤[4]、多形性成胶质细胞瘤[5]、乳腺癌[6]、卵巢癌[7]、转移性前列腺癌[8]等多种类型癌症中过表达,并与肿瘤的增殖、侵袭、不良预后密切相关。本课题以非霍奇金B细胞淋巴瘤Ramos细胞为研究对象,采用shRNA技术干扰EZH2表达,观察EZH2对Ramos细胞辐射敏感性的影响,初步探究其分子机制,以期为B细胞淋巴瘤的辐射增敏治疗提供实验依据。
1 材料与方法
1.1 主要试剂人B淋巴瘤Ramos细胞购自中科院上海细胞中心;RPMI-l640培养基购自Gibco公司;胎牛血清购自杭州四季青公司;shEZH2和阴性shRNA购自广州瑞博生物科技公司;lipofectamine TM2000试剂盒购自北京天根公司; Annexin V-FITC/PI细胞凋亡检测试剂盒和CCK8试剂盒购自南京建成生物科技公司;结晶紫购自北京索莱宝生物科技公司;Bax、Bcl2一抗购自美国Abcam公司; EZH2、p53及NF-kB一抗购自美国santa公司;羊抗兔二抗购自美国santa公司。
1.2 细胞培养与转染Ramos细胞培养于37℃的CO2培养箱中,使用含10%胎牛血清的RPMI-l640培养基。每2天更换培养基1次,待细胞融合超过80%时传代培养。取对数期生长的细胞,接种于6孔板中,每孔5.0×105个细胞,按lipofeetamine TM2000说明书进行转染,同时设置空白对照组、阴性shRNA组和shEZH2组。
1.3 照射方法采用GC3000 Elan辐射器(MDS Nordion,加拿大),使用137Cs-ray放射源,源皮距为100 cm,活度为50.7E+12 Bq。
1.4 CCK8实验收集对数期生长的细胞,接种于96-孔板中,每孔5×103个细胞,在37℃ CO2细胞培养箱中孵育24 h,每组设5个平行。采用4 Gy γ-射线辐射处理,连续培养24-96 h。培养结束后,每孔加入20 μl CCK8试剂,避光培养4 h,使用酶标仪测定在OD450 nm处各孔的吸光值,计算细胞数目。
1.5 克隆形成实验收集对数生长期细胞,接种于6孔板中,调整细胞密度至每孔5.0×105个,每组设置3个平行。于CO2细胞培养箱中孵育24 h,孵育后给予0、2、4、6、8、10 Gy γ-射线辐射。辐射结束后于CO2细胞培养箱中继续培养12 d,每3 d进行一次换液。待细胞的单克隆集落形成后,甲醇固定并0.2%结晶紫染色,计数大于50个细胞的单克隆数和单克隆直径。采用多靶单击模型绘制细胞存活曲线。
1.6 流式细胞术收集对数生长期细胞,接种于6孔板中,调整细胞密度至每孔5.0×105个,每组设置3个平行。于CO2细胞培养箱中孵育24 h,孵育后给予4 Gy γ-射线辐射。辐射结束后于CO2细胞培养箱中培养48 h。细胞凋亡检测使用Annexin V-FITC/PI细胞凋亡检测试剂盒,离心收集细胞,洗涤后分散于200 μl标记缓冲液中。先加入10 μl Annexin V-FITC避光室温反应15 min,再加入0.05 g/L PI染液4℃避光染色5 min,最后使用流式细胞仪检测,使用CellQuest3.0软件进行结果分析。
1.7 western bloting收集经过4 Gy γ-射线辐射的3组细胞,100 μl冰预冷的蛋白裂解液充分裂解细胞,离心收集上清液。使用考马斯亮蓝法测定蛋白浓度,上样20 μg蛋白行SDS-PAGE 聚丙烯酰胺凝胶电泳。将电泳条带转移至硝酸纤维膜,室温条件下的封闭液中孵育30 min,与一抗室温孵育60 min,洗膜后与二抗孵育60 min。显色后的条带使用Gel-Pro 凝胶成像系统灰度扫描,使用Quantity One软件分析光密度值。

2 结果
2.1 Western bloting检测shEZH2转染前后EZH2蛋白表达水平变化shEZH2转染48 h之后,shEZH2组相对于空白对照组和阴性shRNA组EZH2 蛋白表达量均显著降低,差距有统计学意义(P=0.003;P=0.004),见图1。
2.2 CCK8检测对shEZH2对Ramos细胞体外增殖的影响shEZH2转染后,shEZH2组细胞增殖速度降低并呈下降趋势,其72 h、96 h细胞数目显著低于对照组细胞(P=0.017;P=0.002)和阴性shRNA组(P=0.019;P=0.003),干扰EZH2表达明显抑制了Ramos细胞的增殖,见图2。
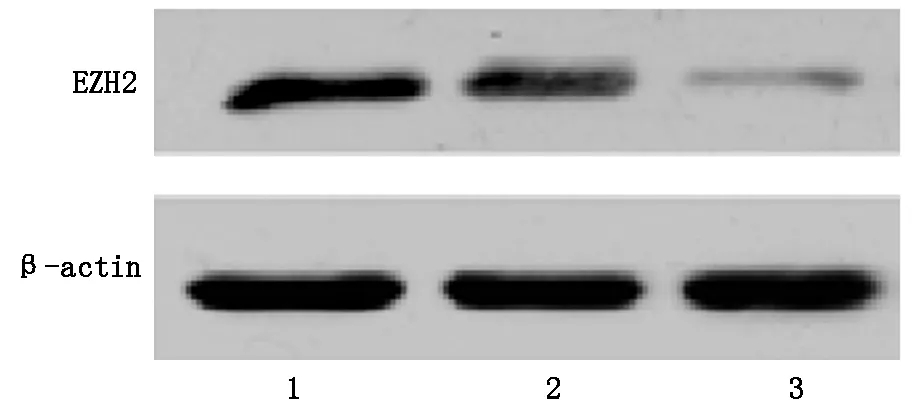
图1 shEZH2转染对Ramos细胞中EZH2蛋白表达的影响
注:1为空白对照组;2为阴性shRNA组;3为shEZH2组
2.3 克隆形成实验检测shEZH2对Ramos细胞辐射敏感性的影响培养12 d时测定细胞克隆数目和克隆半径,相对于阴性shRNA组,shEZH2组克隆数目和克隆半径显著降低(P=0.035;P=0.038);当联合2 Gy γ-射线辐射时,shEZH2组克隆数目和克隆半径进一步降低,并显著低于阴性shRNA组(P=0.027;P=0.031),见图3。用多靶单击模型分析显示shEZH2组细胞存活分数显著低于空白对照组和阴性shRNA组(P=0.013;P=0.016),Ramos细胞的SERDO值比为1.73,见表1。
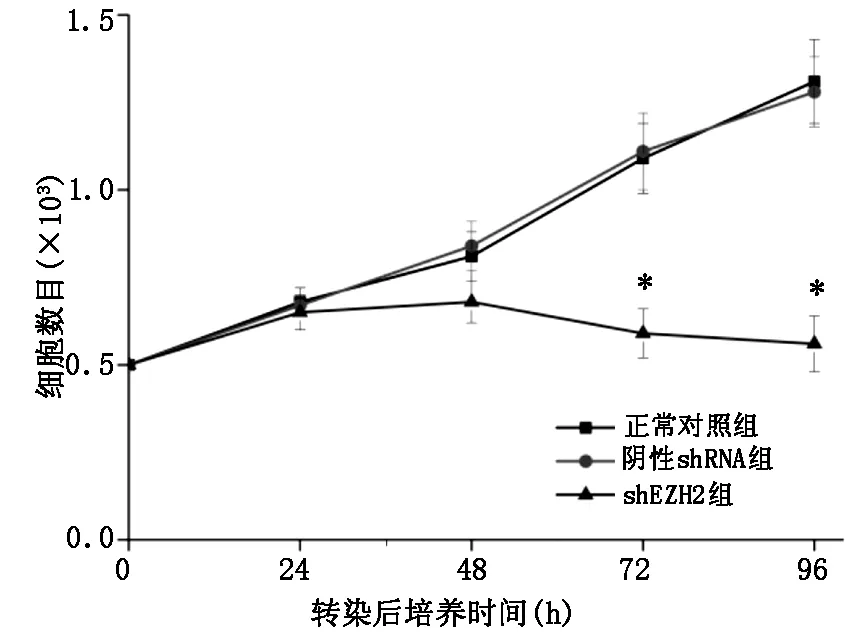
图2 shEZH2转染对Ramos细胞细胞增殖的影响
注:与阴性shRNA组相比*P<0.05;**P<0.01。

图3 shEZH2转染联合γ-辐射对HeLa细胞克隆形成的影响
注:3A为克隆数目;3B为克隆直径;1:空白对照组;2:阴性shRNA组;3:shEZH2组;4:空白对照组+γ-辐射;5:阴性shRNA组+γ-辐射;6:shEZH2组+γ-辐射;与阴性shRNA组相比*P<0.05;**P<0.01。

表1 Ramos细胞不同剂量γ线照射后单击多靶模型拟合曲线参数
2.4 流式细胞仪检测细胞凋亡和细胞周期的变化shRNA转染后24 h后,shEZH2相对于空白对照组和阴性shRNA组细胞凋亡率显著升高(P=0.027;P=0.029);协同给予γ-射线辐射处理后,shEZH2组细胞凋亡率进一步升高,显著高于空白对照组和阴性shRNA组(P=0.016;P=0.017),见图4。细胞周期分析显示,给予辐射处理时阴性shRNA组G0+G1期占比为(57.43±5.82)%,S期占比为(24.63±3.56)%,G2期和M期占比为(17.94±2.17)%;而shEZH2组G0+G1期占比为(39.28±4.18)%,细胞占比明显降低(P=0.016),S期占比为(21.29±2.85)%,无明显差异(P=0.025),G2期和M期占比为(39.43±3.69)%,明显升高(P=0.019),产生了明显的G2/M期细胞阻滞,见图5。
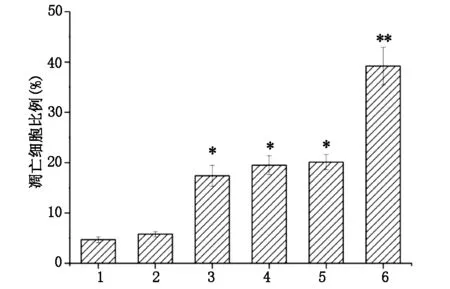
图4 shEZH2转染联合γ-射线辐射对Ramos细胞凋亡率的影响
注:相对于阴性shRNA组*P<0.05;**P<0.01
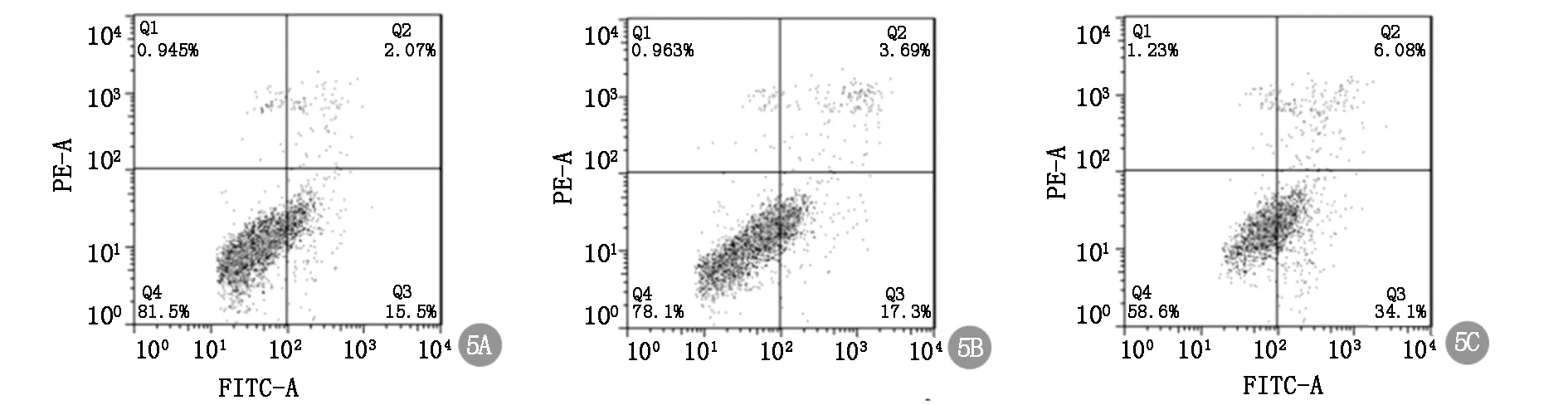
图5 shEZH2转染联合γ-射线辐射对Ramos细胞细胞周期影响的流式细胞术分析(5A为空白对照组;5B为阴性shRNA组;5C为shEZH2组)
2.5 Western bloting检测NF-κB通路蛋白表达的变化shRNA转染后24 h后,shEZH2相对于阴性shRNA组细胞NF-kB、p53、Bax表达均显著降低(P=0.008;P=0.025;P=0.014);而Bcl-2表达却显著升高(P=0.035),见图6。
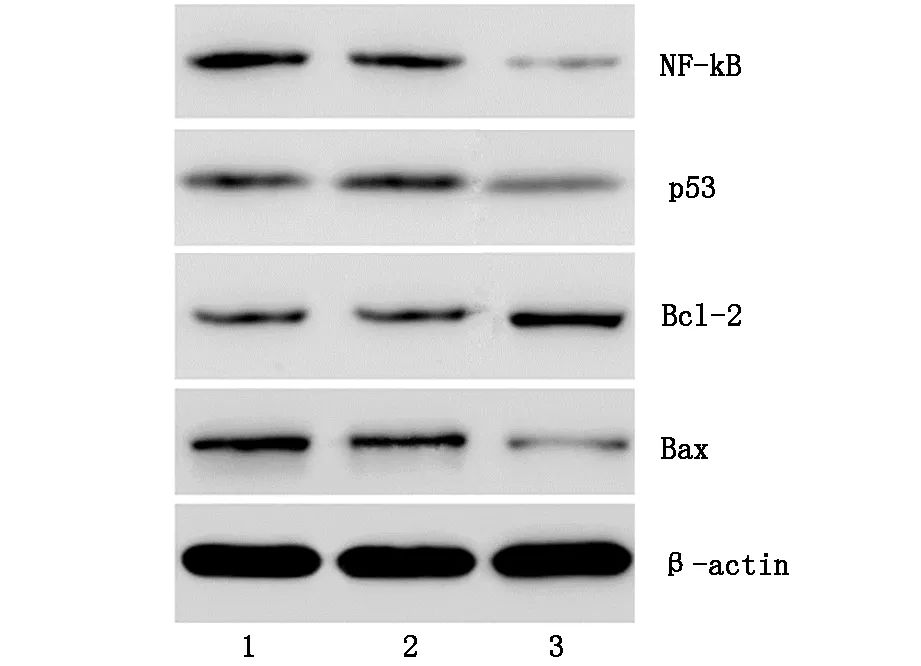
图6 shEZH2转染联合γ-射线对Ramos细胞Bcl-2、Bax、NF-kB、p53表达的影响
注1:空白对照组;2:阴性shRNA组;3:shEZH2组。
3 讨论
恶性淋巴瘤是严重威胁人类健康的淋巴造血系统疾病,放疗是恶性淋巴瘤的传统治疗手段之一。随着淋巴瘤病理分类的广泛应用,部分病理类型在肿瘤早期疗效较好,而对于耐药、复发的恶性病变当前缺少合理的治疗手段,并且20-30%的淋巴瘤患者放疗后出现局部复发,提示淋巴瘤中存在辐射耐受现象[9]。
近年来,表观遗传学调节在肿瘤发生、转移及侵袭中调控作用得到了临床研究的广泛关注。EZH2是PPC2家族的成员,是机体唯一的H3K27甲基化催化酶,与组蛋白甲基化修饰有关。人EZH2基因位于染色体的7q36.1,是一种进化高度保守的基因,含有20个外显子和19个内含子,其编码的产物能够行使组蛋白赖氨酸N-端甲基转移酶功能。EZH2能够通过H3K27me3甲基化进一步招募DNA甲基转移酶,也能通过H2AK119泛素化结合去乙酰化酶,通过组蛋白和DNA修饰干扰抑癌基因[10]。EZH2在细胞周期、细胞定向分化、细胞衰老和细胞复制方面发挥重要的调节作用,具有强大的促癌功能。EZH2在多种肿瘤组织中过表达,并且并与肿瘤的增殖、侵袭、不良预后密切相关[4-8]。Wagener[11]等收集了127例非霍奇金淋巴瘤组织样本,通过免疫组化染色发现EZH2阳性染色率高发89%,其中86%的样本核染色强阳性,证实EZH2在淋巴瘤组织中异常表达。Velichutina[12]等研究发现,EZH2在B淋巴细胞的发育早期发挥重要的调节作用,通过甲基化修饰调控免疫球蛋白IgH的重排,并且其高表达增加了淋巴瘤发生风险。EZH2与多种肿瘤的侵袭性亚类群密切相关,被视为一种有潜力的肿瘤治疗靶点,但是其在淋巴瘤放射敏感性方面的影响尚未见报道。
本研究以人B淋巴瘤Ramos细胞为研究对象,应用shRNA转染技术沉默EZH2表达,发现EZH2的沉默明显降低了Ramos细胞的增殖能力,提示EZH2参与调控Ramos细胞增值活性,与先前报道中EZH2沉默抑制淋巴瘤细胞增殖能力的结果类似。Cabrero[13]等应用siRNA干扰了Namalwa、Ramos和naji 3种恶性淋巴瘤细胞系中EZH2表达,明显降低3种细胞增值能力,并上调了NF-kB、HIF-α、IKK等蛋白的表达水平。并且克隆形成实验显示在γ-射线辐射条件下,EZH2的沉默明显降低了Ramos细胞克隆形成能力,其放射增敏比为1.73,提示EZH2参与Ramos细胞辐射抗性的形成。
DNA断裂损伤修复能力改变引发的细胞周期失控是淋巴瘤放疗抗拒和放疗失败重要原因之一。EZH2在B淋巴祖细胞发育过程中广泛表达,Fussbroich[14]研究发现在敲除EZH2的小鼠中,B细胞发育受阻, G1/S期细胞周期停滞,并产生免疫球蛋白重链重排减少和早期淋巴细胞增殖缺陷。本研究中流式细胞术分析显示,给予γ-射线辐射处理时,EZH2沉默的Ramos细胞凋亡率明显提高, G0/G1期占比为细胞占比明显降低,S期占比无明显差异, G2/M期占比明显升高,这提示本研究中EZH2沉默使Ramos细胞积累在对放射相对敏感的G2/M期,提高了细胞凋亡水平。
NF-kB是一种具有特异DNA结合序列的核转录调控因子,广泛参与细胞周期阻滞、DNA损伤修复,能通过调节150多种效应基因调节肿瘤的辐射敏感性[15]。在淋巴瘤等多种肿瘤中均存在NF-kB的表达活化,NF-KB的活化促进淋巴组织不断的增殖是淋巴瘤发生的重要风险因素[16]。本研究发现抑制EZH2显著降低了NF-kB的表达。典型的衰老蛋白p53是NF-kB的下游靶蛋白,与细胞增殖、凋亡、周期调控等生命活动密切相关,本研究中p53的表达同样降低。Bcl-2和Bax是p53的下游靶基因, BCL-2的过量表达抑制细胞凋亡,延长肿瘤细胞生存,造成B细胞的累积和恶变, 高比率的Bcl-2/Bax能够降低放疗过程中肿瘤细胞凋亡,保护肿瘤细胞。本研究中抑制EZH2引发了Bcl-2和Bax表达改变,升高了Bcl-2/Bax比率,这提示EZH2沉默能抑制Ramos细胞中的NF-kB活化,并能进而改变下游蛋白的表达,提高Ramos细胞辐射敏感性。
总之,本研究明确了EZH2在人B淋巴瘤细胞中的辐射增敏作用,其机制与细胞周期G2/M期细胞积累和调控NF-κB通路有关,为B细胞淋巴瘤的临床靶向治疗提供实验依据。

