阻塞性睡眠呼吸暂停低通气综合征患者气道炎症及气管壁厚度变化的研究
曾余丰,陈琼琰,郑国君
(温州市中西医结合医院, 浙江 温州 325000)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是在睡眠时,上气道塌陷频繁出现,导致睡眠中不断打鼾,并且伴有呼吸暂停或者低通气。患者主要表现为日间嗜睡,晨起头痛等,严重影响患者的工作和生活[1-2]。OSAHS患者多伴有气道炎性反应,炎性反应严重伤害患者的健康,且具有动脉粥样硬化的OSAHS患者更易并发心血管并发症。本研究选取我院62阻塞性睡眠呼吸暂停低通气综合征患者,观察其气道炎症及气道壁厚度的变化,并与62例健康体检者进行对比研究,现报告如下。
1 资料和方法
1.1 一般资料
选取我院2015年10月至2017年12月的62例阻塞性睡眠呼吸暂停低通气综合征患者作为观察组。纳入标准:所有患者经过确诊,符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)》[3]诊断标准,并且明确研究目的,签署知情同意书。排除标准:合并有认知功能障碍、心功能不全等患者;合并严重支气管扩张、支气管哮喘、肺部肿瘤、肺大泡等患者;近期有使用免疫抑制剂、糖皮质激素的患者;无法进行无创正压通气(positive pressure ventilation,PAP)治疗的患者。其中男40例,女22例,年龄45~71岁,平均(63.3±5.8)岁。选取我院2015年10月到2017年12月每月1号进行体检者共62名为对照组,男39名,女23名,年龄46~70岁,平均(63.8±5.1)岁。2组性别(χ2=0.035,P=0.852)、年龄(t=0.510,P=0.610)等基本资料无差异。
1.2 方法
1.2.1 观察组患者治疗及监测方法 观察组患者进行持续气道无创正压通气(PAP)治疗。使用Polysmith型多导睡眠监测仪,检测血氧饱和度低于90%的时间百分比(CT90)、夜间最低氧饱和度(SpO2)、睡眠中平均每小时呼吸暂停+低通气次数(average hourly apnea+hypopnea number in sleep,AHI)。患者治疗首夜压力为3~4cmH2O,随着患者的入睡压力不断增加,直到打鼾消失,呼吸暂停消失。在没有吸氧的情况下,通过腕式血氧饱和度监测仪,维持90%以上的SpO2,制定压力参数7.5~13.5cmH2O。每日正压通气治疗5h以上,定期复查。连续治疗6个月。
1.3 观察指标及方法
2组入组时、观察组治疗6个月后行诱导痰白介素8(IL-8)、髓过氧化物酶(MPO)、肿瘤坏死因子α(TNF-α)、中性粒细胞计数(NEUT)、呼出气一氧化氮(eNO)、高分辨率CT检测气管壁面积占气道总横截面积百分比(WA% )、气管壁厚度比(T/ D)检测。上述指标于入组时行组间比较,观察组治疗前、治疗6个月后比较。
1.3.1 高分辨率CT扫描(High Resolution CT,HRCT)检查 检查范围从肺尖到肺底,层距10mm,层厚1.25mm,从气管隆突上下左右部位可以清晰显示支气管横截面积段水平支气管,测量其内径(L)和外径(D),计算气管壁的厚度(T),T=(D-L)/2。计算气管壁的厚度比(T/D),T/D=(D-L)/2D。计算气管壁面积占气道总横截面积的比值(WA%),WA%=(气道总横截面积-气道腔面积)/气道总横截面积。
1.3.2 eNO水平检测 使用化学发光光度法一氧化碳分析仪,根据美国胸科学会测定的指南要求,将呼出气流速度控制在5mL/s,以ppb表示结果。
1.2.3 诱导痰炎症因子及细胞计数检测 留取合格痰液:首先请受检者用清水漱口3次,然后进行痰液诱导雾化,使用3%高渗盐水15mL,将其放入雾化装置中,留取3~4mL下呼吸道痰液标本。使用低倍镜观察痰涂片,合格诱导痰标本为中性粒细胞超过25个,鳞状上皮细胞低于10个。在离心管中放入合格痰标本,振荡15min混匀,开始诱导分离,离心半径13.5cm,转速300r/min,时间20min。上清液取出,使用ELISA法检测TNF-α、IL-8、MPO水平。将沉淀物取出,瑞氏染色后进行镜检,对中性粒细胞数计数。
1.4 统计学处理
采用SPSS20.0软件对数据进行统计分析。P<0.05表示差异有统计学意义。
2 结果
2.1 气道炎症和气管壁厚度
观察组进行PAP之前的IL-8、MPO、eNO、WA%、TNF-α等指标明显高于对照组(P<0.05)。但NEUT、T/ D比较差异无统计学意义(P>0.05)。见表1。
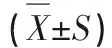
表1 2组气道炎症和气管壁厚度比较
2.2 观察组患者治疗前后气道炎症和气管壁厚度
观察组患者经过6个月PAP治疗后,IL-8、MPO、eNO、TNF-α、WA%比治疗前明显降低(P<0.05),但NEUT、T/ D治疗前后比较差异无统计学意义(P>0.05)。见表2。
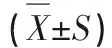
表2 观察组患者治疗前后气道炎症和气管壁厚度比较
3 讨论
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种影响公众健康的慢性呼吸系统疾病,容易诱发氧化应激和气道炎症,有一定的潜在危险性,造成患者睡眠不足、胸腔负压增加、长期缺氧等问题[3-4]。OSAHS主要发病机制是低氧和氧化应激,与缺血再灌损伤类似。活性氧自由基和炎性细胞因子大量产生,从而影响炎症和损伤。本次研究显示,OSAHS患者的IL-8、MPO、eNO、WA%、TNF-α指标明显高于健康体检者,提示OSAHS本身会导致气道炎症水平上升,并且可能由于慢性炎症和缺氧的过程,继发气管壁厚度的增加,WA%指标比T/ D指标更敏感。治疗中重度OSAHS患者的首要方法是PAP治疗,通过PAP治疗能够增加功能残气量,消除低通气和呼吸暂停的现象,促进患者的恢复[5]。本次研究显示,OSAHS患者经过6个月PAP治疗后,IL-8、MPO、eNO、TNF-α、WA%指标明显下降,炎症明显改善,而反映气管壁厚度的指标T/ D变化不明显,因此认为气管壁厚度的增加可能是继发于慢性缺氧及慢性炎症的过程,发生相对较晚。
有研究表明,持续气道正压通气(CPAP)是治疗阻塞性睡眠呼吸暂停低通气综合征的首选方法[6-7]。本组研究表明,经6个月的PAP治疗,62例OSAHS患者的TNF-α等炎性因子水平明显下降,但没有证据证明可以改善气道结构,其原因需扩大样本和延长PAP治疗周期,做进一步研究。
综上所述,OSAHS患者的气道炎症水平升高,并且气管壁增厚,采用气道正压通气进行治疗后,患者的气道炎症水平明显下降,气管壁厚变化不明显。

