土壤中持久性有机污染物的吸附与解吸研究
田培,狄珊珊,汪志威,徐浩,齐沛沛,2,赵慧宇,王新全,2*
(1.浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021; 2.省部共建农产品质量安全国家重点实验室(筹),浙江 杭州 310021)
持久性有机污染物(POPs)在环境中降解缓慢,具有半挥发性和较强的亲脂憎水性,可沿食物链逐级放大,并可在环境中做远距离迁移,使得原本存在于大气、水、土壤中的低浓度POPs通过食物链对处于高营养级的生物或人类健康造成损害[1-4],并可通过“蒸馏效应”[5]或“蚱蜢跳效应”[6]转移到全世界大部分地区,导致全球范围的污染[7]。
POPs已被禁用多年,但由于其难降解,在大部分地区仍有不同程度的残留。土壤是农药在环境中迁移转化最重要的环境介质。农药可由土壤释放进入水体等其他环境介质,也可因吸附而被土壤积累,同时还可受淋溶作用进入地下水。POPs在水和土壤中的迁移转化是一个复杂的过程,同时存在吸附和解吸过程。化合物的吸附平衡具有统计学的特征,即随着吸附质浓度的增加,吸附质分子之间占据吸附位的竞争越发激烈,当所有的吸附位被占据,吸附剂的有机物浓度就不再改变,吸附作用达到平衡。
以POPs作为研究对象,以最基本的环境介质水和土壤为客观载体,选取2种有机质含量差异较大的土壤,研究POPs的吸附和解吸规律,明确土壤有机质含量对POPs吸附和解吸的影响。
1 材料与方法
1.1 材料
供试POPs标准样品:o,p′-DDT、o,p′-DDD、p,p′-DDT、p,p′-DDE、PCB52(2,2′,5,5′-四氯联苯)、PCB138(2,2′,3,4,4′,5′-六氯联苯),均购自百灵威试剂公司。二氯甲烷(分析纯)、异辛烷(色谱纯)、无水氯化钙、无水硫酸钠等,均购于北京化学试剂公司。超纯水。两种土壤样品(1号土样和2号土样)的基本理化性状:1号土样,pH值7.71,有机质含量22.3 g·kg-1;2号土样,pH值8.51,有机质含量4.90 g·kg-1。弗罗里硅土固相萃取小柱(SPE,500 mg×3 mL,安捷伦科技有限公司)。
20 μL、200 μL、1 mL、5 mL可调式移液器,热电(上海)仪器有限公司;0.01 g及0.1 mg电子天平,德国Sartorious;QL-901涡旋仪,上海沪西分析仪器厂有限公司;低速台式大容量离心机,上海安亭科学仪器厂;水浴振荡器,上海捷呈实验仪器有限公司;BF-200氮气吹干仪,北京八方世纪科技有限公司;Thermo TSQ QUANTUM GC气质联用仪,美国Thermo Technologies。
1.2 方法
每个处理均准确称取1 g土样,加10 g含0.005 mol·L-1氯化钙的超纯水,120 r·min-1、25 ℃振荡。
1.2.1 POPs的吸附和解吸平衡时间确定
吸附试验:在上层水中添加供试POPs(1 ng·mL-1),分别于15 min、30 min、1 h、2 h、4 h、8 h、12 h、24 h、36 h、48 h、72 h取样,每个取样时间做3个平行,确定吸附平衡时间。
解吸试验:向土壤中添加供试POPs(10 ng·mL-1),分别于30 min、1 h、4 h、8 h、12 h、24 h、48 h、72 h取样,每个取样时间做3个平行,最终确定解吸平衡时间。
1.2.2 不同浓度POPs的吸附与解吸试验
根据1.2.1节确定的吸附和解吸平衡时间,选取5个浓度进行吸附和解吸附研究,上层水和土壤中的添加浓度分别为0.5、1、2、5、10、50 ng·mL-1(ng·g-1)。
1.3 样品前处理
准确量取5 mL试验水样,加入1 ng·mL-1的内标TCMX(十氯联苯和四氯间二甲苯),用5 mL二氯甲烷液液分配萃取2次,收集2次的萃取液,SPE小柱净化,氮吹至干,200 μL异辛烷定容,过0.22 μm滤膜,待进样。
1.4 仪器分析方法
色谱柱:HP-5(30.0 m×0.25 μm,0.25 μm,Agilent);进样口温度:270 ℃;N2流速:1 mL·min-1;进样量:1 μL;离子源温度:290 ℃;程序升温:90 ℃保持2 min,10 ℃·min-1升温至200 ℃,保持5 min;10 ℃·min-1升温到270 ℃,保持5 min;290 ℃保持5 min。各供试POPs在气相色谱-串联质谱(GC-MS/MS)中的主要参数如下:o,p′-DDT,保留时间12.01 min,离子对分别为237.1/165.2和235.1/165.2(m/z),对应的碰撞能量分别为20和20 V;o,p′-DDD,保留时间11.96 min,离子对分别为235.0/200.1和235.0/165.1(m/z),对应的碰撞能量分别为10和25 V;p,p′-DDT,保留时间12.61 min,离子对分别为237.0/165.2和235.0/165.2(m/z),对应的碰撞能量分别为20和20 V;p,p′-DDE,保留时间11.25 min,离子对分别为315.8/246.0和246.1/176.2(m/z),对应的碰撞能量分别为15和30 V;PCB52,保留时间9.61 min,离子对分别为291.9/221.9、289.9/219.9和255.0/220.0(m/z),对应的碰撞能量分别为25、25和10 V;PCB138,保留时间13.12 min,离子对分别为359.9/324.9、359.9/289.9和287.9/217.9(m/z),对应的碰撞能量分别为15、30和40 V。
2 结果与分析
2.1 检测结果的质量评价
在水中分别添加0.2、2、20 ng·mL-1的POPs,每个浓度设置3个平行,以每种供试POPs的定量限作为最小添加浓度。供试的6种POPs在水样中均获得了较好的回收率(80%~110%),相对标准偏差小于20%。同时,在1~50 ng·mL-1,溶剂标准曲线和基质标准曲线均有较好的线性关系,决定系数大于0.991 7。
2.2 POPs的吸附和解吸平衡时间
2.2.1 吸附平衡时间
对比图1和图2可知,1号土样对6种供试POPs的吸附能力比2号土样稍强。两种土样上,供试POPs在1 h内均经过快速吸附过程,然后在1~4 h缓慢释放,8 h后再次吸附并趋于平衡,样本在24 h基本达到平衡。因此,供试POPs的吸附平衡时间应为24 h。
2.2.2 解吸平衡时间
对比图3和图4可知,1号土样与2号土样的解吸情况相似,表明解吸平衡时间与土壤有机质含量相关性不大。土样中供试POPs的解吸经历了快速释放、缓慢吸附、再次释放的过程,在24 h基本达到平衡,即供试POPs的解吸平衡时间为24 h。
2.3 不同浓度POPs的吸附与解吸
2.3.1 不同浓度POPs的吸附
1号和2号土样对上层水中不同浓度POPs的吸附情况分别如图5和6所示。在0.5~2 ng·mL-1,随着上层水中POPs浓度增大,1号土样中POPs的吸附增多,除o,p′-DDD的吸附曲线在10 ng·mL-1时才达到平稳、PCB52在50 ng·mL-1时吸附降低外,其他供试POPs当浓度高于5 ng·mL-1后随着

图1 吸附试验中1号土样上层水中供试POPs浓度变化

图2 吸附试验中2号土样上层水中供试POPs浓度变化
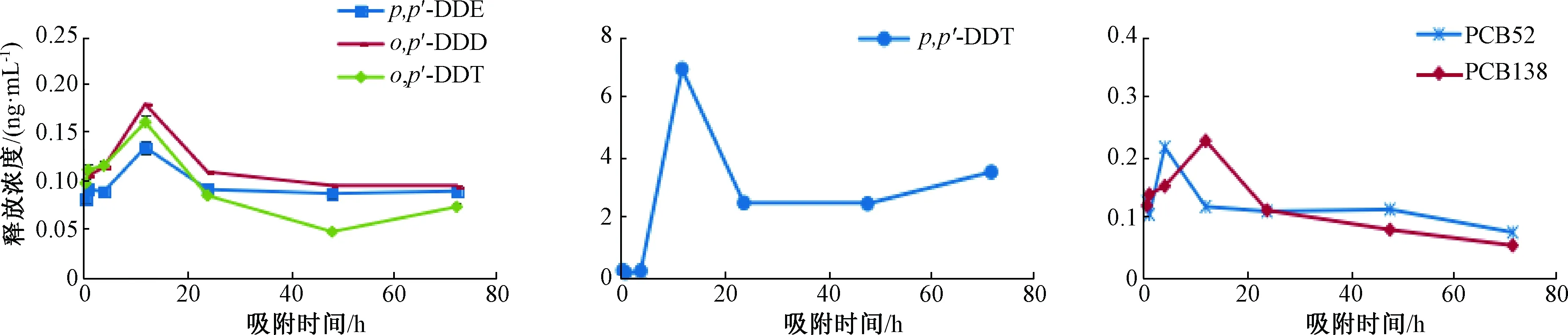
图3 解吸试验1号土样上层水中POPs浓度变化
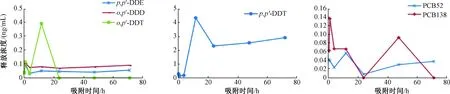
图4 解吸试验2号土样上层水中POPs浓度变化

图5 1号土样对不同浓度POPs的吸附情况
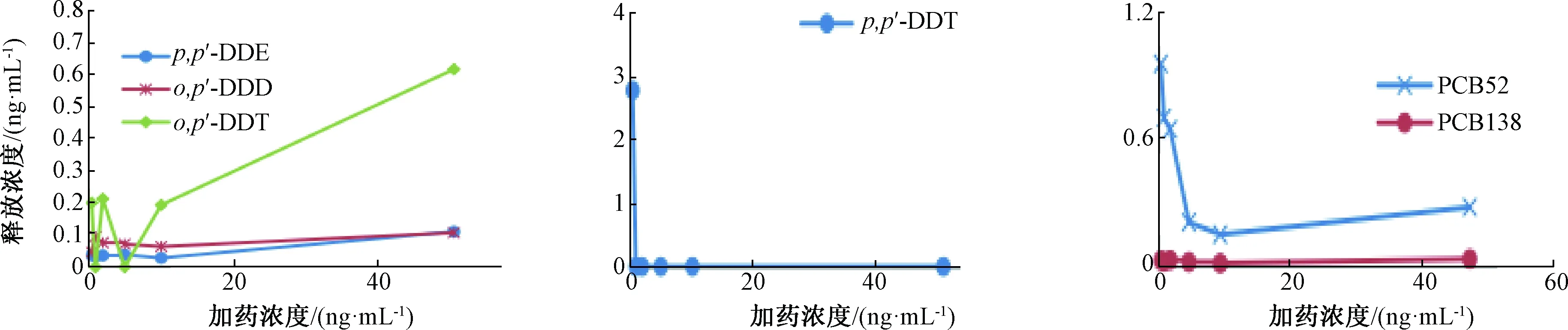
图6 2号土样对不同浓度POPs的吸附情况
浓度增大土壤吸附量变化很小,吸附曲线基本达到稳定。2号土样对不同浓度POPs的吸附动力学与1号土样相似,但o,p′-DDT的吸附波动剧烈,且吸附量明显低于1号土样,这与2号土样有机质含量较低相一致。吸附试验表明,随着POPs浓度增大,吸附量由小浓度时的剧烈变化逐渐转为微小变化,表明大部分POPs可被土壤吸附,最后达到吸附平衡。在试验浓度范围内,除PCB52和o,p′-DDT外,其他化合物均达到平衡,说明土壤对PCB52和o,p′-DDT的吸附能力弱于其他供试POPs。
2.3.2 不同浓度POPs的解吸
1号和2号土样中供试POPs向上层水中的解吸情况分别如图7和8所示。在解吸试验中,1号土样上供试POPs基本在5~10 ng·mL-1解吸曲线趋于平稳。在供试浓度范围内,所有药物的解吸量在低浓度时都剧烈变化,并随土壤POPs浓度增加而降低,随后趋于平稳。即当土壤中POPs的浓度较高时,POPs从土壤解吸附到水中的量基本不变。2号土样上供试POPs的解吸曲线与1号土样相似。当土壤中供试POPs的浓度小于10 ng·mL-1时,解吸量随土壤POPs浓度增加而降低,与1号土样一致,随后解吸量略有增加。1号和2号土样上解吸进入上层水中的供试POPs量基本相同,说明解吸量可能与土壤有机质含量关系不大。供试POPs的解吸曲线基本在5~10 ng·mL-1达到平衡,即大部分POPs的解吸平衡浓度在5~10 ng·mL-1。

图7 1号土样中不同浓度POPs的解吸情况

图8 2号土样中不同浓度POPs的解吸情况
3 小结
本研究表明,土壤对供试POPs的吸附过程可以分为快速吸附和缓慢释放2个阶段,对POPs的吸附平衡基本在24 h,随着吸附时间延长,一部分POPs又会缓慢释放,最终达到一种相对平衡状态。解吸过程一般可分为快速解吸和重新吸附,供试POPs基本在1~12 h内实现快速解吸,随着解吸量的增加,土壤对POPs重新吸附,随后达到吸附解吸平衡。
在0.5~2 ng·mL-1,随着浓度增大,土壤对POPs的吸附增大,土壤对o,p′-DDT和PCB52的吸附能力弱于其他POPs,其他POPs在上层水溶液中浓度为5~10 ng·mL-1时达到吸附平衡。解吸时,当土壤中POPs的浓度达到10 ng·mL-1后,解吸进入上层水中的POPs量基本稳定,达到吸附解吸附平衡。供试POPs在土壤中的吸附量跟土壤有机质含量有关,有机质含量多的土壤对POPs的吸附能力稍强。

