金莲花中8种黄酮类成分的肝微粒体生物转化研究△
刘双月,安燕南,刘斯琪,丁鹏敏,王青青,庞月笙,王如峰
北京中医药大学 生命科学学院,北京 102488
金莲花(Flos Trollii)为毛茛科金莲花属植物金莲花TrolliuschinensisBunge的干燥花,主要含黄酮类、酚酸类和生物碱类成分,具有抗炎、抗病毒、抗氧化、抗肿瘤、抑菌等活性[1-2]。黄酮类化合物含量最高,约占金莲花干质量的18%[3-4],金莲花中大部分黄酮类化合物为黄酮碳苷,例如荭草素、牡荆素、异当药黄素、金莲花碳苷Ⅰ、Ⅱ和Ⅲ及其衍生物等。除黄酮碳苷外,还有黄酮醇及氧苷类成分,如槲皮素、异槲皮素等[5-11]。这些化合物的生物活性及体内代谢情况对确定金莲花的有效成分研究具有重要的作用。虽然黄酮类化合物的代谢研究报道较多[12-14],但是这些研究大多集中于黄酮氧苷的代谢,而由于黄酮碳苷在植物中的分布相对较窄,其代谢研究特别是肝代谢研究却鲜有报道。肝脏是代谢的主要器官,其中富含代谢酶系,肝微粒体细胞色素P-450酶系(CYP450)是其中催化药物生物转化的主要酶系统,可发生Ⅰ相代谢,如氧化、还原、水解等反应以及Ⅱ相代谢,如葡萄糖醛酸、硫酸和氨基酸等轭和反应[15]。目前肝微粒体转化模型在药物体外代谢研究中被广泛应用,该方法可排除体内诸多干扰因素,专一地模拟研究药物在肝脏内的代谢情况。鉴于此,本研究采用大鼠肝微粒体转化模型分别对金莲花中的牡荆素、荭草素、荭草素-2″-O-β-L-半乳糖苷、异当药黄素、日本异当药素、2″-O-(2‴-甲基丁酰基)异当药黄素、金莲花碳苷Ⅰ和异槲皮素等8种黄酮类成分的肝脏代谢过程进行了研究。
1 材料与方法
1.1 仪器与试剂
Waters高效液相色谱仪;Thermo LTQ ORBITRAP XL质谱仪;匀浆器(德国IKA);超速离心机CP100WX(株式会社日立制作所);氮吹仪(北京市优晟联合科技有限公司);AE240十万分之一电子天平(Mettler公司);涡旋混匀器(海门市气林贝雨仪器厂);水浴振荡器(金坛市华立实验仪器厂)。
氧化型辅酶Ⅱ(NADP)、还原型辅酶Ⅰ(NADH)、葡萄糖-6-磷酸(G-6-P)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)均购于Sigma公司;二硫酸苏糖醇(DTT)购于北京拜尔迪生物技术有限公司;苯巴比妥钠注射液购于中国中医科学院望京医院;氯化钾、氯化镁、磷酸二氢钾、磷酸氢二钾、乙二胺四乙酸二钠、乙酸乙酯、甲醇、乙腈均购于北京高华伟业食品添加剂有限公司;Folin-酚试剂盒购于北京鼎国昌盛生物技术有限公司;金莲花黄酮类化合物均为本实验室分离、鉴定得到的单体化学成分,结构见图1。
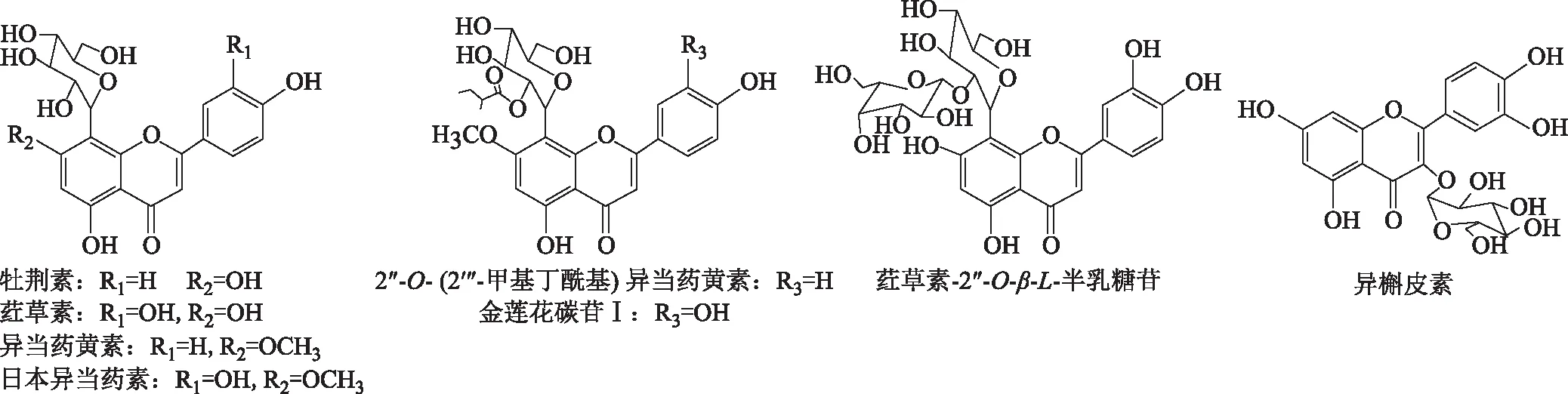
图1 金莲花中8种黄酮类化合物的结构式
1.2 实验动物
清洁级SD大鼠,20只,体质量(220±20) g,由北京大学医学部实验动物中心提供,合格证编号:SCXK(京)2006-0008。
1.3 大鼠肝微粒体的制备
SD大鼠20只,每天腹腔注射一次苯巴比妥钠0.9%氯化钠溶液(按80 mg·kg-1剂量),连续注射3 d。禁食12 h,自由饮水,于第4天脱颈椎处死,快速解剖取出大鼠肝脏。参照文献方法[16],采用二次离心法制备大鼠肝微粒体。制备的肝微粒体溶液分装,-80 ℃保存,备用。
1.4 肝微粒体的总蛋白浓度测定
按照Lowry法,测定大鼠肝微粒体中蛋白浓度,以梯度浓度的牛血清白蛋白(BSA)作标准液测定吸光度值并制作浓度(X)-吸光度值(Y)标准曲线,得到回归方程Y=0.968 1X+0.033 9,r=0.999 1,线性范围0.025~0.25 mg·mL-1。以水溶液代替样品作空白对照,据上述结果计算,所制备的微粒体蛋白质量浓度为22.8 mg·mL-1。
1.5 肝微粒体的CYP450酶含量及活性测定
采用CO还原差示光谱法测定CYP450酶含量[17],结果所测CYP450蛋白的浓度为0.55 nmol·mL-1。以CYP450酶能氧化氯唑沙宗生成6-羟基氯唑沙宗为原理进行活性验证,用HPLC测定转化结果[18],从而间接地证明所制备的肝微粒体具有CYP450酶活性。
1.6 肝微粒体模型体外代谢转化实验
精密称取各单体化合物,溶于适量磷酸盐缓冲液(50 mmol·L-1KH2PO4-K2HPO4,pH 7.4)中,配制成底物化合物原液。采用酶法再生辅酶NADPH系统,用磷酸盐缓冲液配制辅酶体系(包括1.0 mmol·L-1NADP,0.5 mmol·L-1NADH,10 mmol·L-1G-6-P,1.0 IU·mL-1G-6-PDH和4.0 mmol·L-1MgCl2)。在配制的辅酶体系中定量加入肝微粒体(灭活组:将肝微粒体于80 ℃水浴加热处理10 min),摇匀后,37 ℃水浴中温孵5 min,定量加入底物化合物反应,实验反应体系见表1。反应2 h后加入等体积预冷的乙酸乙酯终止反应。

表1 肝微粒体模型体外代谢反应体系 mL
1.7 液质联用色谱检测
1.7.1 检测样品预处理 将反应终止后的样品在16 162×g离心10 min,除去肝微粒体,加入等体积乙酸乙酯萃取3次,合并乙酸乙酯层,氮气吹干。再加入1 mL甲醇超声溶解,0.22 μm微孔滤膜过滤,待HPLC-LTQ Orbitrap MS检测。
1.7.2 色谱/质谱条件 Phenomenex色谱柱(250 mm×4.6 mm,4 μm),流动相乙腈-水,流速1.0 mL·min-1,进样量10 μL,各组待测样本分别按照适应的流动相比例梯度洗脱。Thermo LTQ Orbitrap XL质谱仪,Accela 600 泵,电喷雾离子源(ESI),负离子扫描模式,扫描范围m/z:100~800。毛细管温度350 ℃,毛细管电压-35 V,气化温度300 ℃,鞘流气流量17 L·min-1。
1.8 数据处理
将肝微粒体转化组与空白组和对照组的总离子流图进行对比(见图2),新增加的峰推测可能为代谢产物,根据质荷比获得代谢产物峰的提取离子流图,对各产物的一级质谱和二级质谱碎片信息进行数据库检索及分析。

注:A.牡荆素;B.荭草素-2″-O-β-L-半乳糖苷;C.异当药黄素;D.2″-O-(2‴-甲基丁酰基)异当药黄素;E.金莲花碳苷Ⅰ;F.异槲皮素;G.荭草素;H.日本异当药素;A1、A2、B1、B2、C1、C2、D1、D2、D3、D4、E1、E2、E3、F1、F2为各代谢产物;a.空白对照组;b.阴性对照组;c.灭活对照组;d.转化组。 图2 金莲花中8种黄酮类化合物肝微粒体转化的总离子流图

图3 已确定结构的黄酮类化合物肝微粒体代谢产物的结构图
2 结果与分析
2.1 金莲花黄酮类化合物质谱裂解规律分析
对底物化合物的LC-MS数据进行分析,归纳出8种黄酮类化合物在质谱电喷雾离子源(ESI)系统中易断裂的部位及形成的碎片,见表2。黄酮碳苷类主要是以糖环内部的断裂为主要断裂形式,单六碳糖碳苷主要脱去m/z90和120的碎片,产生典型的[M-C3H6O3-H]-和[M-C4H8O4-H]-碎片离子,双糖碳苷主要脱去m/z120、90和60的碎片离子。由于碎片离子结构中含有羰基,质谱图中常见丢失CO的小分子碎片离子。衍生物先断掉衍生取代基后会按照母核的断裂方式继续断裂黄酮碳苷部分及苷元部分,O-糖基或O-甲基丁酰基不稳定,会优先碎裂。当C-7位有甲氧基时,易发生脱甲基断裂。这与研究报道的黄酮化合物裂解规律一致。
表2 金莲花中8种黄酮类化合物的质谱碎片信息
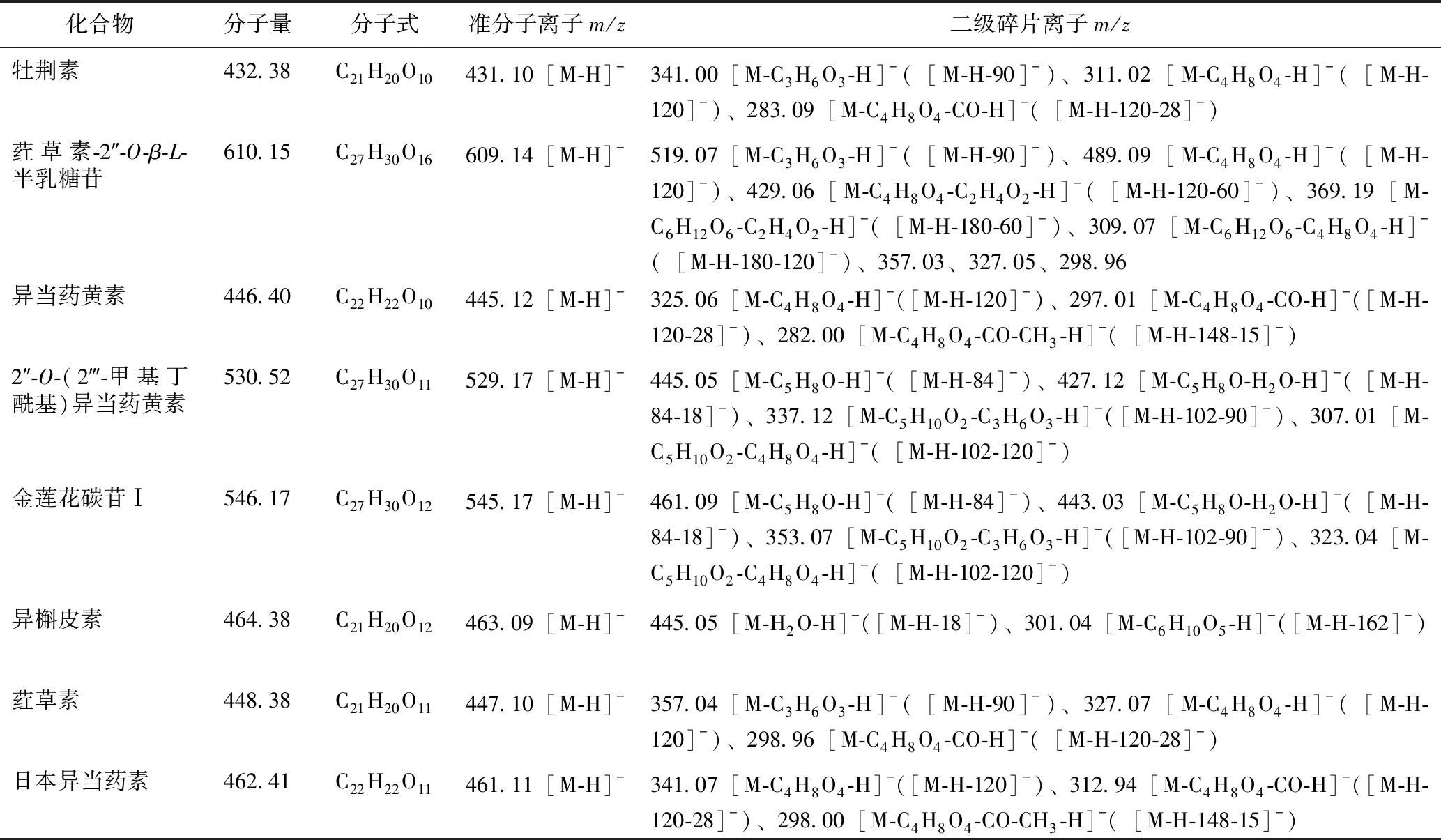
化合物分子量分子式准分子离子m/z二级碎片离子m/z牡荆素432.38C21H20O10431.10[M-H]-341.00[M-C3H6O3-H]- ([M-H-90]-)、311.02[M-C4H8O4-H]-([M-H-120]-)、283.09[M-C4H8O4-CO-H]- ([M-H-120-28]-)荭草素-2″-O-β-L-半乳糖苷610.15C27H30O16609.14[M-H]-519.07[M-C3H6O3-H]- ([M-H-90]-)、489.09[M-C4H8O4-H]-([M-H-120]-)、429.06[M-C4H8O4-C2H4O2-H]-([M-H-120-60]-)、369.19[M-C6H12O6-C2H4O2-H]-([M-H-180-60]-)、309.07[M-C6H12O6-C4H8O4-H]- ([M-H-180-120]-)、357.03、327.05、298.96异当药黄素446.40C22H22O10445.12[M-H]-325.06[M-C4H8O4-H]- ([M-H-120]-)、297.01[M-C4H8O4-CO-H]- ([M-H-120-28]-)、282.00[M-C4H8O4-CO-CH3-H]-([M-H-148-15]-)2″-O-(2‴-甲基丁酰基)异当药黄素530.52C27H30O11529.17[M-H]-445.05[M-C5H8O-H]-([M-H-84]-)、427.12[M-C5H8O-H2O-H]-([M-H-84-18]-)、337.12[M-C5H10O2-C3H6O3-H]-([M-H-102-90]-)、307.01[M-C5H10O2-C4H8O4-H]-([M-H-102-120]-)金莲花碳苷Ⅰ546.17C27H30O12545.17[M-H]-461.09[M-C5H8O-H]-([M-H-84]-)、443.03[M-C5H8O-H2O-H]-([M-H-84-18]-)、353.07[M-C5H10O2-C3H6O3-H]-([M-H-102-90]-)、323.04[M-C5H10O2-C4H8O4-H]- ([M-H-102-120]-)异槲皮素464.38C21H20O12463.09[M-H]-445.05[M-H2O-H]- ([M-H-18]-)、301.04[M-C6H10O5-H]- ([M-H-162]-)荭草素448.38C21H20O11447.10[M-H]-357.04[M-C3H6O3-H]-([M-H-90]-)、327.07[M-C4H8O4-H]-([M-H-120]-)、298.96[M-C4H8O4-CO-H]- ([M-H-120-28]-)日本异当药素462.41C22H22O11461.11[M-H]-341.07[M-C4H8O4-H]- ([M-H-120]-)、312.94[M-C4H8O4-CO-H]-([M-H-120-28]-)、298.00[M-C4H8O4-CO-CH3-H]-([M-H-148-15]-)

表3 金莲花中8种黄酮类化合物肝微粒体代谢转化产物检测结果
2.2 代谢转化产物结构特征分析
牡荆素(vitexin),分子式C21H20O10,分子量432.38。经肝微粒体转化后有两个转化产物(A1和A2)。转化产物A1,保留时间14.18 min,准分子离子峰m/z473.11[M-H]-,分子式C23H22O11,推测其为牡荆素的乙酰化产物。其二级碎片离子m/z431.06[M-H-42]-为脱去乙酰基后形成,m/z341.14为[M-H-42-90]-,m/z353.14为[M-H-120]-,m/z311.04为[M-H-120-42]-,m/z283.00为[M-H-120-42-28]-,碎片离子及断裂方式与牡荆素一致,推测其乙酰化的位置可能在糖苷的2位或黄酮母核上。转化产物A2,保留时间10.38 min,准分子离子峰m/z447.09[M-H]-,分子式C21H20O11。黄酮类B环是发生代谢反应的主要部位,B环上没有或仅有1个羟基时,易被代谢成3′,4′-二羟基黄酮[19]。根据反应规律,推测是牡荆素发生羟基化反应生成了荭草素,其产生的二级碎片离子m/z357.18[M-H-90]-,327.10[M-H-120]-,与荭草素碎片离子及断裂方式一致。
荭草素-2″-O-β-L-半乳糖苷(2″-O-β-L-galactopyranosylorientin),分子式C27H30O16,分子量610.15。经肝微粒体转化后得到两个转化产物(B1和B2)。转化产物B1,保留时间11.83 min,准分子离子峰m/z771.20[M-H]-,分子式C33H40O21,推测其为糖基化产物。其二级碎片离子m/z591.21[M-H-180]-很可能是丢失C6H12O6中性碎片后形成,碎片离子m/z489.29、369.01、357.07、327.06与荭草素-2″-O-β-L-半乳糖苷碎片离子一致,推测其是增加了一个六碳糖,但糖基化位置无法确定。转化产物B2,保留时间16.43 min,准分子离子峰m/z651.16 [M-H]-,分子式C29H32O17,推测其为乙酰化产物。其二级碎片离子m/z609.27是其脱掉乙酰基后形成,m/z519.13、489.09是半乳糖部分断裂形成,m/z471.11是其丢失180(-C6H12O6)后形成,m/z429.08为继续脱掉乙酰基后形成。另外,碎片离子m/z357.11和327.01与荭草素的碎片一致,说明产物的乙酰化位置不在半乳糖上,也不在糖苷上,很可能在黄酮母核上。
异当药黄素(isoswertisin),分子式C22H22O10,分子量446.40。经肝微粒体转化后有两个转化产物(C1和C2)。转化产物C1,保留时间12.69 min,准分子离子峰m/z431.10[M-H]-,分子式C21H20O10,推测其为异当药黄素脱掉甲基后生成的牡荆素。其二级碎片离子m/z341.07、311.00和282.99与牡荆素碎片离子及断裂一致。转化产物C2,保留时间18.08 min,准分子离子峰m/z487.13[M-H]-,分子式C24H24O11,推测其为异当药黄素的乙酰化产物。其二级碎片离子m/z445.15为脱去乙酰基后形成,m/z427.13为[M-H-60]-,m/z325.00为[M-H-42-120]-,m/z297.02为[M-H-42-148]-,m/z282.04为继续丢失CH3碎片,不能确定乙酰化位置。
2″-O-(2‴-甲基丁酰基)异当药黄素[2″-O-(2‴-methylbutyryl)isoswertisin],分子式C27H30O11,分子量530.52。经肝微粒体转化后有4个转化产物(D1~D4)。其中有3个不同保留时间的准分子离子峰为m/z545.17[M-H]-的转化产物,且其分子式均为C27H30O12,推测是在不同位置发生了羟基化,生成3个产物D1、D2和D3。转化产物D1,保留时间为13.33 min,准分子离子峰为m/z545.17[M-H]-,二级碎片离子m/z461.14、443.09、353.07和323.05为连续丢失84、18、90和120碎片而形成,根据文献[20]推测其为金莲花碳苷Ⅰ,如图3所示的结构。另外两个m/z545.17[M-H]-的准分子离子峰,保留时间分别为11.60(转化产物D2)和11.96 min(转化产物D3),由于2‴-甲基丁酰基上可以发生ω氧化或ω-1氧化反应,且二级碎片离子中都有m/z501和445,其三级碎片离子中有m/z427、337、307碎片,且对m/z501进行二级扫描发现产生有m/z427、337、307碎片,与2″-O-(2‴-甲基丁酰基)异当药黄素断裂一致,推测为2″-O-(2‴-甲基-4‴-羟基丁酰基)异当药黄素(2″-O-(2‴-methyl-4‴-hydroxybutyryl)isoswertisin)和2″-O-(2‴-甲基-3‴-羟基丁酰基)异当药黄素(2″-O-(2‴-methyl-3‴-hydroxybutyryl) isoswertisin),见图3所示的结构。转化产物D4,保留时间12.34 min,准分子离子峰m/z515.16[M-H]-,分子式C26H28O11,推测其为脱甲基产物。其二级碎片离子m/z431.28为[M-H-84]-,是脱去了甲基丁酰基后形成,m/z413.09可能为继续脱去一分子水,m/z311.08为[M-H-84-120]-,推测其为2″-O-(2‴-甲基丁酰基)牡荆素(2″-O-(2‴-methylbutyryl)vitexin),见图3所示的结构。
金莲花碳苷Ⅰ(trollisin I),分子式C27H30O12,分子量546.17。经肝微粒体转化后有3个转化产物(E1~E3)。转化产物E1,保留时间12.71 min,准分子离子峰m/z587.18[M-H]-,分子式C29H32O13,推测其为乙酰化产物。其二级碎片离子m/z545.16为其脱去乙酰基后形成,m/z503.08为其脱去甲基丁酰基后形成,m/z485.08为[M-H-42-60]-,碎片离子m/z443.13、353.12和323.06与金莲花碳苷Ⅰ碎片一致,说明乙酰化部位不在甲基丁酰基上。转化产物E2和E3的准分子离子峰为m/z561.16[M-H]-,分子式C27H30O13,保留时间分别为9.02 min(转化产物E2)和9.28 min(转化产物E3)。由于2‴-甲基丁酰基上可以发生ω氧化或ω-1氧化反应,转化产物E2和E3的二级碎片离子中都有m/z517、461、443、353和323,与金莲花碳苷Ⅰ断裂一致,推测分别为2″-O-(2‴-甲基-4‴-羟基丁酰基)日本异当药素(2″-O-(2‴-methyl-4‴-hydroxybutyryl)isoswertiajaponin)和2″-O-(2‴-甲基-3‴-羟基丁酰基)日本异当药素(2″-O-(2‴-methyl-3‴-hydroxybutyryl) isoswertiajaponin),见图3 所示的结构。
异槲皮素(isoquercitrin),分子式C21H20O12,分子量464.38。经肝微粒体转化后有两个转化产物(F1和F2)。转化产物F1,保留时间15.41 min,准分子离子峰m/z505.10[M-H]-,分子式C23H22O13,推测其为乙酰化产物。其二级碎片离子m/z463.13为[M-H-42]-,m/z445.05为[M-H-42-18]-,m/z301.04为[M-H-42-162]-,不能确定乙酰化位置。转化产物F2,保留时间11.55 min,准分子离子峰m/z625.14[M-H]-,分子式C27H30O17,推测其为糖基化产物。其二级碎片离子m/z462.94为[M-H-162]-,m/z301.03为[M-H-162-162]-,不能确定糖基化位置。
荭草素(orientin),分子式C21H20O11,分子量448.38。荭草素与牡荆素A环结构相同,肝微粒体转化形式相似,但由于转化组和灭活组均检测到了准分子离子峰为m/z489.11[M-H]-,分子式为C23H22O12的物质,不能确定其是否发生了乙酰化,可能是灭活的体系残留一定的酶活性造成的。
日本异当药素(isoswertiajaponin),分子式C22H22O11,分子量462.41。日本异当药素比异当药黄素多一个羟基,A环结构相同,理论上会发生脱甲基反应,但由于对照品中有准分子离子峰为m/z447.10[M-H]-,分子式为C21H20O11的物质,不能确定其是否发生了脱甲基反应。
3 讨论
本研究中肝微粒体可促进黄酮苷类化合物发生羟基化、乙酰化、糖基化以及脱甲基反应,说明建立的肝微粒转化模型中不止发生了I相代谢,也发生了以乙酰化和糖基化反应为代表的Ⅱ相代谢。黄酮碳苷类化合物,在C-8位通过C-C键将苷元和糖链连接,C-苷键不易水解,实验中没有直接脱糖的产物生成,异槲皮素是黄酮氧苷类化合物,容易发生O-苷键的水解,但实验中未能找到直接脱糖的转化产物。化学成分经大鼠肝微粒体转化后,发生的羟基化、脱甲基和糖基化反应,会使转化产物的极性增强,有利于化合物的排泄,减少化合物的体内存留时间,降低毒性。酰化反应后,黄酮类化合物的脂溶性和水溶性提高,并能促进脂肪及类脂代谢[21]。本实验中,金莲花黄酮类单体成分在大鼠肝微粒体模型中转化率较低,所以没有检测到大量的新产物生成。代谢反应中存在化合物相互转化的现象,说明金莲花的部分药理活性很可能是由其原形化合物产生的,例如牡荆素、荭草素等[22-23]是已经报道的金莲花中活性较强的成分。
黄酮苷类化合物在肠道中较难吸收,主要在肝脏部位发生生物转化[14]。肝脏代谢的主要作用是对进入机体的外源性化学成分进行结构修饰,使其易于排出体外,同时化学成分经生物转化后的药理活性变化复杂,可能进一步产生活性成分,增强药效或产生毒性成分等。金莲花中的化学成分被机体吸收后,可直接到达靶器官发挥药效,或者通过代谢组织代谢产生的活性产物来发挥药效。本文采用大鼠肝微粒体转化模型模拟肝脏代谢过程,对金莲花中黄酮类单体成分进行了转化研究,并采用液质联用技术对转化产物进行了结构分析,可进一步为金莲花成分的体内代谢途径研究和确定活性成分等奠定基础,也对黄酮类化合物新药开发及临床应用具有指导意义。

