药用植物活性成分的细胞工厂合成研究进展△
晁二昆,苏新堯,陈士林,刘佳柔,3,朱智慧,盛玮*,王彩霞*
1.淮北师范大学 生命科学学院,安徽 淮北 235000;2.中国中医科学院 中药研究所,北京 100700;3.河北科技大学,河北 石家庄 050018
大多数药用活性成分在原植物中含量很低,且植物生长周期长,受时间、空间、气候等诸多因素的限制,化学合成难度大,副产物多,提取成本高,且产生的废弃物会对生态环境造成不可逆破坏。因此,传统的天然提取和人工化学合成的方法已经很难满足现代可持续发展的要求,中药合成生物学的产生与发展,将会有效地解决这些矛盾[1]。
1979年,Har Gobind Khorana人工合成了207个碱基对的DNA序列,并因此获得诺贝尔化学奖,合成生物学由此开始[2]。20世纪90年代初,随着测序技术和信息技术的快速发展,对生命科学的研究进入了基因组时代,大量的研究结果为合成生物学的产生奠定了坚实基础。2010年,Venter研究所[3]在《Science》杂志上报道了首例“人造细胞”的诞生,这是世界上第一个由人类制造并能够自我复制的新物种,同年合成生物学被《Science》杂志评为年度十大科学突破之一。2018年,覃重军团队[14]将酿酒酵母16条染色体的全基因组进行修建和重拍,最终获得只有1条染色体的酿酒酵母,这一重大成果使得人类距离实现合成生命的目标更近了一步。
现今,合成生物学已在医药、能源、环境等领域取得了举世瞩目的成就[5]。
1 药用植物活性成分合成研究概述
中药合成生物学的目的在于将复杂的自然生物代谢系统改造为简单且可控的功能元件,如启动子、终止子、功能蛋白等,然后经计算机辅助设计对其进行模拟预测,从而构建由天然或非天然的功能元件或模块组成的生物系统,来产生药用植物的活性成分。
药用植物活性成分生物合成途径解析的策略见图1。首先根据化学原理和已经分离鉴定的中间产物推测出可能的生物合成途径,必要时可以通过同位素追踪的手段对推测途径进行进一步确认;其次通过转录组分析和生物信息学分析筛选和挖掘特定代谢途径的功能基因并解析其合成途径;然后将合成途径组装成细胞工厂;最后设计并构建细胞工厂。
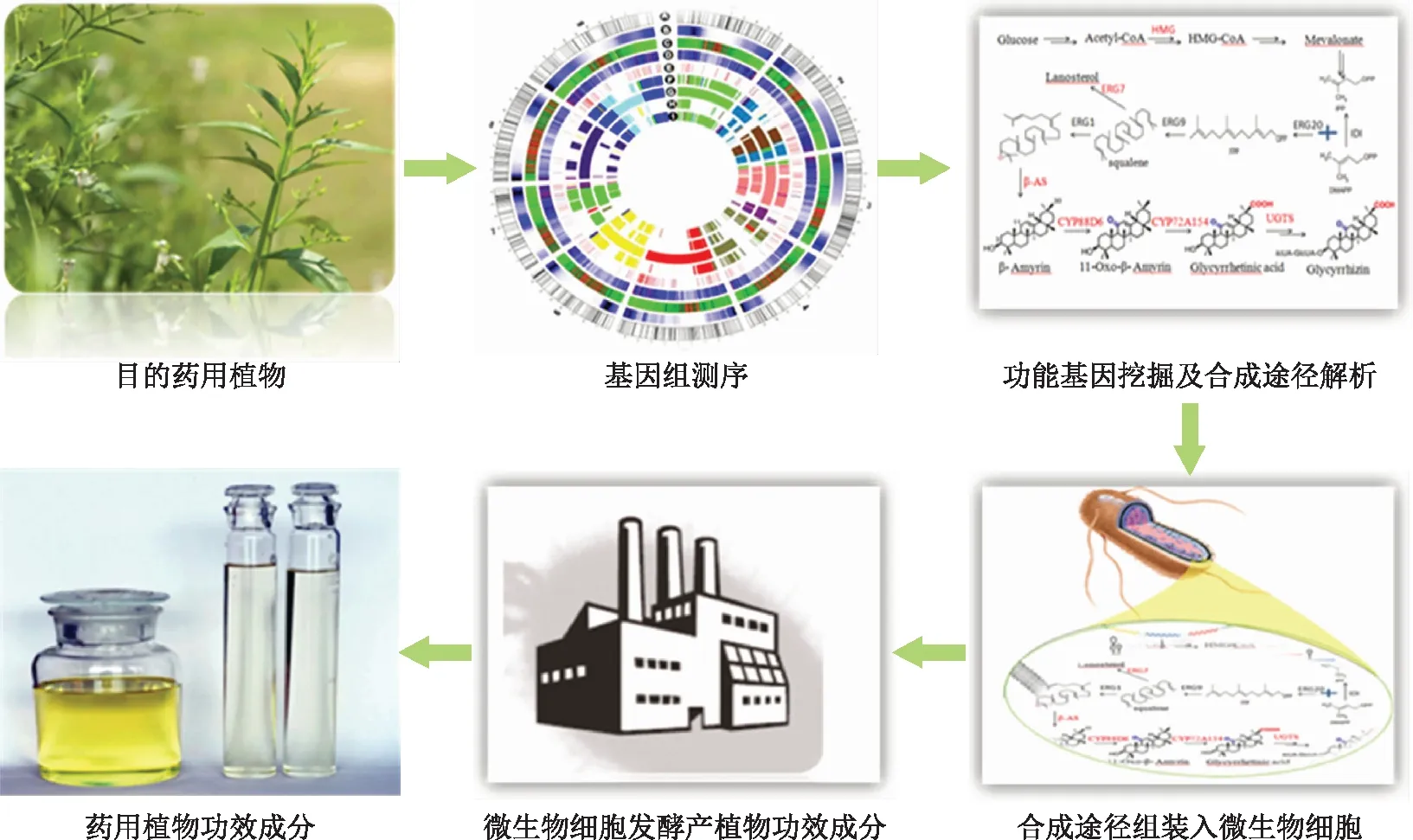
图1 天然产物的细胞工厂生产技术路线
2 药用植物活性成分细胞合成技术策略
药用植物活性成分细胞合成技术策略(见图2),即在解析较为清楚的天然产物代谢途径的基础上,结合底盘细胞自身的代谢途径,对目标代谢途径进行复制或转移;或根据现有目标成分或中间体的化学结构,在底盘细胞中重新集成一条新的代谢途径。无论是原有代谢路径的转移还是新代谢途径的创建,其在工程菌株中的生物合成都不是相互独立的,而是相互交错而成的一个动态平衡的代谢网络,在构建工程菌株的同时,需从整体上对其代谢网络进行优化调控,以期更有利于目标药用活性成分的合成及积累。

图2 药用植物活性成分细胞合成技术策略
2.1 代谢途径的重构
天然产物代谢途径在异源底盘细胞中的重构,可以使原本不能产生天然产物的底盘细胞产生甚至高产目的产物,有利于验证各种基因的功能,有助于理解细胞的代谢行为和生命现象。然而,编码整个代谢途径或重组长的DNA片段具有重大难度,科研人员对此做了许多工作。如2009年,Shao等[6]创建了一种新的重组方法——DNA assembler,它通过酿酒酵母中的体内同源重组,在一步组装整个生物途径中用此方法可以快速组装功能性D-木糖利用途径(由3个基因组成的9 kb DNA)、功能性玉米黄质生物合成途径(由5个基因组成的5 kb DNA)、功能性组合D-木糖利用和玉米黄质生物合成途径(由8个基因组成的19 kb DNA),整合到酵母染色体上的效率高达70%。2016年,Jin等[7]发明了一种新的无缝克隆方法——DATEL(DNA Assembly method using Thermostable Exonucleases and Ligase)。此方法设计具有重叠的5′磷酸化DNA片段并置于一个管中,在变性和退火后,相邻DNA片段突出的重叠端互补并形成发卡结构,剩余的ssDNA被Taq聚合酶完全消化,3′端同理,以此精确连接目的片段。该团队使用此方法在大肠杆菌中快速构建了β-胡萝卜素的合成路径,结合核糖体结合位点(RBS)调控代谢途径中crtE、crtX、crtY、crtI、crtB5个基因,最终β-胡萝卜素产量为3.57 g·L-1。
2.2 基因编辑
天然产物代谢途径是复杂的,如果前体物质能较少流入,甚至不流入目的产物代谢流的竞争支路,可能获得更多的目的产物,CRISPR-Cas9技术的开发利用很好地解决了这一难题。CRISPR-Cas9技术是一种革命性基因编辑技术,其功能强大,可以用来删除、添加、抑制或激活生物体的目标基因,可以广泛用于生物技术[8-9]。

表1 酵母CRISPR基因编辑技术研究进展
2.3 底盘细胞构建
中药合成生物学首先是要根据天然产物的合成途径和微生物代谢调控来构建底盘细胞。这个过程常用的微生物有大肠杆菌、酵母、枯草芽孢杆菌等。
2.3.1 构建大肠杆菌底盘细胞 大肠杆菌是最为简单的模式生物,其遗传背景清晰、生长周期短、易于操作,一些DNA重组技术以及分子生物学工具的应用都是先在大肠杆菌中试验,然后推广到其他生物中,其作为生物合成学的底盘菌株有着其他生物无可比拟的优势[25]。Stephanopoulos课题组将强效抗癌药物——紫杉醇合成途径进行重构。并通过优化中间基因的表达以及代谢通量,重构大肠杆菌发酵葡萄糖生产紫杉醇的前体紫杉二烯的能力与改造前相比提高了15 000倍,紫杉二烯产量达到了1 g·L-1的水平[26]。2018年,Wang等[27]构建了一种能定向合成黄芩素或野黄芩素的大肠杆菌,只需提供苯丙氨酸或酪氨酸两种不同的前体,就可以获得这两种黄酮化合物。该团队首先将来自欧芹的4CL、FNS I,红酵母的PAL、矮牵牛的CHS、苜蓿的CHI等酶的6个基因转入酵母中,构建了黄酮的重要中间体芹菜素的代谢通路。然后通过克隆黄芩来源的F6H及拟南芥来源的AtCPR基因,实现了黄芩素和野黄芩素的异源合成。在此基础上,该团队通过过量表达丙二酰辅酶A合成基因acs和脂肪酸合成基因fabF,并引入三叶草根瘤菌来源的丙二酰辅酶A合酶基因matB与丙二酸盐载体蛋白基因matC,最终大肠杆菌可产黄芩素23.6 mg·L-1、野黄芩素106.5 mg·L-1。
2.3.2 构建酵母底盘细胞 大肠杆菌作为底盘细胞生产天然化合物,由于其是原核细胞,不能很好地表达植物或其他真核生物来源的酶,限制了蛋白后期的加工修饰,尤其是细胞色素P450酶。酿酒酵母为安全的模式生物,能够高效表达P450酶,重组酿酒酵母基因,使用酵母发酵生产植物源天然药物己成为微生物发酵法的研究热点[28-29]。美国麻省理工学院Stephanopoulos教授课题组[26]通过尝试不同物种来源的关键基因HMGS和HMGR,对途径中基因表达量进行优化,结合发酵过程优化,青蒿二烯的产量在大肠杆菌中达到27 g·L-1。但青蒿二烯向青蒿酸的这步转化由P450氧化酶CYP71AV1催化,是一步氧化反应。由于P450氧化酶在大肠杆菌中一直都不能高效表达,所以表达CYP71AV1的重组大肠杆菌只能生产1 g·L-1的青蒿酸,即转化率只有4%左右。2006年,Ro等[30]通过对酵母中的MVA途径代谢调控关系的调整、关键基因表达量优化、前体物FPP代谢支路的削弱,结合氧化酶CYP71AV1的表达,成功构建产青蒿酸的酵母菌株,产量达到115 mg·L-1,通过发酵优化青蒿酸的产量可以进一步提高到2.5 g·L-1。通过进一步的基因挖掘,他们找到了3个由青蒿二烯向青蒿酸转化的基因,即细胞色素b5基因、青蒿醇脱氢酶基因、青蒿醛脱氢酶基因。在合成青蒿二烯酵母菌株中表达这3个基因,同时优化CYP71AV1辅助还原酶CPR1的表达量和发酵过程,青蒿酸产量提高到25 g·L-1[31]。此时酵母作为底盘菌株的优势显而易见。
2.3.3 构建枯草芽孢杆菌底盘细胞 枯草芽孢杆菌作为国内研究最早的微生物之一,具有超强的分泌系统,可以通过特殊的运输机制将其体内表达的蛋白或多糖运输到体外,只需简单处理发酵液就可以收集目的产物,省去了繁琐的破碎细胞过程[32]。Liu等[33]首次在枯草芽孢杆菌中“从头”设计合成人工启动子文库,对其代谢网络优化,以肌苷生产菌株为出发菌,利用弱启动子弱表达肌苷生产菌株的嘌呤途径必需基因purA,使肌苷产量提高了7倍,且对工程菌的生长无影响;利用强启动子TP2过表达木聚糖酶基因xynA,提高了木聚糖分解和利用能力,在以木聚糖为唯一碳源的培养基中,利用木聚糖产乙偶姻工程菌株表现出更好的生长能力,且乙偶姻产量提高44%。
3 代谢网络调控
药用植物细胞合成技术即在对药用源植物复杂代谢路径解析较为清楚的基础上,结合底盘细胞自身的代谢途径,对目标代谢途径进行复制或转移;或根据现有目标成分或中间体的化学结构,在底盘细胞中重新集成一条新的代谢途径。无论是原有代谢路径的转移还是新代谢途径的创建,其在工程菌株中的生物合成都不是相互独立的,而是相互交错而成的一个动态平衡的代谢网络,在构建工程菌株的同时,需从整体上对其代谢网络进行优化调控,以期更有利于目标药用成分的合成及积累。
3.1 静态调节
核糖体结合位点(RBS位点)是控制翻译起始的关键区域额,因此也是调节翻译强度的重要原件。通过寻找或人工设计合适的RBS可以增强蛋白表达,从而提高目的产物。Sun等[34]使用可产生162.98 mg·L-1色氨酸的谷氨酸棒杆菌ATCC 21850作为代谢工程底盘菌株,将来自紫色色杆菌的异源操纵子在具有组成型启动子的ATCC 21850菌株中过量表达,获得532 mg·L-1紫色杆菌素。考虑到紫色杆菌素的毒性,其使用诱导型启动子表达vio操纵子,并发酵获得629 mg·L-1紫色杆菌素。由于vio操纵子的经济编码性质,vio基因的压缩RBS被替换为强表达的谷氨酸棒杆菌。并将扩展表达单元组装成一个合成操纵子。通过该策略,发酵获得了1116 mg·L-1紫色杆菌素。然后通过优化发酵时间、浓度、培养组成和发酵温度等,最终将紫色杆菌素发酵浓度提升到了5436 mg·L-1。
3.2 动态调节
微生物发酵产生目的产物的过程中往往也会产生许多不必要的副产物,副产物的产生不仅浪费目的产物前体物质,同时也增加了目的产物的提取难度。使用动态调节策略来调控代谢产物浓度和代谢途径通量,从而获得更多的目的产物。将法呢基二磷酸(FPP)响应性启动子转入大肠杆菌中的紫穗槐二烯生物合成途径中,以降低毒性前体FPP的积累。筛选对细胞内FPP水平有响应的内源性大肠杆菌启动子,随后用于实施上游FPP产生途径中8种酶表达的负反馈调节方式,以及对紫穗槐-4,11-二烯合酶表达的正反馈调节方式,将FPP转化为紫穗槐二烯。与静态调控策略相比,这种动态调控策略使紫穗槐二烯的产量从700 mg·L-1增加到了1.6 g·L-1[35]。2018年,Yan等[36]在大肠杆菌中构建了己二烯二酸(MA)启动子调控系统,在缺乏MA的情况下,两个MA响应转录因子(CatR)形成一个四聚体,然后与26 bp的抑制序列(rbs)和14 bp的激活序列(abs)序列结合使DNA弯曲,并阻断RNA聚合酶Rep激活catBCA启动子,关闭基因catBCA的转录。在MA的存在下,MA引发CatR构象变化,从而减轻DNA弯曲并使RNA聚合酶激活catBCA的转录。然后结合RNAi技术,形成双功能动态调控代谢网络技术,最终使MA产量达到1.8 g·L-1,远高于动态调控。
3.3 混菌发酵
随着合成生物学的发展,人工设计合成代谢途径越来越复杂,使得底盘菌株代谢负荷越来越大,利用两种或多种菌种对这些代谢网络进行分工合作,可以减轻菌株的代谢负荷,完成更复杂的代谢调控,从而提高效率。Liu等[37]将3种不同的菌进行混合发酵。首先,利用大肠杆菌将葡萄糖转化为乳酸提供C源和电子,枯草芽孢杆菌生产黄核素,瓦氏菌从中获得能量氧化乙酸为乙酸酯,为大肠杆菌和枯草芽孢杆菌提供C源。这3种微生物形成了交叉喂养的微生物联合体。在瓦氏菌、枯草杆菌和大肠杆菌的联合作用下,11 mmol·L-1葡萄糖转化为17.7 mmol·L-1乳酸,乳酸产量提高了10倍以上,枯草芽孢杆菌产生28.3 mol·L-1核黄素,提高了1.5倍,通过“分工”生产使乳酸和核黄素的产量达到最高水平。Zhou等[38]将细胞色素P450紫杉烯5α-羟化酶(5αCYP)及其还原酶(5αCYP-CPR)转入酿酒酵母细胞中表达,用来催化紫杉醇生物合成途径中的第一步氧化反应。接下来,将该菌与产紫杉烯大肠杆菌共同培养,以葡萄糖为唯一碳源,混合培养72 h产生了2 mg·L-1含氧紫杉烷。当只培养大肠杆菌或酿酒酵母时,未产生含氧紫杉醇类化合物。然而,由于酵母利用葡糖糖产生的乙醇抑制了大肠杆菌的生长代谢,在酵母存在时大肠杆菌的细胞密度和紫杉烯的浓度下显著降低。为了克服这个问题,将C源换成木糖,然而大肠杆菌代谢木糖产生的乙酸对它自己的生长有抑制作用。另一方面,酵母不能代谢木糖,但可以使用乙酸生长代谢并且不产生乙醇。因此,酿酒酵母只有在大肠杆菌存在下才能在木糖培养基中生长,大肠杆菌的细胞密度和紫杉烯的浓度也没太大波动。然后调节代谢通路和发酵优化,最终含氧紫杉烷的产量达到了33 mg·L-1。合成混菌体系已成为合成生物学的前沿之一,是合成生物学第二次浪潮的重要研究。
4 药用植物活性成分微生物细胞工厂合成研究进展
药用植物活性成分微生物细胞是通过设计并构建合成药用植物功效成分的细胞工厂来发酵生产植物天然产物(见表2),如今已有了飞速发展。其中最典型的例子是加州大学伯克利分校Jay Keasling研究团队[41]构建了一个高效生产青蒿素前体青蒿酸的酿酒酵母人工细胞,其产量高达25 g·L-1,并进一步通过化学半合成转化,实现了青蒿素的全合成[31]。在此工作的启发下,一些中药的功效成分如人参皂苷[39]、紫杉醇[40]、丹参酮、大黄素[42]等都陆续实现在微生物系统中合成。如Ajikumar等[26]通过将上游模块的4个关键酶基因以及下游模块的GGPP合酶基因和紫杉二烯合成酶基因导入大肠杆菌中,并通过进一步优化,紫杉醇二烯合成量最高达1.02 g·L-1,但由于由紫杉烯到紫杉醇的合成过程未完全解析,因此,通过合成微生物细胞工厂构建产紫杉醇仍需进一步探索;Wang等[43]在酿酒酵母底盘菌株BY4742中过表达甲羟戊酸(MVA)途径的所有基因包括上游模块的7个基因ERG10、ERG13、ERG12、ERG8、ERG19、IDI、tHMG1以及6个下游模块基因ERG1、ERG20、ERG9、synPgDDS、synPgPPDS、synPgCPR1,同时通过染色体整合增加一个synPgPPDS的拷贝数,通过条件优化,最终在10 L补料分批发酵中人参皂苷Rh2产量为2.25 g·L-1,是现有报道中产量最高的。大麻素(cannabinoids)是仅存在于大麻中的一类药用活性分子,其生物合成途径在20世纪90年代中期才被基本解析清楚。Luo等[44]通过在酵母中引入EfmvaE、EfmvaS基因,同时过表达ERG12、ERG8、ERG19和IDI1以及一个突变的ERG20基因,实现对酿酒酵母天然的的甲羟戊酸途径(mevalonate pathway)的改造,使其代谢流更多地流向大麻素重要中间体——香叶基焦磷酸(GPP);随后,该课题组通过引入RebktB、CnpaaH1、Cacrt、Tdter4个基因,在该菌株中引入了一条新的己酰辅酶A(hexanoyl-CoA)的代谢途径,GPP合成量达到了1.6 mg·L-1,较原菌株提高了7倍。Sun等[42]通过重组不同来源的酶,首先在酿酒酵母中构建内黄素和大黄素的合成通路,将来源于S.lycopersici的TE-less NR-PKS(SlACAS)与酿酒酵母中的不同MβL-TE共表达,当与HyTE偶联时,SlACAS产内黄素产率提高了115.6%,为了得到更多的大黄素,将鉴定的与HyDC具有高度同源性的7种脱羧酶分别引入生物合成途径中,挑选出催化活性最高的AfDC,进一步引入双点突变体乙酰辅酶A羧化酶ACC1S659A、S1157A以增加蒽醌的前体丙二酰辅酶A的产生,内黄素和大黄素的产量随后急剧增加到(233.6±20.3)、(253.2)mg·L-1,最终通过发酵优化,内黄素和大黄素滴度分别为(661±50.5)、(528.4±62.7)mg·L-1,均高于此前报道的水平。
5 药用植物活性成分植物细胞工厂合成进展
相较于微生物,植物与天然产物的亲缘关系更加接近,并且自身的催化系统更有利于天然产物相关基因的正确表达,由于植物自身可进行光合作用,有利于降低成本,一些模式植物如烟草、拟南芥、番茄等也都用来构建产天然产物底盘细胞(见表3)。
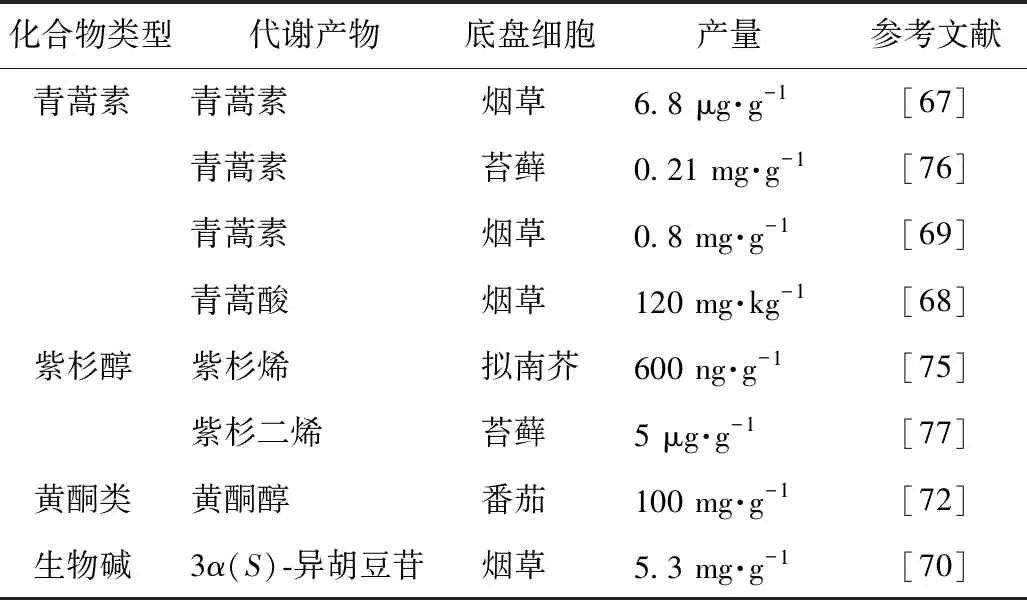
表3 药用植物活性成分植物细胞工厂研究进展
5.1 以烟草为底盘的植物细胞工厂
2011年Farhi等[67]在pSAT载体上同时整合紫穗槐-4,11-二烯合酶(ADS)、细胞色素P450家族的(CPR)还原酶、CYP71AV1羟化酶以及青蒿醛双键还原酶(DBR2)4个基因,并通过农杆菌转化技术首次实现了青蒿素在烟草中的异源合成。然后过表达甲羟戊酸(MVA)途径限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(tHMG),以增加青蒿素的前体物质,最后运用信号ADS定位到线粒体上的方式,使烟草中青蒿素质量分数达到6.8 μg·g,-1。该工作展示了利用烟草等植物底盘进行青蒿素合成的可能。2016年,Fuentes等[68]将青蒿酸的合成途径的完整基因全部整合到烟草叶绿体的基因组中,同时引入一些基因使系统更加稳定,最终获得了120 mg(以1 kg生物量计)青蒿酸。2016年,Malhotra等[69]把在烟草细胞中合成青蒿素的途径进行模块化:先利用信号肽cox4融合将ADS定位在线粒体中,再通过质体导肽将CYP71AV1、CPR、DBR2定位在叶绿体内,最后在叶绿体中引入酵母的整条MVA途径来增加萜类前体供应,最终获得0.8 mg·g-1的青蒿素。
Hallard等[70]将长春花中的TDC基因转入烟草细胞,并将TDC基因过表达,3α(S)-异胡豆苷的产量分别增加到5.3 mg·L-1。Miettinen等[71]把长春花马钱子苷途径中的4个酶(8-HGO、IO、7-DLGT、7-DLH)以及TDC与STR酶转入烟草中,在异源植物烟草中重构了整个MIA途径,实现3α(S)-异胡豆苷的合成。
5.2 以番茄为底盘的植物细胞工厂
英国植物代谢工程专家Cathie Martin团队[72]以番茄为底盘,将拟南芥的转录因子AMYB12等在番茄中进行过表达,大幅提高番茄中黄酮醇等物质的含量,干物质质量分数达到100 mg·g-1。Tohge等[73]在番茄中引入金鱼草来源的转录因子Delila和Rosea1后,检测到花青素和苯丙类黄酮衍生物的含量都有所增加。随后该团队通过在番茄中引入拟南芥来源的黄酮特异性调控因子AtMYB12,检测到黄酮类化合物和对羟基肉桂酸乙酯的质量分数达到了果实干质量的10%。
5.3 其他底盘的植物细胞工厂
在紫杉醇的生物合成途径中,牻牛儿基焦磷酸(GGPP)在taxadiene合酶(TXS)的作用下生成紫杉烯,然后经过大约12步酶促反应最终合成紫杉醇[74]。在拟南芥中表达紫杉(Taxus baccata)的TXS基因,转基因植株虽然可以积累紫杉烯,但同时出现生长迟缓和光合色素含量减少等现象。OSCAR等[75]采用诱导表达系统,用糖皮质激素处理后,紫杉烯含量比组成型表达得到的转基因植株提高30倍,达到了600 ng干质量。
NKB K等[76]将ADS、CYP71AV1、ADH1、DBR2和ALDH1 5个基因在苔藓中共表达后,经过进一步的光氧化后,青蒿素产量为0.21 mg·g-1。Anterola等[77]将红豆杉来源的紫杉二烯合酶转入小立碗藓中并表达,获得了产紫杉二烯5 μg·g-1的转基因植株。
6 问题及未来研究重点
如今运用合成生物学生产药用植物功效成分已取得了一定的发展,但仍有一些问题需要克服:1)天然产物代谢复杂及解析方法技术的不完备限制了代谢途径的解析效率。植物天然产物代谢途径复杂往往呈交叉网络状,牵一发动全身,甚至受时空影响,大大增加了其解析难度;解析天然代谢途径需要做大量的工作及技术的支持。生物信息学的快速发展为找代谢通路中的相关基因簇做出了巨大贡献,但目前代谢组学和基因组学的发展限制了其功能基因验证的效率。因此,目前首要任务是加快代谢组学和基因组学方法技术的创新,提高鉴定基因簇的效率。2)基因元件数量少、异源表达效率低且模块化与标准化不完善是重构代谢途径的障碍。目前虽然已建立有基因元件库,但其中的基因元件数量和自然中基因元件资源相比仍是冰山一角。植物中的基因元件转入异源微生物中后效率较低,如“万能生物催化剂”细胞色素P450酶(CYPs)。CYPs活性的发挥往往需要细胞色素P450氧化还原酶(CPR)的协助,而大肠杆菌中并没CPR;相对来说酵母表达系统自带CPR,具有一定的优势,但仍要需注意CYPs的偏好性,以保证其能高效表达。通过蛋白定向进化、代谢突变、基因编辑等手段对基因元件进行模块化和标准化修改,将基因元件变为可“即插即用”的标准“零件”,有利于代谢通路的简约化设计和工程化构建。3)营养物质在底盘细胞中更多的是流向了初级代谢流,只有很少一部分才流向目的代谢流。如碳流在酵母细胞中主要流向了乙醇合成途径,合成天然产物则希望碳流少流入甚至不流入乙醇合成途径,更多地流入目的代谢流。将底盘细胞基因组简化,将会大大改善这种情况。目前有“自上而下”和“自下而上”两种手段来实现此目的,即在原有的基因组上敲除非必需基因和人工合成基因组来获得最简基因组。但基因组的简化会影响到正常的细胞功能,因此,找到两者的平衡点至关重要。目前设计最简基因组还处于比较初期的阶段,科研人员仍需努力。

