血清IL-6、IL-10、IL-17及IL-33水平与食管癌患者放射性肺损伤关系的研究
陈安艳,王连青,申振涛,闫琳
聊城市传染病医院肿瘤科,山东 聊城 252000
放射性肺损伤(radiation induced lung injury,RILI)是临床常见的胸部肿瘤放射治疗后的并发症和最主要的剂量限制性不良反应[1]。近年来放疗技术不断发展,尤其是三维适形放疗和调强放疗大大延长了食管癌患者的生存期,但是放疗对肺部正常组织造成的损伤仍然是影响患者预后和生活质量的主要危险因素[2]。而联合使用化疗药物更是在某种意义上增加了RILI的发生率[3]。寻找关键的生物效应分子,及早预测并判断RILI对肺癌患者的风险分层和个体化治疗具有重要的临床价值。基于近年来有关RILI机制的深入研究,普遍认为炎症反应是造成肺损伤的主要原因。由肺泡上皮细胞、巨噬细胞、成纤维细胞等分泌的一系列细胞因子及趋化因子相互作用,可启动并维持“瀑布样”炎症反应,从而引发RILI,促进胶原纤维大量产生,最终进展为肺纤维化[4]。本研究采用三维适形放疗或调强放疗治疗局部晚期食管癌患者,分析放疗前后患者的血清白细胞介素(interleukin,IL)-6、IL-10、IL-17及IL-33水平,并结合患者的临床特征,分析食管癌患者发生RILI的影响因素,现报道如下。
1 对象与方法
1.1 研究对象
选择2016年1月至2017年11月于聊城市传染病医院就诊的局部晚期食管鳞状细胞癌患者117例。纳入标准:①经病理学检查确诊为食管鳞状细胞癌;②首次确诊,TNM分期为Ⅲb~Ⅳ期;③初次接受放射治疗;④不可手术或拒绝手术并自愿接受胸部放疗;⑤预计生存时间>6个月;⑥卡氏功能状态(Karnofsky performance status,KPS)评分>70分。排除标准:①既往接触过放射性物质者;②入院前6个月有胸部手术史者;③合并严重肺气肿、消化道炎症、肺心病、肺功能不全、心肌梗死、糖尿病者。117例患者中,男70例,女47例;年龄为27~82岁,平均年龄为(59.58±13.98)岁。根据放疗后是否发生2级及以上RILI将患者分为RILI组和非RILI组。本研究经医院伦理委员会审核通过,所有患者均对本研究知情并签署知情同意书。
1.2 治疗方案
制订放疗计划:采用西门子Somatom Spirit CT模拟定位机及医科达IMPAC放射治疗网络系统进行胸部计算机体层摄影(CT)模拟定位增强扫描,图像经放射治疗网络数字化传输,采用医科达核通Oncentra治疗计划系统进行三维重建。由放疗中心两位副主任医师勾画肿瘤靶区体积(gross target volume,GTV)、临床靶区体积(clinical target volume,CTV)和计划靶区体积(planning target volume,GTV),所有患者均接受6-MV X线照射,常规分割剂量为每次1.8~2.0 Gy共23次或2.0 Gy×20次后行大孔径CT复位。采用5~9野共面照射技术,危及器官的剂量限制:全肺V20<26%;脊髓受量<45 Gy;心脏Dmean<35 Gy,V40<30%,V30<40%。所有患者接受放疗的总剂量为50~60 Gy,5~6周完成治疗。其中74例患者于放疗前或放疗后3个周期接受以铂类化合物为基础的化疗方案,顺铂25 mg/m2,d1~3,21天为1个周期。
1.3 观察指标及检测方法
分析患者放疗前后的外周血IL-6、IL-10、IL-17、IL-33水平。分别于放疗前、放射剂量达到20 Gy、放射剂量达到40 Gy、放疗结束时以及放疗开始后第12、24、28周采集患者的外周静脉血,为了确保结果的一致性,尽量将采血时间控制在7:00-9:00 am。将采集的血液置于真空采血管中,室温静置15 min,3000 r/min离心15 min,离心半径为8 cm。取上清,置于-70℃冰箱中保存备用。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)进行检测,按照试剂盒说明书进行操作。试剂盒购自武汉基因美生物科技有限公司,全自动酶免分析仪购自美国BIO-RAD公司。
1.4 随访方法及评价标准
患者出院后前3个月,每个月复查1次;出院后3~12个月,每3个月复查1次;出院1年后,每6个月复查1次。复查项目包括体检及血常规、肝功能、胸部CT检查等。随访截止时间为2018年9月。由2名专业医师根据胸部CT检查结果以及临床指征,按照美国放射肿瘤学协作组(Radiation Therapy Oncology Group,RTOG)制定的标准[6]诊断RILI。RILI的影像学诊断标准:①有胸部放疗史;②在X线片或CT片上出现与放射野基本一致的肺部病变,可见斑片状、片状密度增高的模糊阴影,CT片可见磨玻璃状或云雾状阴影,典型者呈“直的边缘效应”或“十字征”,可伴有胸膜反应或少量胸腔积液;③肺部病变在抗生素治疗1周后不消失或将永久性存在。诊断RILI时需排除肺内感染及肺内病变进展,且相关症状分级至少较放疗前增加1级。评价终点为2级及以上RILI。
1.5 统计学分析
采用SPSS 17.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Logisitc回归模型分析食管癌患者发生RILI的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 RILI 的发生情况
117例患者随访2~13.5个月,中位随访时间为6.7个月。20例(17.09%)患者在放疗结束后6个月内发生2级及以上RILI,其中2级RILI 16例,3级RILI 4例,无4级和5级RILI。
2.2 两组患者临床特征的比较
RILI组患者20例,非RILI组患者97例。RILI组患者的年龄为(64.80±11.25)岁,高于非RILI组的(57.11±13.69)岁,差异有统计学意义(t=2.351,P<0.05)。RILI组和非RILI组患者的性别、化疗情况、既往肺功能状态比较,差异均有统计学意义(P<0.05);RILI组和非RILI组患者的吸烟情况、KPS评分、临床分期、放射剂量比较,差异均无统计学意义(P>0.05)(表1)。

表1 两组患者临床特征的比较
2.3 血清IL-6、IL-10、IL-17、IL-33水平的比较
放疗前,RILI组和非RILI组患者的血清IL-6、IL-10、IL-17、IL-33水平比较,差异均无统计学意义(P>0.05)。随着放射剂量增加和时间推移,非RILI组患者的血清IL-6、IL-10、IL-17、IL-33水平均无明显变化。RILI组患者放射剂量达到40 Gy时,血清IL-6水平出现一个小高峰,放疗结束后,RILI组患者的血清IL-6水平逐渐上升,放疗开始后第12周时血清IL-6水平达到峰值,随后逐渐降低;放射剂量达到40 Gy、放疗结束时以及放疗开始后第12、24周时,RILI组患者的血清IL-6水平均高于非RILI组,差异均有统计学意义(P<0.05)。随着放射剂量增加和时间推移,RILI组患者的血清IL-10水平无明显变化;放射剂量达到20 Gy时、放射剂量达到40 Gy时、放疗结束时以及放疗开始后第12、24、28周时,两组患者的血清IL-10水平比较,差异均无统计学意义(P>0.05)。从放射剂量达到40 Gy起,随着放射剂量增加和时间推移,RILI组患者的血清IL-17水平逐渐升高,至放疗开始后第24周时达到峰值;放疗结束时以及放疗开始后第12、24、28周时,RILI组患者的血清IL-17水平均高于非RILI组,差异均有统计学意义(P<0.05)。从放射剂量达到40 Gy起,随着放射剂量增加和时间推移,RILI组患者的血清IL-33水平逐渐升高,放疗开始后第12周时达到峰值,随后逐渐降低;放疗结束时以及放疗开始后第12、24、28周时,RILI组患者的血清IL-33水平均高于非RILI组,差异均有统计学意义(P<0.05)。(表2)
表2 不同时间点两组患者血清IL-6、IL-10、IL-17、IL-33水平的比较(pg/ml,±s)

表2 不同时间点两组患者血清IL-6、IL-10、IL-17、IL-33水平的比较(pg/ml,±s)
注:*与同时间点非RILI组比较,P<0.05
指标IL-6 IL-10 IL-17 IL-33时间放疗前放射剂量达到20 Gy放射剂量达到40 Gy放疗结束时放疗开始后第12周放疗开始后第24周放疗开始后第28周放疗前放射剂量达到20 Gy放射剂量达到40 Gy放疗结束时放疗开始后第12周放疗开始后第24周放疗开始后第28周放疗前放射剂量达到20 Gy放射剂量达到40 Gy放疗结束时放疗开始后第12周放疗开始后第24周放疗开始后第28周放疗前放射剂量达到20 Gy放射剂量达到40 Gy放疗结束时放疗开始后第12周放疗开始后第24周放疗开始后第28周RILI组(n=20)67.85±17.35 76.51±15.82 106.32±23.18*89.16±16.48*134.65±22.87*123.60±21.42*85.03±17.69 9.25±3.13 8.96±2.85 10.04±2.98 9.83±3.10 11.14±3.39 10.68±3.21 10.26±3.30 79.51±18.76 81.55±20.73 93.42±21.56 128.67±28.45*138.90±25.82*142.78±30.04*134.23±24.95*497.81±66.94 510.75±72.36 563.82±95.78 647.15±91.60*758.68±110.75*659.67±96.32*587.44±85.35*非RILI组(n=97)74.31±14.22 71.80±12.79 74.57±17.62 72.33±15.89 79.84±18.79 72.57±15.94 79.42±14.85 9.91±3.42 8.98±3.11 9.95±2.78 10.49±3.25 10.80±2.97 9.93±3.28 9.75±2.91 83.14±21.20 83.98±21.89 95.79±24.81 94.38±24.69 93.11±21.30 89.85±26.42 87.46±19.87 500.02±79.83 517.88±84.20 512.56±81.49 489.23±86.72 502.34±87.13 510.78±80.69 487.26±75.63
2.4 血清IL-6、IL-10、IL-17、IL-33水平变化情况的比较
放疗期间,RILI组中IL-6、IL-17、IL-33升高的患者比例均高于非RILI组,差异均有统计学意义(P<0.05);RILI组和非RILI组中IL-10升高的患者比例比较,差异无统计学意义(P>0.05)。(表3)
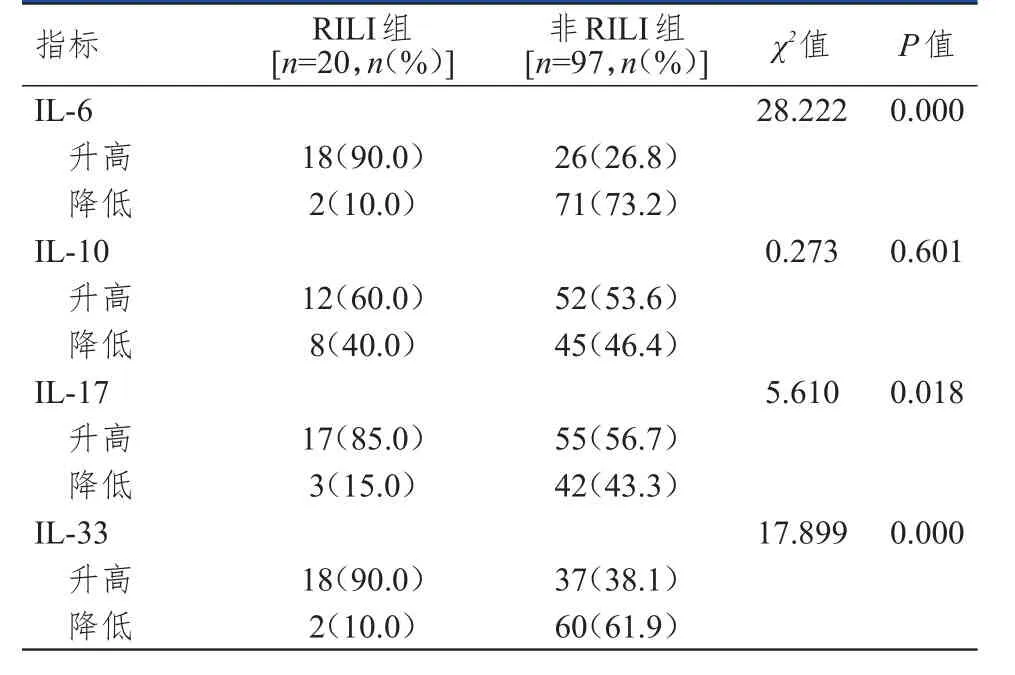
表3 两组患者放疗期间血清IL-6、IL-10、IL-17、IL-33水平变化情况的比较
2.5 食管癌患者发生RILI影响因素的Logistic多因素分析
Logistic多因素逐步回归分析结果显示,年龄、化疗、既往肺功能异常及血清IL-6、IL-17、IL-33水平升高均是食管癌患者发生RILI的独立危险因素(P<0.05)。(表4)

表4 食管癌患者发生RILI影响因素的Logistic多因素分析(n=117)
3 讨论
中国属于食管癌的高发地区,对于局部晚期食管癌患者多采取以放化疗为主的综合治疗方案。但是不同患者即使临床特征类似、放射剂量和放疗方案相同,其发生RILI的风险也不甚相同[7]。近几年,随着三维适形放疗和调强放疗技术的发展,虽然食管癌的局部控制率及患者的生存率均获得一定程度的改善,因放化疗造成的肿瘤周围正常组织损伤的风险已经大大降低,但RILI仍然是影响患者预后和生活质量最重要的危险因素之一。临床上制订放疗方案的原则是在确保正常组织辐射耐受的前提下,尽可能提高对肿瘤组织的辐射剂量。然而在目前循证医学治疗模式下,所有的食管癌患者仍然是按群体的最佳数据给予放射治疗,因此探索RILI的影响因素对于个体化治疗具有十分重要的临床价值。
本研究共纳入117例局部晚期食管鳞状细胞癌患者,进行根治性三维适形放疗或调强放疗,根据V20、V30等经典物理学参数评估放疗计划,但是仍有20例患者放疗开始后6个月内发生2级及以上RILI,其发生率为17.09%,与相关文献报道的数据基本一致[8]。说明经典物理学参数并不能完全预测RILI的发生。目前,很多研究证实多种细胞因子或趋化因子与RILI的发生密切相关,有望成为预测或动态监测RILI发生的重要指标。王忠明等[9]研究表明,血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)及T淋巴细胞亚群水平与放射性肺病具有一定的相关性。郑芳芳等[10]研究发现,放疗前IL-8水平较低的肺癌患者及放疗20 Gy时TGF-β1水平升高的肺癌患者,RILI的发生风险较高。除此以外,鲜有相关研究探讨其他细胞因子与RILI的关系。IL-6、IL-10、IL-17和IL-33均属于典型的炎症诱导或抑制因子,一直是各型炎症以及免疫紊乱等疾病研究的热点之一[11]。IL-6是炎症急性期合成的一种重要的非特异性炎症因子,可通过激活核因子κB(nuclear factor of kappa B,NF-κB)、SMAD和丝裂原激活蛋白激酶(mitogen activation protein kinase,MAPK)等多条途径活化相关炎症细胞,促进细胞外基质沉积和胶原纤维生成,参与肺部炎症甚至纤维化的病理过程[12]。本研究中,随着放射剂量增加和时间推移,RILI组患者的血清IL-6水平出现波动,先升高后回落,随后又再次升至峰值后回落,推测可能由于放射线造成肺组织损伤后引起炎症反应,导致IL-6合成迅速增加,而随着机体免疫系统对炎症反应的自我调控作用以及炎症的逐渐消退,IL-6水平呈回落趋势。由于RILI组患者已经出现放射性损伤,并不能完全自我修复,引起各种炎症细胞募集,并促使IL-6进一步分泌,进一步造成炎症因子的“级联瀑布反应”,最终加剧了RILI。IL-10主要是由调节性T细胞产生的一类干扰素家族成员之一,属于抗炎因子。IL-17则是由辅助性T细胞(helper T cell,Th)产生的一类细胞因子,通过与IL-17受体结合,促使趋化因子的表达,进而增加集落刺激因子的大量分泌,从而招募多种炎症细胞,引起RILI的发生。尤其在炎症或感染早期,IL-17可通过有效介导中性粒细胞参与促炎症反应,属于早期炎症反应的预测因子[13]。目前IL-17与RILI发生关系的研究并不多见。IL-33是表达于肺泡上皮细胞及内皮细胞表面的一类细胞因子,通过与其受体ST2结合诱导Th2细胞活化,参与多种免疫炎症性疾病的发生。基于上述理论分析,本研究分析食管癌患者中IL-6、IL-10、IL-17及IL-33四种细胞因子与RILI的关系,结果显示,随着放射剂量增加和时间推移,RILI组患者的血清IL-6、IL-17和IL-33水平均呈升高趋势,从放疗结束开始,RILI组患者的血清IL-17和IL-33水平均高于非RILI组患者,而IL-6水平则出现一定程度的波动,但是整体水平一直高于非RILI组患者,但是并未发现RILI组患者血清IL-10水平出现明显波动。说明IL-10与RILI的关系可能不大,与Arpin等[14]的研究结果基本一致。动物实验证实,博来霉素诱发小鼠肺组织急性损伤后,在小鼠的肺组织中也观察到了类似于人类RILI的急性炎症期及慢性纤维化期的肺损伤过程,在此过程中,小鼠血清中维持高水平的IL-33,提示IL-33可能参与了肺组织损伤后的病理生理进程[15]。本研究结果证实了放疗期间IL-33水平升高可作为RILI早期的预测因子。对于放疗期间IL-6、IL-17、IL-33等炎症因子异常升高,但尚未表现出典型的RILI临床症状的患者,需进一步结合影像学检查判断RILI的程度,并调整治疗方案,减少肺野受累剂量,并给予阿米福汀等预防性药物。同时放疗过程中尽量避免感冒或其他口腔、呼吸道感染,做好防护工作,以降低RILI的发生率。本研究结果还显示,年龄、化疗、既往肺功能异常及血清IL-6、IL-17、IL-33水平升高均是食管癌患者发生RILI的独立危险因素(P<0.05)。然而本研究纳入的样本量较少,结果可能存在一定的偏差,需加大样本量进一步研究。
综上所述,RILI是一个涉及多阶段、多因素、复杂的动态过程,需综合考虑各种因素的影响,准确评估肺癌患者发生RILI的危险因素,以实现个体化治疗。对于高龄、联合化疗、既往肺功能异常以及放疗期间IL-6、IL-17、IL-33水平升高的局部晚期食管癌患者,必须监测肺功能指标,以指导临床调整放疗计划。

