白蛋白结合型紫杉醇在HER2阴性原发性乳腺癌新辅助化疗中的疗效和安全性
戴丹菁,胡川,景娈恋,刘倩,谢娟,余昌文
汉川市人民医院肿瘤科,湖北 汉川 431600
2015年,中国26.86万女性罹患乳腺癌,6.95万患者死亡[1]。资料显示,全球每年新发乳腺癌病例超过100万,约50万患者因此死亡,乳腺癌居女性全部恶性肿瘤发病率首位[2]。随着相关基础和临床研究的深入以及乳腺癌个体化治疗的推广,患者的预后得到了显著改善,但仍然难以令人满意[3]。紫杉醇是一种二萜生物碱类化合物,是常用的治疗乳腺癌的药物,其可以诱导和促进细胞纺锤丝微管蛋白稳定结合,阻止细胞有丝分裂,导致肿瘤细胞凋亡[4]。《中国抗癌协会乳腺癌诊治指南与规范(2013版)》[5]将剂量密集多柔比星+环磷酰胺序贯紫杉醇作为乳腺癌新辅助化疗的推荐方案。白蛋白结合型紫杉醇(albumin-bound paclitaxel,Nab-T)是采用纳米技术将紫杉醇与白蛋白结合,使紫杉醇进入细胞的方式变为胞吞转运。一项接种人类乳腺癌细胞的裸鼠药物动力学实验研究表明,Nab-T剂型较传统紫杉醇可使细胞内药物浓度增加33%,并且表现出更高的组织穿透力,使药物到达更深层的组织[6-7]。本研究比较了Nab-T与普通溶剂型紫杉醇在乳腺癌新辅助化疗中的疗效与安全性,现报道如下。
1 对象与方法
1.1 研究对象
选择2013年6月至2016年6月于汉川市人民医院治疗的150例HER2阴性原发性乳腺癌患者。纳入标准:①经原发灶空心针穿刺病理诊断为浸润性乳腺癌;②人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性;③未接受过抗肿瘤治疗。排除标准:①身体状况较差,不能耐受化疗的患者;②妊娠患者;③携带心脏起搏器的患者;④影像学结果为多中心病灶的患者;⑤不需要化疗的Luminal A型患者。采用随机数字表法将150例患者分为紫杉醇组和Nab-T组,每组75例。两组患者均予以多柔比星+环磷酰胺序贯紫杉醇方案化疗,其中紫杉醇组使用普通溶剂型紫杉醇,Nab-T组使用Nab-T。两组患者的年龄、月经状态、病理类型、临床分期、分子分型比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会审核通过,所有患者均对本研究知情并签署知情同意书。

表1 两组患者的临床特征
1.2 治疗方法
参考《中国抗癌协会乳腺癌诊治指南与规范(2013版)》[5]中的方案对患者进行治疗。紫杉醇组患者予以多柔比星+环磷酰胺序贯普通溶剂型紫杉醇新辅助化疗,3周为1个周期,共化疗8个周期,第1~4个化疗周期的第1天予多柔比星50 mg/m2、环磷酰胺500 mg/m2静脉滴注,第5~8个化疗周期的第1天予普通溶剂型紫杉醇175 mg/m2静脉滴注。Nab-T组患者将上述方案中的普通溶剂型紫杉醇替换为Nab-T,剂量为260 mg/m2。用药前予西咪替丁护胃,地塞米松口服预防过敏,出现并发症时给予相应的对症治疗。
1.3 观察指标及评价标准
依据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1 版[8]进行疗效评价:完全缓解(complete response,CR),肿瘤完全消失;部分缓解(partial response,PR),肿瘤病灶最大径之和减小≥30%;疾病进展(progressive disease,PD),肿瘤病灶最大径之和增加≥20%或出现新病灶;疾病稳定(stable disease,SD),介于PR和PD之间。总有效率(overall response rate,ORR)=(CR+PR)例数/总例数×100%。依据抗癌药物常见毒副反应分级标准[9]评估患者新辅助化疗期间的不良反应并进行分级。比较两组患者的无进展生存率。
1.4 随访方法
治疗结束后2年内每3个月门诊随访1次,第3年每6个月门诊随访1次,检查内容包括体检触诊、血常规、生化检查、肝脏彩超及胸部X线。随访时间为3~36个月,末次随访时间为2019年6月。
1.5 统计学方法
采用SPSS 21.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验,等级资料的比较采用Mann-WhitneyU检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
紫杉醇组和Nab-T组患者的ORR分别为85.33%(64/75)和86.67%(65/75),差异无统计学意义(P>0.05);Nab-T组患者的CR率为36.00%,高于紫杉醇组的21.33%,差异有统计学意义(χ2=3.945,P<0.05)。(表2)
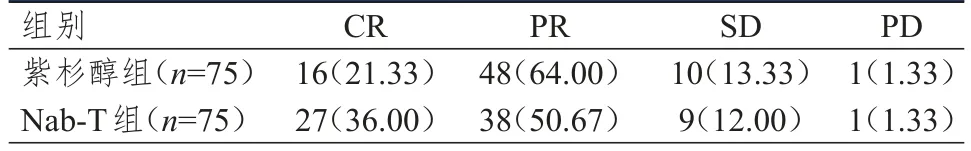
表2 两组患者的临床疗效[n(%)]*
2.2 不良反应发生情况的比较
Nab-T组患者神经毒性严重程度高于紫杉醇组,差异有统计学意义(Z=1.969,P<0.05)。两组患者白细胞减少、血小板减少、胃肠道反应、脱发、口腔黏膜炎、心脏毒性及过敏反应的发生情况比较,差异均无统计学意义(P>0.05)。(表3)
2.3 生存情况的比较
随访时间为3~36个月,紫杉醇组患者的3年无进展生存率为57.6%,与Nab-T组患者的62.3%比较,差异无统计学意义(P>0.05)。(图1)
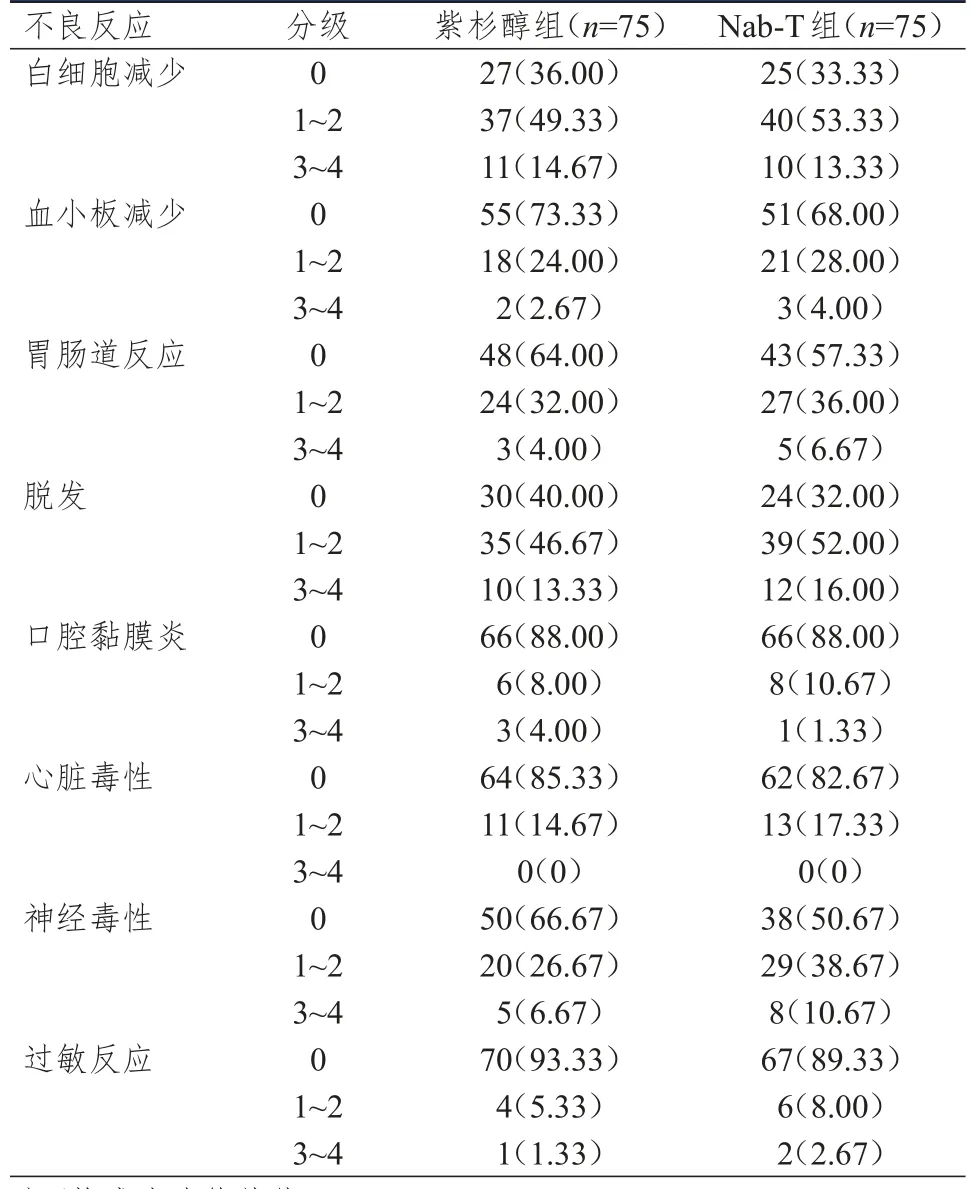
表3 两组患者的不良反应发生情况[n(%)]*

图1 紫杉醇组(n=75)和Nab-T组(n=75)患者的无进展生存曲线
3 讨论
中国每年超过160万人被确诊为恶性肿瘤,120万人死于恶性肿瘤,人们的健康负担日益加重[10]。与大多数其他国家一样,乳腺癌是中国女性最常见的恶性肿瘤,中国乳腺癌病例占全球新诊断乳腺癌的12.2%,占全世界乳腺癌死亡人数的9.6%[11]。不同地区和医院的乳腺癌治疗方式具有很大差异,虽然自20世纪90年代以来各国指南都推荐以保乳手术(只要可能)作为推荐术式,然而,一项全国性调查结果显示,中国乳房切除术占原发性乳腺癌手术的88.8%,远高于美国(36%)等发达国家[12]。研究指出,新辅助化疗可以提高乳腺癌患者的总有效率、近期及远期生存率,其目的在于:①缩小肿瘤原发灶体积,减轻患者的身体负荷;②减少肿瘤组织中缺氧细胞数量,提高乳腺癌的放疗敏感性;③消灭可能存在的亚临床病灶或微转移灶[13-14]。因此,新辅助化疗是降低临床分期,提高保乳手术实施率的有效手段。
目前多柔比星+环磷酰胺序贯紫杉醇是乳腺癌新辅助化疗常用的推荐方案。动物实验结果表明,Nab-T可以显著提高乳腺癌细胞对紫杉醇的转运效率,相比传统溶剂型紫杉醇,Nab-T采用无水乙醇等有机溶剂作为载体,对肿瘤细胞的靶向作用增强且组织利用率显著提高[6]。本研究结果显示,Nab-T组患者的CR率(36.00%)高于紫杉醇组患者(21.33%),差异有统计学意义(P<0.05),但两组患者的ORR比较,差异无统计学意义(P>0.05),这与Untch等[15]的研究结果类似。然而张岭等[16]研究报道,Nab-T不能显著提高乳腺癌患者的CR率。因此,Nab-T是否能使乳腺癌患者近期获益仍需大样本临床试验和高质量荟萃分析予以证实。
Matsui等[17]分析了66例乳腺癌患者的临床资料,结果发现,Nab-T可以降低患者化疗相关不良反应,可能是因为其提高了药物对肿瘤细胞的靶向作用,降低了其在正常组织中的浓度。本研究结果显示,Nab-T组患者神经毒性严重程度高于紫杉醇组,差异有统计学意义(P<0.05);两组患者白细胞减少、血小板减少、胃肠道反应、脱发、口腔黏膜炎、心脏毒性及过敏反应的发生情况比较,差异均无统计学意义(P>0.05)。因此,Nab-T用药安全性仍有待更多研究证实。
Tamura等[18]研究结果显示,接受多西他赛和Nab-T治疗的内脏转移乳腺癌患者的无进展生存时间和总生存时间比较,差异均无统计学意义(P>0.05);但在内脏显性转移患者中,采用Nab-T治疗的患者中位无进展生存时间为13.1个月,长于采用多西他赛治疗患者的7.8个月,差异有统计学意义(P=0.019)。本研究结果显示,紫杉醇组和Nab-T组患者的3年累积无进展生存率比较,差异无统计学意义(P>0.05),与Martín等[19]的研究结果类似。
综上所述,Nab-T新辅助化疗可能使HER2阴性乳腺癌患者的CR率提高,但也有增加神经毒性的风险,且不能显著提高患者的远期无进展生存率。

