Vasostatin-1对缺氧复氧肾小管上皮细胞炎性损伤的影响
高博,胡芳芳,高艳凤
论著
Vasostatin-1对缺氧复氧肾小管上皮细胞炎性损伤的影响
高博,胡芳芳,高艳凤
探讨血管生成抑制因子vasostatin-1(VS-1)对缺氧复氧肾小管上皮细胞的炎性损伤作用及机制。
采用缺氧复氧方式制造肾小管上皮细胞炎性损伤。构建慢病毒载体并以脂质体法将shVS-1 转染 NRK-52E 细胞。ELISA 法检测细胞中 LDH 和 IL-1β 含量;Western blot 检测细胞中 VS-1、pro-caspase-1 和 caspase-1 蛋白表达。
与对照组相比,缺氧复氧组细胞 LDH 和 IL-1β 含量显著升高,且 VS-1 蛋白表达显著升高。成功构建沉默 VS-1 的慢病毒载体,且转染缺氧复氧 NRK-52E 细胞,可降低细胞中 LDH 和 IL-1β 含量、降低 caspase-1 蛋白表达,过表达 VS-1 则具有相反的功能。
沉默 VS-1 可保护缺氧复氧肾小管上皮细胞的炎性损伤,可能与下调 caspase-1 有关,可为急性肾损伤的临床治疗提供依据。
Vasostatin-1; 缺氧复氧; 肾小管上皮细胞; 炎性损伤; 炎性因子
急性肾损伤又称急性肾衰竭,是一种涉及多种疾病的临床常见危重病症[1]。医院患者急性肾损伤的发生率在 1.4% ~ 25.9%,死亡率为 60.3%[2]。炎症反应是引起缺血再灌注肾损伤的重要原因,肾小管上皮细胞为缺血再灌注肾损伤的重要效应细胞,是肾脏炎症介质的关键[3]。血管生成抑制因子vasostatin-1(VS-1)是在应激状态下由脊椎和无脊椎动物神经、内分泌以及弥散性神经内分泌系统释放的嗜铬粒蛋白 A 通过组织特异性加工程序产生的N 端 1 ~ 76 酶解多肽片段,具有舒张血管、促进机体固有免疫、调节细胞黏附等多种组织非特异性稳态调节作用[4-6]。各种炎症因子,如肿瘤坏死因子(TNF)、血管内皮生长因子,造成内皮细胞损伤、内皮屏障功能紊乱和血管渗漏以吸引炎症中单核巨噬细胞聚集、黏附内皮、迁入内皮下间隙形成泡沫细胞[7]。VS-1 具有促进血管舒张,减少内皮细胞的趋化、增殖、血管渗漏及抑制炎症细胞黏附的功能[8]。VS-1 在冠状动脉病变组织中低表达,但在外伤或炎症应激状态下表达明显升高[9]。但 VS-1 在炎症状态下升高的机制尚未阐明。VS-1 在慢性结肠炎和肿瘤新生血管形成中均有报道[10-11]。大量研究报道 VS-1 在缺血性心脏疾病的防治中具有很大潜力。但 VS-1 在急性肾损伤中的作用机制尚未完全清楚。本研究将建立缺氧复氧(H/R)肾小管上皮细胞损伤,构建沉默 VS-1 的慢病毒载体和沉默 VS-1 的缺氧复氧肾小管上皮细胞,观察沉默 VS-1 对缺氧复氧肾小管上皮细胞损伤和炎症因子 caspase-1 的影响,揭示沉默 VS-1 可保护缺氧复氧肾小管上皮细胞的损伤,可能与下调 caspase-1 有关,为急性肾损伤的临床诊断治疗提供理论依据。
1 材料与方法
1.1 材料
大鼠肾小管上皮细胞 NRK-52E 购自 ATCC 细胞库;DMEM 培养基、DH5α 感受态细胞、HQ 高纯度质粒抽提试剂盒、LipofectamineTM2000、PUC-T 载体连接试剂盒、R I、I 内切酶均购自北京康为世纪生物科技有限公司;PVDF 膜购于德国罗氏诊断有限公司;乳酸脱氢酶(LDH)检测试剂盒购自上海碧云天生物技术有限公司;IL-1β 检测试剂盒购自上海酶联生物科技有限公司;凝胶成像分析仪购自日本柯达公司;半干转膜仪购自美国 Bio-Rad 公司。
1.2 方法
1.2.1 细胞培养 采用含 10% 胎牛血清的 DMEM 培养基培养大鼠肾小管上皮细胞NRK-52E,置于 37 ℃、5% CO2和 95% 空气的恒温培养箱中常规培养。
1.2.2 缺氧复氧肾小管上皮细胞模型 当细胞长到对数生长期时,用无血清的 DMEM 培养基处理细胞 24 h,培养液用不含血清和抗生素的磷酸盐缓冲液、换用 1% O2+ 94% N2+ 5% CO2混合气体的37 ℃缺氧箱中缺氧培养 4 h。然后复氧培养,如 1.2.1 培养方法培养 3、6、12 和 24 h,收集细胞及培养液上清。
1.2.3 构建沉默 VS-1 的慢病毒载体 shVS-1 核苷酸序列由美国 Invitrogen 公司合成,然后将 shVS-1 插入到表达载体 PUC-T,4 ℃连接过夜,瞬时转化至感受态细胞 DH5α,然后摇菌培养,涂板过夜培养。挑取单克隆株扩大培养,用 HQ 高纯度质粒抽提试剂盒提取质粒。构建质粒 shVS-1,最后将其转化至感受态细胞 DH5α 中。在转化平板中挑取克隆株并验证其是否与插入基因片段一致。
1.2.4 细胞转染 将构建载体 shVS-1、Scrambled 和 pcDNA、pcDNA-VS-1 用LipofectamineTM2000 转染到常规培养的 NRK-52E 细胞。然后进行缺氧复氧培养 12 h。转染-制造细胞损伤成功后用于酶联免疫吸附试验、Western blot 实验。
1.2.5 酶联免疫吸附试验 按照检测试剂盒的技术手册检测细胞中 LDH 和 IL-1β 含量。
1.2.6 Western blot 实验 取适量缺氧复氧处理 12 h 的 NRK-52E 细胞和转染细胞,RIPA 裂解液裂解后,提取总蛋白,BCA 法蛋白定量后变性,按照 Western blot 实验步骤进行操作。以目的条带灰度值与内参 GAPDH 灰度值的比值表示目的蛋白 VS-1、pro-caspase-1、caspase-1 的表达情况。
1.3 统计学处理

2 结果
2.1 缺氧复氧肾小管上皮细胞的炎性损伤
缺氧复氧处理大鼠肾小管上皮细胞 NRK-52E 3、6、12 和 24 h,和对照组相比,LDH 含量均显著升高(图 1A),IL-1β 含量均显著升高(图 1B),差异均具有统计学意义(< 0.05)。最佳致 NRK-52E 细胞损伤时间为 12 h。

图 1 缺氧复氧处理不同时间的肾小管上皮细胞 NRK-52E 的炎性损伤(A:LDH 的含量;B:IL-1β 的含量;*P < 0.05)
Figure 1 Inflammatory injury of renal tubular epithelial cells NRK-52E at different time after hypoxia reoxygenation (A: LDH content; B: IL-1β content;*< 0.05)

图 2 缺氧复氧肾小管上皮细胞中 VS-1 蛋白表达升高(*P < 0.05)
Figure 2 Increased expression of VS-1 protein in hypoxic reoxygenated renal tubular epithelial cells (*< 0.05)
2.2 缺氧复氧肾小管上皮细胞中 VS-1 高表达
运用 Western blot 检测缺氧复氧处理 12 h 的 NRK-52E 细胞中 VS-1 的蛋白表达,与对照组相比,VS-1 的蛋白表达量显著升高(图 2,< 0.05)。
2.3 构建沉默 VS-1 的慢病毒载体
如图 3 所示,与 Scrambled 慢病毒载体相比,shVS-1 慢病毒载体中 VS-1 的蛋白表达显著降低,差异具有统计学意义(< 0.05)。可见,成功构建沉默 VS-1 的慢病毒载体。
2.4 沉默 VS-1 减轻缺氧复氧对肾小管上皮细胞的炎性损伤
shVS-1 组与 Scrambled 组相比,肾小管上皮细胞中 LDH 含量显著降低(图 4A),IL-1β 含量显著降低(图 4B),差异均具有统计学意义(< 0.05)。可见,沉默 VS-1 可减轻缺氧复氧对肾小管上皮细胞的炎性损伤。
2.5 沉默 VS-1 抑制缺氧复氧肾小管上皮细胞 VS-1 蛋白表达
如图 5 所示,转染 shVS-1 组细胞与转染 Scrambled 组相比,VS-1 蛋白表达显著降低(< 0.05)。
2.6 沉默 VS-1 下调缺氧复氧肾小管上皮细胞 caspase-1
如图 6 所示,shVS-1 组细胞与 Scrambled 组相比,caspase-1 蛋白表达显著降低(< 0.05),pro-caspase-1 蛋白表达差异不显著(> 0.05)。

图 3 沉默 VS-1 对慢病毒载体中 VS-1 蛋白表达的影响(*P < 0.05)
Figure 3 Effect of silencing VS-1 on VS-1 protein expression in lentiviral vectors (*< 0.05)

图 4 沉默 VS-1 减轻缺氧复氧对肾小管上皮细胞的炎性损伤(A:对 LDH含量的影响;B:对 IL-1β 含量的影响;*P < 0.05)
Figure 4 Silencing VS-1 attenuated inflammatory injury to renal tubular epithelial cells by hypoxia reoxygenation (A: Effect on LDH content; B: Effect on IL-1β content;*< 0.05)

图 5 沉默 VS-1 抑制缺氧复氧肾小管上皮细胞 VS-1 蛋白表达(*P < 0.05)
Figure 5 Silencing VS-1 inhibited VS-1 protein expression in hypoxic reoxygenation renal tubular epithelial cells (*< 0.05)
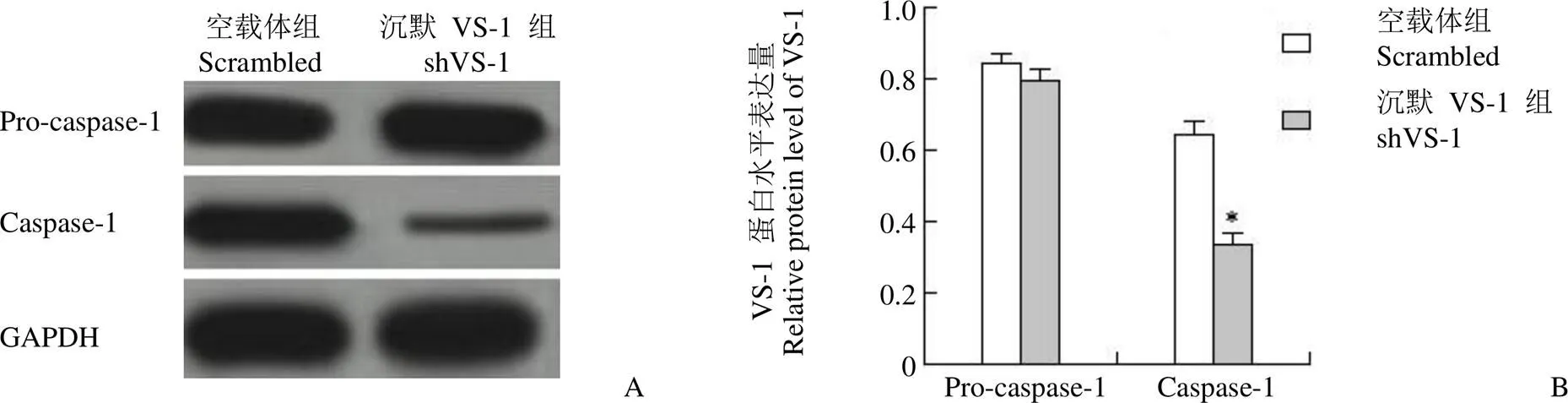
图 6 沉默 VS-1 下调缺氧复氧肾小管上皮细胞caspase-1(*P < 0.05)
Figure 6 Silencing VS-1 down-regulated caspase-1 in hypoxic reoxygenation renal tubular epithelial cells (*< 0.05)

图 7 VS-1 过表达对缺氧复氧肾小管上皮细胞损伤的影响(A:免疫印迹图;B:VS-1 蛋白相对表达量;C:对pro-caspase-1、caspase-1 蛋白表达的影响;D:对 LDH含量的影响;E:对 IL-1β含量的影响;*P < 0.05)
Figure 7 Effects of VS-1 overexpression on oxygenation of renal tubular epithelial cells (A: Immunoblot; B: Relative expression of VS-1 protein; C: Effect on pro-caspase-1, caspase-1 protein expression; D: Effect on LDH content; E: Effect on IL-1β content;*< 0.05)
2.7 VS-1 过表达对缺氧复氧肾小管上皮细胞损伤的影响
结果如图 7 所示,与 pcDNA 组相比,pcDNA-VS-1 组细胞中 VS-1 的表达水平明显升高,caspase-1 蛋白表达显著升高,LDH、IL-1β 含量均显著升高(< 0.05)。
3 讨论
Vasostatin 类多肽在心血管循环系统中起到平衡调节作用,具有保护血管系统抵抗强烈兴奋和应激刺激的作用[12]。VS-1 在心肌细胞缺血再灌注损伤中的研究非常普遍,VS-1 的复性肌力作用、抗心肌缺血再灌注损伤及抗心律失常作用已得到认可[13-14]。目前关于 VS-1 与细胞炎症因子的研究甚少。童玉娜[15]在缺氧复氧诱导的肾小管上皮细胞炎症反应的研究中阐明,缺氧复氧可上调肾小管上皮细胞中 IL-1β 和 caspase-1 表达,且成熟的 IL-1β 表达与 caspase-1 的表达相一致。本研究建立缺氧复氧肾小管上皮细胞损伤,运用 Western blot 检测 VS-1 蛋白表达发现,在缺氧复氧肾小管上皮细胞中 VS-1 高表达且可上调 LDH 和 IL-1β。这些发现表明 VS-1 的表达与肾小管上皮细胞损伤分泌的炎性因子呈剂量依赖性。
VS-1 在不同生物中的作用机制是具有种属特异性的,其对蛙和鳗鱼心脏钙/钠通道的依赖性不同[16-18]。王铮[19]在心肌缺血再灌注损伤的研究中,通过构建腺病毒重组的 VS-1 基因,并转染大鼠心肌细胞和大鼠血管内皮细胞,运用 MTT 法检测细胞活力,Annexin-V-FITC 流式细胞术检测细胞凋亡,揭示了 VS-1 在心肌细胞和血管内皮细胞中具有显著的抗缺氧复氧损伤作用。Liu 等[20]研究阐明,过表达 VS-1 可保护缺氧复氧心肌细胞-血管内皮细胞的损伤。
本研究构建慢病毒介导的沉默 VS-1 的缺氧复氧肾小管上皮细胞损伤,运用 ELISA 法检测 LDH 和 IL-1β 含量发现,沉默 VS-1 可下调 LDH 和 IL-1β,可保护缺氧复氧肾小管上皮细胞损伤,过表达 VS-1 则具有相反的作用,揭示了 VS-1 在急性肾损伤中的作用。VS-1 在缺氧复氧肾小管上皮细胞损伤中的作用与心肌缺血再灌注损伤中的作用相反。
IL-1β 是炎症反应早期产生的多潜能细胞因子,可诱导 TNFα、IL-6、IL-8 等细胞因子的产生,是引起肾小管上皮细胞炎性损伤和凋亡的重要效应分子[21]。Caspase-1 是 IL-1β 转化酶,其为哺乳动物体内剪切促炎因子 IL-1β 的特异蛋白酶,可将 pro-IL-1β 剪切为成熟的 IL-1β[22-23]。Gasman 等[24]研究运用 ELISA 法检测肠源和胰源内分泌肿瘤患者血清和正常人血清中 CgA 和 VS-1 的表达,揭示促生长抑制素治疗可上调患者血清中的 CgA 但不影响 VS-1 的表达水平,提示 VS-1 可作为肠源和胰源内分泌肿瘤的诊断标记物。Rumio 等[10]在研究慢性结肠炎时,建立 DSS 诱导的鼠急性和慢性结肠炎模型,LPS 诱导的肠黏膜上皮细胞损伤,运用 ELISA 法检测 VS-1、IL-8、CK 的含量,发现 VS-1 抑制损伤细胞分泌TNFα、干扰素 c,且在动物模型中具有保护作用,揭示 VS-1 在动物体内具有治疗作用,该机制可能与抑制肠道的渗透力,对损伤肠黏膜的修复和抑制 IL-8/KC 及其他炎性因子的产生有关。本研究在前人的基础上建立沉默 VS-1 的慢病毒介导的缺氧复氧肾小管上皮细胞损伤模型,运用 Western blot 法检测细胞中 caspase-1、pro-caspase-1 的蛋白表达,揭示沉默VS-1 可抑制缺氧复氧肾小管上皮细胞中 caspase-1的蛋白表达,提示沉默 VS-1 可抑制炎症因子的分泌。这将为 VS-1 在不同种属、不同组织中的特异性研究提供参考依据。
总之,沉默 VS-1 可保护缺氧复氧肾小管上皮细胞的炎性损伤,其可能与下调 caspase-1 有关,可作为临床治疗急性肾损伤的理论依据。
[1] Wu S, Ding XQ, Fang Y. Research development of micro RNA involving in acute kidney injury. Chin J Clin Med, 2015, (5):703-706. (in Chinese)
吴声, 丁小强, 方艺. microRNA参与急性肾损伤的研究进展. 中国临床医学, 2015, (5):703-706.
[2] Lang XB, Yang Y, Chen JH. Epidemiology of acute kidney injury in hospitalized patients in China. J Zhejiang Univ (Med Sci), 2016, 45(2): 208-213. (in Chinese)
郎夏冰, 杨毅, 陈江华. 中国住院患者急性肾损伤流行病学调查现状. 浙江大学学报(医学版), 2016, 45(2):208-213.
[3] Wang Y, Li ZH, Deng X, et al. Protective mechanism of ischemic preconditioning on apoptosis induced by kidney ischemia - reperfusion. Chin J Practi Pediatr, 2016, 31(5):354-358. (in Chinese)
王颖, 李志辉, 邓旭, 等. 缺血预处理对大鼠缺血再灌注肾损伤诱发凋亡的保护机制. 中华实用儿科临床杂志, 2016, 31(5):354-358.
[4] Wang Z, Xiao MD. Homeostatic effects of vasoslatin-1 in cardiovnscular system. Int J Cardiovasc Dis, 2008, 35(5):272-275. (in Chinese)
王铮, 萧明弟. Vasostatin-1在心血管系统的稳态调节作用. 国际心血管病杂志, 2008, 35(5):272-275.
[5] Corti A, Ferrero E. Chromogranin A and the endothelial barrier function. Curr Med Chem, 2016, 19(24):4051-4058.
[6] Wallez Y, Huber P. Endothelial adherens and tight junctions in vascular homeostasis, inflammation and angiogenesis. Biochim Biophys Acta, 2008, 1778(3):794-809.
[7] Wang Q, Zhou XY, Li B, et al. Effects of serum containing atorvastatin on TNF-α-induced human umbilical vein endothelial growth factor. Chin J Integr Med Cardio Cerebrovasc Dis, 2016, 14(18):2113-2114. (in Chinese)
王群, 周喜燕, 李彬, 等. 含阿托伐他汀大鼠血清对TNF-α损伤人脐静脉内皮细胞生长因子的影响. 中西医结合心脑血管病杂志, 2016, 14(18):2113-2114.
[8] Helle KB. Regulatory peptides from chromogranin A and secretograin II: putative modulators of cells and tissues invoved in inflammatory conditions. Regul Pept, 2010, 165(1):45-51.
[9] Chen SM. Expression of heme oxygenase-1 in peripheral blood mononuclear cells of patients with coronary heart disease. Shantou: Shantou University, 2005. (in Chinese)
陈宋明. 血红素氧化酶-1在冠心病患者外周血单个核细胞中的表达. 汕头: 汕头大学, 2005.
[10] Rumio C, Dusio GF, Colombo B, et al. The N-terminal fragment of chromogranin A, vasostatin-1 protects mice from acute or chronic colitis upon oral administration. Dig Dis Sci, 2012, 57(5):1227-1237.
[11] Veschini L, Crippa L, Dondossola E, et al. The vasostatin-1 fragment of chromogranin A preserves a quiescent phenotype in hypoxia-driven endothelial cells and regulates tumor neovascularization. FASEB J, 2011, 25(11):3906-3914.
[12] Chen CY, Bai M, Zhang Z. Development of chromogranin A in the cardiovascular area. J Clin Cardiol, 2016, 32(1):82-85. (in Chinese)
陈长源, 白明, 张钲. 嗜铬粒蛋白A衍生多肽在心血管领域研究进展. 临床心血管病杂志, 2016, 32(1):82-85.
[13] Zheng G. Prospect on the clinical application of vasostatin-1 in the diagnosis and treatment of cardiovascular disease. World Clin Med, 2013, 34(10):619-622. (in Chinese)
郑刚. 多肽vasostatin-1在心血管疾病诊治中的应用前景. 世界临床药物, 2013, 34(10):619-622.
[14] Stavrakis S, Scherlag BJ, Fan Y, et al. Antiarrhythmic effects of vasostatin-1 in a canine model of atrial fibrillation. J Cardiovasc Electrophysiol, 2012, 23(7):771-777.
[15] Tong YN. Role and mechanism of endoplasmic reticulum-derived transcription factor CHOP in inflammatory response induced by hypoxia-reoxygenation in renal tubular epithelial cells. Chongqing: Third Military Medical University, 2011. (in Chinese)
童玉娜. 内质网源性转录因子CHOP在缺氧复氧诱导肾小管上皮细胞炎症反应中的作用和机制研究. 重庆: 第三军医大学, 2011.
[16] Llach A, Huang J, Sederat F, et al. Effect of beta-adrenergic stimulation on the relationship between membrane potential, intracellular [Ca2+] and sarcoplasmic reticulum Ca2+ uptake in rainbow trout atrial myocytes. J Exp Biol, 2004, 207(Pt 8):1369-1377.
[17] Vornanen M, Shiels HA, Farrell AP, et al. Plasticity of excitation-contraction coupling in fish cardiac myocytes. Comp Biochem Physiol A Mol Integr Physiol, 2002, 132(4):827-846.
[18] Morad M, Cleemann L. Role of calcium channel in development oftension in heart muscle. J Mol Cell Cardiol, 1987, 19(6):527-553.
[19] Wang Z. Experimental study of transfection of Vasostatin-1 gene against myocardial ischemia/reperfusion injury. Shanghai: Shanghai Jiaotong University, 2009. (in Chinese)
王铮. Vasostatin-1基因转染抗心肌缺血/再灌注损伤的实验研究. 上海: 上海交通大学, 2009.
[20] Liu J, Yang D, Shi S, et al. Overexpression of vasostatin-1 protects hypoxia/reoxygenation injuries in cardiomyocytes-endothelial cells transwell co-culture system. Cell Biol Int, 2014, 38(1):26-31.
[21] Haq M, Norman J, Saba SR, et al. Role of IL-1 in renal ischemic reperfusion injury. J Am Soc Nephrol, 1998, 9(4):614-619.
[22] Saha N, Moldovan F, Tardif G, et al. Interleukin-1beta-converting enzyme/caspase-1 in human osteoarthritic tissues: localization and role in the maturation of interleukin-1beta and interleukin-18. Arthritis Rheum, 1999, 42(8):1577-1587.
[23] Li P, Allen H, Banerjee S, et al. Mice deficient in IL-1 beta-converting enzyme are defective in production of mature IL-1 beta and resistant to endotoxic shock. Cell, 1995, 80(3):401-411.
[24] Gasman S, Corsello A, Di FL, et al. Vasostatin-1: A novel circulating biomarker for ileal and pancreatic neuroendocrine neoplasms. PLoS One, 2018, 13(5):e0196858.
Effect of vasostatin-1 on inflammatory damage of hypoxic reoxygenation in renal tubular epithelial cells
GAO Bo, HU Fang-fang, GAO Yan-feng
To study the inflammatory injury mechanism of vasostatin-1 (VS-1) in renal tubular epithelial cells by hypoxic reoxygenation.
Inflammatory injury of kidney tubular epithelial cells was established by hypoxia reoxygenation. The lentiviral vector of shVS-1 was transfected into NRK-52E cells by liposome method. LDH and IL-1β levels in cells were detected by ELISA. The protein expression of VS-1, pro-caspase-1 and caspase-1 in cells were detected by Western blot.
Compared with the control group, the levels of LDH and IL-1β in the hypoxia reoxygenation group were significantly increased, and the protein expression of VS-1 was significantly increased. The lentiviral vector was successfully constructed. Transfection of silencing VS-1 lentiviral vector into NRK-52E cells with hypoxic reoxygenation could decrease LDH and IL-1β levels and downregulate caspase-1 expression, but overexpression of VS-1 possessed the opposite function.
Silencing VS-1 could protect the kidney tubular epithelial cells with hypoxic reoxygenation from inflammatory injury, which may be related to the down-regulation of caspase-1, which will provide a basis for clinical treatment of acute kidney injury.
Vasostatin-1; Hypoxia reoxygenation; Renal tubular epithelial cells; Inflammatory injury; Inflammatory factors
GAO Bo, Email: dongji991@163.com
Author Affiliation: Department of Nephrology, The People's Hospital of Anyang City, Henan 455000, China
10.3969/j.issn.1673-713X.2019.06.010
455000 河南,安阳市人民医院肾内科
高博,Email:dongji991@163.com
2019-07-05

