FAP-α与VEGF 在乳腺癌中的表达及临床意义
段佳佳,王莹
1应急总医院普外肿瘤科,北京 100028
2首都医科大学附属北京朝阳医院病理科,北京 100020
乳腺癌是女性常见的一种恶性肿瘤,据统计,2005—2014年,乳腺癌的发病率居全球女性肿瘤第1位,病死率居全球女性肿瘤第2位[1]。不同于其他实体肿瘤,乳腺癌具有异质性,因而其治疗方向逐渐从肿瘤细胞转移至肿瘤微环境。癌相关成纤维细胞(cancer associated fibroblast,CAF)是肿瘤微环境的重要组成部分,而成纤维细胞激活蛋白-α(fibroblast activation protein-α,FAP-α)是特异性表达于CAF表面的抗原分子,FAP-α具有促进微血管生成的特性,可以参与肿瘤细胞的生长、浸润和转移过程。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种促进血管内皮细胞生长的因子,具有促进血管通透性增加、细胞外基质变性和血管生成等作用。目前,关于FAP-α、VEGF与乳腺癌细胞生物学特性的关系尚未见报道。因此,本研究对乳腺癌患者乳腺癌组织中FAP-α、VEGF的表达情况及相关性进行分析,并探讨了其与乳腺癌患者临床特征的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年7月至2012年7月首都医科大学附属北京朝阳医院收治的乳腺癌患者。所有患者均经病理证实为乳腺癌,且均有详细的临床资料、手术记录,术前均未接受放疗、化疗等抗肿瘤治疗。本研究共纳入乳腺癌患者74例,患者的年龄为31~79岁,平均年龄为(51.8±11.5)岁;国际抗癌联盟(International Union Against Cancer,UICC)乳腺癌TNM分期[2]:Ⅰ期32例,ⅡA期28例,ⅡB期4例,ⅢA期10例;导管原位癌8例,浸润性导管癌60例(1级4例,2级36例,3级20例),黏液癌2例,小叶癌2例,其他2例;肿瘤直径为1.5~6.5 cm,中位肿瘤直径为2 cm;T1c期42例,T2期30例,T3期2例;有淋巴结转移18例,无淋巴结转移56例;远处转移:1例患者于术后3年发生肺转移,1例患者于术后3年发生脑转移,1例患者于术后4年发生脑转移,1例患者于术后4年发生骨转移。收集74例乳腺癌患者的乳腺癌组织标本;同时,收集同期于首都医科大学附属北京朝阳医院行手术切除的20例乳腺纤维腺瘤和乳腺增生患者的乳腺组织为正常对照,其中乳腺纤维腺瘤组织10例,乳腺增生组织10例。
1.2 免疫组化染色法检测不同组织中FAP-α、VEGF 蛋白的表达
收集乳腺癌组织标本和正常乳腺组织标本,经10%中性缓冲福尔马林固定液固定乳腺组织,常规进行乳腺组织取材、脱水、石蜡包埋制作石蜡包埋组织块,切成4 μm石蜡切片,常规载玻片捞片。兔抗人FAP-α多克隆抗体(1∶50,购自美国Vitatex公司)、兔抗人VEGF多克隆抗体(1∶100,购自武汉博士德生物工程有限公司)均应用生物素标记的二抗及二氨基联苯胺(diaminobenzidine,DAB)显色系统(购自北京中杉金桥生物技术有限公司),行链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)法染色,石蜡切片均需常规脱蜡,再经梯度乙醇脱水,而后3%H2O2室温灭活30 min,采用微波抗原修复,采用正常山羊血清封闭30 min,加入一抗4℃过夜,滴加二抗,DAB显色、脱水、透明、封片。将已知的阳性切片作为阳性对照,用磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为阴性对照。
1.3 免疫组化染色结果判定标准
免疫组化染色切片由2名高年资主治医师采用双盲方法判读。FAP-α主要表达于乳腺癌间质中成纤维细胞的细胞质及肿瘤细胞中,呈淡黄色或棕黄色颗粒。VEGF主要表达于细胞质中,呈棕黄色颗粒。参照Henry等[3]的评分系统对FAP-α和VEGF的表达情况进行半定量评价:阴性,免疫组化染色阴性或<1%的肿瘤细胞阳性;弱阳性,1%~10%的肿瘤细胞阳性;中度阳性,11%~50%的肿瘤细胞阳性;强阳性,>50%的肿瘤细胞阳性。
1.4 统计学方法
采用SPSS 13.0统计软件对数据进行分析。计量资料以均数±标准差(±s)表示;计数资料以例数表示;相关性分析采用Spearman非参数相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 FAP-α蛋白在乳腺癌组织中的表达情况
FAP-α蛋白表达于乳腺癌细胞和间质细胞的细胞质中(图1),但在正常乳腺组织的导管上皮细胞和间质细胞的细胞质中不表达。免疫组化染色结果显示,74例乳腺癌患者中,FAP-α蛋白阴性表达6例,弱阳性表达26例,中度阳性表达28例,强阳性表达14例。
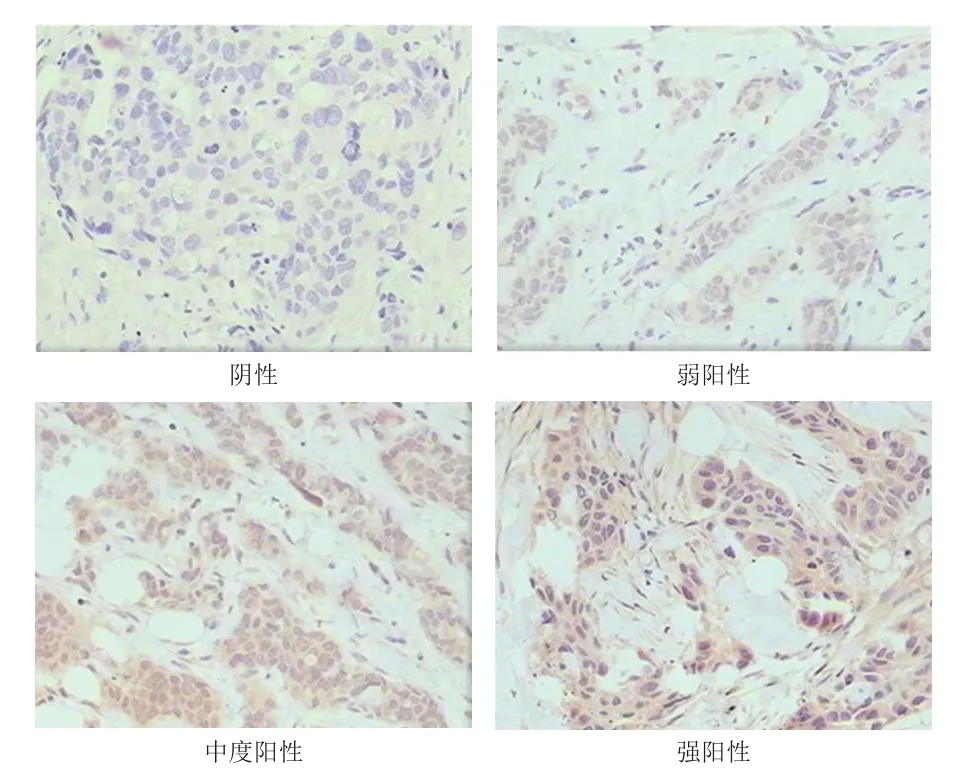
图1 乳腺癌组织中FAP-α蛋白的表达情况(免疫组化染色,×200)
2.2 VEGF 蛋白在乳腺癌组织中的表达情况
VEGF蛋白表达于乳腺癌细胞的细胞质中(图2),但在正常乳腺组织的导管上皮细胞中不表达。免疫组化染色结果显示,74例乳腺癌患者中,VEGF阴性表达8例,弱阳性表达34例,中度阳性表达20例,强阳性表达12例。
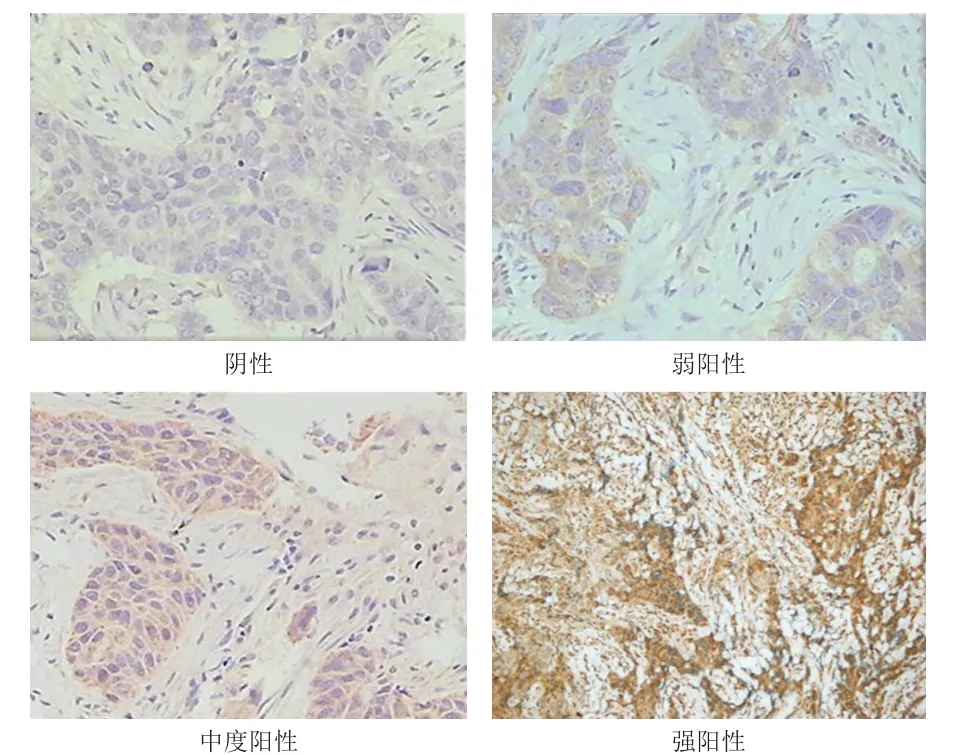
图2 乳腺癌组织中VEGF 蛋白的表达情况(免疫组化染色,×200)
2.3 乳腺癌组织中FAP-α、VEGF 蛋白表达的相关性
Spearman相关性分析结果显示,乳腺癌患者乳腺癌组织中VEGF与FAP-α的表达水平呈正相关(r=0.321,P<0.05)。
2.4 乳腺癌组织中FAP-α、VEGF 蛋白表达与乳腺癌患者临床特征的相关性
Spearman相关性分析结果显示,乳腺癌组织中VEGF蛋白的表达水平与乳腺癌患者的T分期、N分期、临床分期均呈正相关(P<0.05);乳腺癌组织中FAP-α蛋白的表达水平与乳腺癌患者的N分期、临床分期均呈正相关(P<0.05)。(表1)

表1 乳腺癌组织中FAP-α、VEGF蛋白表达与乳腺癌患者临床特征的相关性(n=74)
3 讨论
乳腺癌是女性高发肿瘤之一,且病死率居高不下。相关研究表明,早期乳腺癌患者诊断时,已有约30%的患者发生复发或转移,而6%~10%的乳腺癌患者在确诊时已发生远处转移[4]。DeSantis等[5]研究显示,超过90%的乳腺癌患者的死亡不是由原发肿瘤本身导致的,而是由肿瘤细胞远处转移导致。肿瘤细胞的增殖、浸润、转移均离不开肿瘤微环境,因此,针对乳腺癌微环境致癌机制的研究对乳腺癌的早期诊断和治疗具有重要意义。
FAP-α是由Rettig等[6]于1986年首先报道的应用单克隆抗体F19识别的一种膜抗原,属于Ⅱ型丝氨酸蛋白酶类,基因定位于2q23[7],分子量约为73 kD,具有分解明胶和Ⅰ型胶原的活性以及类似二肽基肽酶的活性;其可以降解细胞外基质,参与生物活性肽和趋化因子的裂解,从而使肿瘤细胞脱离原来的位置,导致肿瘤细胞的侵袭、转移[6]。已有研究显示,FAP-α具有胶原酶活性,可以促进肿瘤细胞的侵袭[8-11]。当实体肿瘤(包括上皮来源的恶性肿瘤)的直径大于1~2 mm时,需要通过微环境的基质形成获取肿瘤细胞存活和生长所必须的营养物质;而活化的成纤维细胞是这种起支持营养作用的基质成分所必需的。FAP-α是增生性成纤维细胞的表面标志物,可能参与调控成纤维细胞的生长、胚胎发育、组织修复及恶性肿瘤的发生、发展、浸润和转移过程,是肿瘤微环境中重要的活性产物之一。
本研究结果显示,FAP-α表达于乳腺癌细胞和间质细胞的细胞质中,但在正常乳腺组织的导管上皮细胞和间质细胞的细胞质中不表达。Park等[12]和Shi等[13]研究均显示,FAP-α无论在肿瘤细胞还是在间质细胞中均可以表达。Liu等[14]研究显示,FAP-α在肿瘤细胞中的表达水平高于间质细胞。由于FAP-α可以同时表达于乳腺癌细胞和间质细胞的细胞质中,因而针对FAP-α的靶向治疗也可以同时作用于肿瘤基质的间质细胞和肿瘤细胞,该方法既可以抑制肿瘤细胞赖以生存的间质,又可以直接杀伤肿瘤细胞。本研究进一步分析显示:乳腺癌组织中FAP-α蛋白的表达水平与乳腺癌患者的N分期呈正相关(P<0.05)。Liu等[14]研究显示,FAP-α表达水平与肿瘤患者的预后及淋巴结转移呈正相关。Koperek等[15]研究结果显示,在甲状腺髓样癌中,FAP-α的表达水平与淋巴结转移呈正相关,提示其可能是甲状腺髓样癌患者预后的相关因子,该研究结果与本文研究结果相似。还有研究表明,FAP-α高表达与胰腺癌患者预后差有关[13,16],且FAP-αmRNA是非小细胞肺癌患者预后的独立影响因素[17]。另外,研究还发现,FAP-α在女性乳腺癌的发生、发展中具有重要作用,可以作为乳腺癌预后的重要预测因子[18]。本研究结果显示,乳腺癌组织中FAP-α蛋白的表达水平与乳腺癌患者的临床分期呈正相关(P<0.05),提示临床可以通过检测FAP-α的表达情况,对部分高风险、预后差的乳腺癌患者进行筛选,进而尽早采取有效的预防及治疗措施。
相关研究表明,FAP-α可能参与了肿瘤微血管的生成[19-20]。Cao 等[20]研究结果显示,FAP-α可以激活细胞外基质中的VEGF。Patsouras等[21]应用共聚焦激光扫描显微镜和常规免疫组化法对胰腺癌中FAP-α和VEGF的表达情况进行分析,结果显示FAP-α较VEGF可以更好地预测胰腺癌患者的预后情况。Li等[22]通过免疫组化法检测了110例Ⅰ~Ⅲ期乳腺癌患者中VEGF的表达情况,结果显示VEGF表达水平与乳腺癌患者的肿瘤直径、临床分期和淋巴结转移均呈正相关,提示VEGF与乳腺癌患者的疾病进展和不良预后有关。Goussia等[23]研究发现,VEGF高表达提示乳腺癌患者预后不良。本研究结果还显示,乳腺癌患者乳腺癌组织中VEGF与FAP-α的表达水平呈正相关(P<0.05),乳腺癌组织中VEGF蛋白的表达水平与T分期、N分期及临床分期均呈正相关(P<0.05)。提示VEGF的表达水平越高,肿瘤微环境中血管生成活性越高,新血管生成越多,越有利于肿瘤细胞的生长、浸润和转移。
综上所述,乳腺癌组织中FAP-α蛋白与VEGF蛋白的表达呈正相关,且这两种蛋白与乳腺癌患者的N分期及临床分期均呈正相关,可能参与了乳腺癌的发生发展过程。深入探究FAP-α、VEGF在乳腺癌发生发展过程中的作用机制,可为临床调控机体的抗肿瘤免疫应答及建立有效的治疗策略提供新思路。

