耐热蛋白酶产生菌的筛选鉴定及其酶学性质研究
桑 鹏, 王肇衿, 陈贵元, 杨力权
(1.大理大学农学与生物科学学院,云南大理671003;2.大理大学基础医学院,云南大理671000;3.云南省昆虫生物医药研发重点实验室,云南大理671000)
蛋白酶在科学研究和工业生产等方面应用广泛(唐兵等,2000),其主要产自微生物,但在高温、强酸、强碱、多金属离子等条件下酶的催化活性并不好,常有失活情况发生(林影等,2000)。 高温蛋白酶的应用前景十分广阔(廉立慧等,2011),但国内对高温蛋白酶产生菌的研究相对较晚, 对高温蛋白酶催化活性方面的研究还鲜有报道。 本研究以云南大理弥渡县热泉土样为材料, 筛选出产高温蛋白酶的菌株, 对其分类鉴定并对其酶学性质进行研究, 旨在为发酵工业新备选产蛋白酶菌株的开发应用提供资源, 为进一步开发利用该菌株提供基础, 也为进一步获得产蛋白酶基因的研究奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 土壤样品 土壤样品来自大理弥渡县白总旗热泉的底泥,热泉水温55 ℃。
1.1.2 主要仪器 显微镜(奥林巴斯);紫外可见光分光光度计(上海菁华仪器公司);高速冷冻离心机(上海安亭科学仪器公司);恒温培养箱(上海一恒科学仪器有限公司);水浴恒温摇床(常州国华电器有限公司);高压蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司);超净工作台(苏州净化设备有限公司);PCR 扩增仪(美国ABI);电泳仪(北京六一生物科技有限公司)。
1.1.3 试剂 酵母抽提物、蛋白胨为英国进口;琼脂粉为西班牙进口分装;脱脂奶粉、三氯乙酸、folin试剂、浓盐酸、干酪素、氯化钠、结晶紫、碘、乙醇、孔雀绿、番红等均为国产分析纯试剂。DNA 抽提试剂盒、PCR 扩增试剂盒、 胶回收试剂盒和DNA 分子量标准品均购自北京天根生物技术有限公司。
1.1.4 培养基 脱脂奶粉培养基:脱脂奶粉50 g,水500 mL,琼脂粉10 g,100 ℃灭菌20 min。
LB 液体培养基:胰蛋白胨10 g,酵母浸出物5 g,NaCl 10 g, 超纯水1000 mL, 调pH 至7.2,121 ℃灭菌20 min。
发酵产酶培养基:豆粕20 g,葡萄糖1 g,蒸馏水200 mL,121 ℃灭菌20 min。
1.2 试验方法
1.2.1 菌株富集 称取白总旗热泉底泥2 g 于45 mL 的无菌蒸馏水中,150 r/min,振荡15 min。在无菌条件下, 用移液枪吸取5 mL 悬液于50 mL 的富集培养基中,将接种好的富集培养基置于55 ℃,转速为150 r/min 的水浴恒温振荡培养箱中振荡培养24 h。
1.2.2 菌株初筛 将富集好的菌液稀释至10-3、10-6、10-9倍, 用移液枪分别吸取稀释的菌液150 μL接种在筛选培养基平板上,涂布均匀。 于37 ℃倒置培养24 h。 观察菌落周围若有水解圈出现,说明该菌株能产生蛋白酶。
1.2.3 菌株复筛 将初筛得到的菌株取少量接种于种子瓶(LB 液体培养基),55 ℃培养24 h 后,将种子液按2%的接种量接入到发酵培养基,55 ℃、150 r/min 水浴摇床培养一周。 离心取上清测酶活。
酶活测定:采用福林法(Folin)进行酶活测定(高英等,2004)。 在一定的pH 和温度下,蛋白酶液和底物酪蛋白反应,经一定时间后,加入三氯乙酸终止酶反应, 并使多余的酪蛋白发生沉淀而与水解产物分开。 过滤后,取滤液(含蛋白水解产物的三氯乙酸液)用Na2CO3碱化,再加入Folin 试剂使之发色, 蓝色强度与蛋白质水解产物的量成正比, 在一定浓度范围内符合朗白-比尔定律,因此,可推测蛋白酶活性。
酶活力定义:在酶最适反应温度条件下,每分钟水解酪蛋白产生1 μg 酪氨酸为一个酶活单位。
酶活力/(μg/mL)= K×OD×N×4/10;
式中:K 为标准曲线斜率的倒数;N 为酶的稀释倍数。
1.2.4 菌株鉴定
1.2.4.1 形态学、 生理生化特征 产酶菌株的形态观察及生理生化实验参照黄秀梨等(2008)的方法进行。
1.2.4.2 16S rRNA 基因序列测序和分析 根据北京天根生化科技有限公司提供的试剂盒以及说明书进行DNA 的提取。 使用通用引物27F:5,-AGAGTTTGATCCTGGCTCAG-3, 和1492R:5,-GGTTACCTTGTTACGACTT-3, 扩增细菌16S rD NA。扩增条件为:预变性94 ℃,5 min;变性94 ℃,30 s;退火50 ℃,45 s;延伸72 ℃,100 s,最后延伸72 ℃,5 min,循环30 次,将PCR 产物加入预先制备好的0.8%的琼脂糖凝胶中,140V,电泳1 h,琼脂糖凝胶回收根据北京天根生化科技有限公司提供的试剂盒以及说明书进行PCR 产物回收。 将PCR 回收产物送广州英潍捷基(上海)贸易有限公司测序,将获得的序列提交GenBank (http: / /www. ncbi. nlm. nih. gov), 根据BLAST 数据库中细菌16S rRNA 基因序列进行相似性比较分析,利用MEGA 5.0 软件进行系统进化分析。
1.2.5 菌株最适生长温度 按接种量为1%的菌种于LB 液体培养基中,置于不同的温度(25、31、37、43、49、55 ℃) 下摇床培养24 h, 然后在波长600 nm 处测定各个温度下菌株生长的吸光值,以确定菌株的最适生长温度。
1.2.6 酶学性质
1.2.6.1 温度对酶活的影响 将酶液分别在4 ~75 ℃条件下测定蛋白酶的活力。
1.2.6.2 pH 对酶活的影响 在最适酶活温度下,配制不同pH 的反应缓冲液,检测不同的pH 对蛋白酶活力的影响。
1.2.6.3 酶的热稳定性 将1 mL 酶液分别置于不同的温度(4、37、55、60、75 ℃)下保温,在保温15、30、60、90 min 时测定酶活。以保温0 min 温度下所测得的酶活为对照组, 其余温度下所测得的酶活与其相比,并计算相对酶活,用相对酶活绘制出酶的热稳定性曲线。
1.2.6.4 金属离子对酶活的影响 将1 mL 的酶液和10 μL 浓度为0.1 mol/L 的金属离子(Ca2+、Fe2+、Mn2+、Cu2+、Zn2+、Mg2+、K+)混匀,将其放置到4 ℃冰箱过夜,第二天测定各组酶活力。以未加入金属离子的酶液反应体系作为对照组, 测定和观察金属离子对酶活力的影响。
2 结果与分析
2.1 产酶菌株的筛选 根据水解圈直径与菌落直径比值的大小。筛选到3 株产高温蛋白酶菌株。其中1 号菌株水解圈直径与菌落直径比值(R1/R2)最大。 经复筛发现3 株菌均为分泌型蛋白酶产生菌,且1 号菌株酶活最高,为49.99 U/mL,与初筛的结果相符。因此,选择1 号菌株作为后续试验研究菌株,命名为Pro-55。
2.2 菌种鉴定
2.2.1 形态学、 生理生化特征 Pro-55 在LB 培养基上37 ℃培养72 h 后, 菌落形态呈圆形,黄色,不透明,黏稠,光滑,表面湿润,中间隆起,边缘整齐, 菌落整体较小未产菌丝。 革兰氏染色呈阳性,端生芽孢,鞭毛染色后未观察到鞭毛。
对Pro-55 的生理生化特性进行研究发现,V-P 试验、甲基红试验、蔗糖发酵试验结果均为弱阳性。明胶试验、吲哚试验、乳糖发酵试验、葡萄糖发酵试验结果均为阴性。
2.2.2 16S rRNA 基因序列及系统发育分析 16S rRNA 基因测序, 所获得的序列长度为1438 bp,将Pro-55 的16S rRNA 基因序列与GenBank 数据库中的序列进行同源性比对,发现Pro-55 与短芽孢杆菌属的16S rRNA 基因序列自然聚类,Pro-55 的16S rRNA 基因序列与16 条相似性较高的序列构建系统发育树见图1, 从图中可以看出 Pro -55 与 Brevibacillus sp. FJAT -21992(KP728965.1)菌株聚为一群,相似性也最高,表明Pro-55 与Brevibacillus sp.的菌株亲缘关系最近。
根据Pro-55 的形态及生理生化特征, 结合《伯杰氏细菌鉴定手册》(第八版)(布坎南,1984),以及Pro-55 16S rRNA 基因序列及系统发育树,将Pro-55 初步鉴定为短芽孢杆菌属(Brevibacillus sp.) 的一株菌, 命名为Brevibacillus sp.Pro-55。
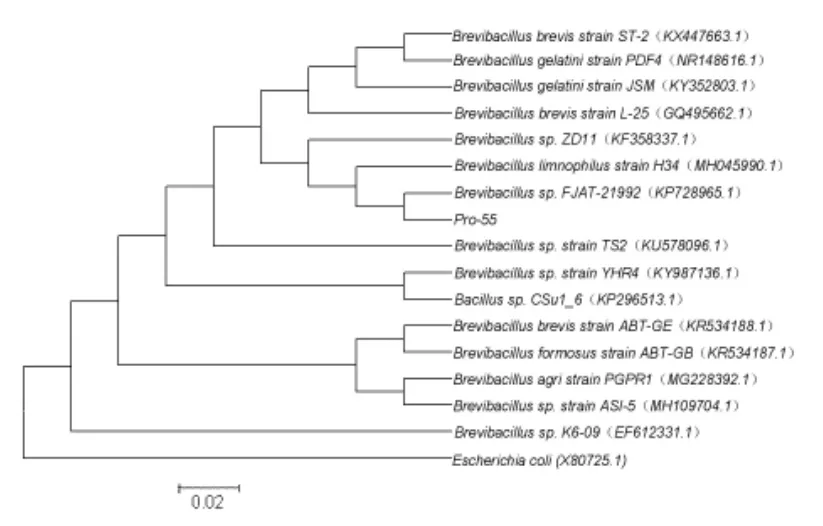
图1 基于16S rRNA 基因序列相似性的菌株Pro-55 与16 株细菌的系统进化树
2.3 菌种的最适生长温度 按照试验方法,在波长600 nm 处测定不同温度培养下LB 培养基的吸光值,以600 nm 处的吸光值为纵坐标,温度为横坐标作温度—吸光值关系曲线,结果如图2。
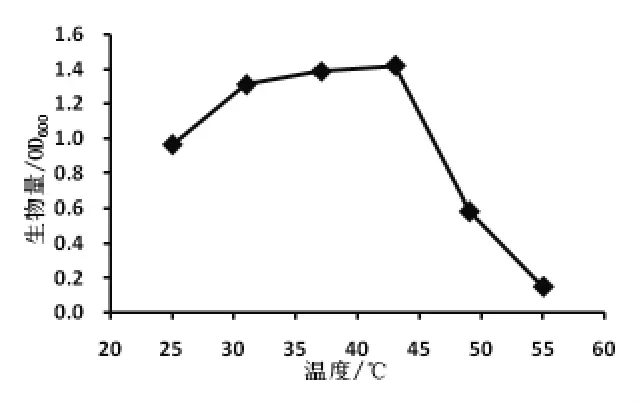
图2 Pro-55 菌株生长曲线
从图2 可知,25 ~43 ℃菌株的生长量随着温度的升高而增加,43 ℃时,LB 培养基在600 nm下的吸光值最高,表明43 ℃是菌株的最适生长温度。 45 ℃以后,菌株生长量随着温度的升高而下降,菌株在55 ℃下仍能生长,表明菌株属于典型的耐高温菌。
2.4 菌株Pro-55 的蛋白酶性质
2.4.1 对硝基苯酚标准曲线 根据制作对硝基苯酚标准曲线的方法, 得出对硝基苯酚标准曲线线性回归方程为y=0.6743x-0.0634, 线性相关系数R2=0.9924,表明线性比较好。
2.4.2 温度对酶活的影响 按照试验方法, 在不同温度下测定酶的活性,以酶活力为纵坐标,温度为横坐标作温度—酶活关系曲线(图3)。
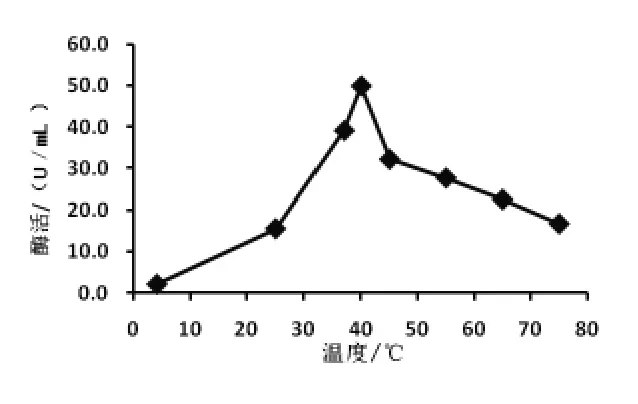
图3 温度对Pro-55 蛋白酶活性的影响
从图3 可以看出,低温能抑制酶的活性,但不能使酶失活, 在4 ℃的条件下, 蛋白酶仍具有活性,但活性较低,4 ~40 ℃,随着温度升高,酶活力增加,在40 ℃时,酶活力达到最大值,为50 U/mL。在40 ℃之后,随着温度升高,蛋白酶活力反而降低,部分酶失去活性。 40 ℃是蛋白酶的最适反应温度,该菌株产生的蛋白酶属于典型的耐热蛋白酶。
2.4.3 蛋白酶的最适反应pH 从图4 可以看出,pH 6.0 之前,蛋白酶活力随着pH 的增加而升高,在pH 6.0 之后, 蛋白酶活力下降速度较快。 pH 6.0 是该蛋白酶的最适反应pH,表明菌株Pro-55产生的蛋白酶属于酸性蛋白酶。
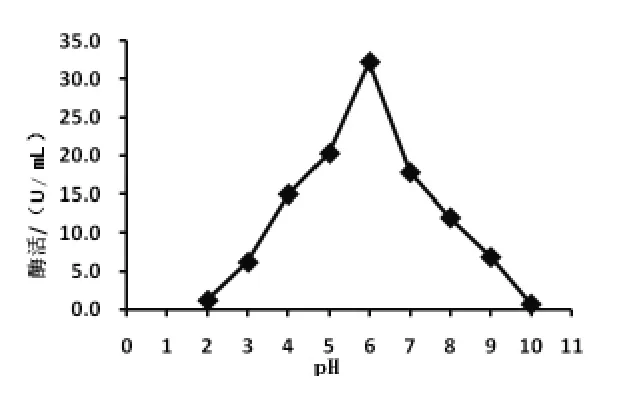
图4 pH 对Pro-55 蛋白酶活性的影响
2.4.4 蛋白酶热稳定性 按照试验方法, 测定其各个温度下不同时间点蛋白酶的酶活,以保温0 min测得的酶活为对照组, 其余温度下所测得的酶活与其相比并计算相对酶活, 用相对酶活绘制出酶的热稳定性曲线,结果如图5 所示。
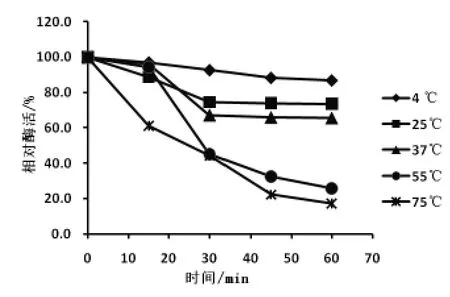
图5 Pro-55 蛋白酶的热稳定性
从图5 可以看出,在37 ℃以下,Pro-55 蛋白酶能够在长时间内保持相对稳定的酶活。在75 ℃保温60 min,相对酶活损失近83%。 菌株产生的酶虽然是高温蛋白酶,但酶在较高的温度下,酶活性随着保温的时间增加而降低, 酶的热稳定性较差,温度耐受性质符合一般酶的性质。
2.4.5 金属离子对酶活力的影响 将加有金属离子的稀释酶液在4 ℃中保温过夜, 以未加入金属离子的酶液作为对照组, 测定各种金属离子对酶活力的影响,结果见表1。

表1 金属离子对Pro-55 蛋白酶活的影响%
从表1 可知,Cu2+对酶活性有较大促进作用,Mg2+、Ca2+有较弱促进效果,而Fe2+、K+和Mn2+则有抑制效果,推断可能不是单一的酶类,有辅酶;说明酶液有较强的离子耐受能力。
3 结论
高温蛋白酶是一类广泛应用于医药、食品、日用化工等方面且有着巨大开发潜力的酶, 在微生物体内广泛存在 (徐辉艳等,2009; 胡青平等,2005)。 本次试验得到的菌株经分子鉴定为短芽孢杆菌;其最适生长温度为43 ℃,酶反应最适温度40 ℃,酶反应最适pH 为6.0,在最适反应温度下酶活力为36.74 μg/mL; 在37 ℃以下酶具有较好的热稳定性。 Ca2+、Zn+、Mg2+、Cu2+等离子对酶液的酶活性均有促进作用, 同时酶液具有很强的离子耐受力。本文所筛选菌株在55 ℃高温下依然具有较强的酶活力,且温度耐受性较强。 综上所述,此次试验得到的酶在重金属高温环境下的应用前景非常广阔, 且在其他的科研与工业生产中的应用也有待研究。

