番茄外泌体的分离提取工艺优化及其作为药物载体的可行性分析*
吴菊萍,肖倩,王建国,王莺
(南方医科大学基础医学院 肿瘤研究所,广东 广州 510515)
外泌体是一种可参与细胞间信号传导的细胞外囊泡[1-3],具有脂质双分子层结构,可作为药物载体应用于疾病研究[4]。目前研究多集中于动物细胞来源的外泌体[5]。然而其提取工艺复杂,成本高,收率低;同时含有与供体细胞一致的脂质、核酸及蛋白等[6],应用过程存在安全性问题[7]。相比较植物来源的外泌体,其生物相容性和安全性更为可靠[8-9]。本研究从番茄中提取外泌体,对提取工艺进行摸索和优化,旨在开发植物来源的外泌体作为药物载体。
1 材料与方法
1.1 材料
市售番茄,MTT、OptiPrep 购于美国Sigma 公司,DiI 荧光染液购于上海碧云天生物公司,BCA 蛋白含量检测试剂盒购于江苏南京凯基生物,FAM 标记及未标记反义EBV-miR-BART7-3p 由上海吉玛制药公司合成,DOTAP ∶DOPE(阳离子脂质体)购于美国Avanti 公司,miRNA 逆转录试剂盒购于大连宝生生物技术有限公司,实时荧光定量聚合酶链反应试剂盒和探针购于日本TaKaRa 公司,动态光散射仪购于英国马尔文公司,Avanti J-26XP 低温高速离心机购于美国BECKMAN 公司,Hitachi CP100WX 低温超高速离心机购于日本日立公司,TOPCONDS 150 透射电镜、正置荧光显微镜购于日本尼康公司,电穿孔仪购于美国BIO-RAD 公司,Agilent Technologies Mx3005P 荧光定量聚合酶链反应仪购于美国安捷伦科技有限公司。
1.2 方法
1.2.1 细胞培养 人肺腺癌A549 细胞、人鼻咽癌HONE1(EBV+)细胞用含10%胎牛血清RPMI 1640培养基,人卵巢癌A2780 细胞用含10%胎牛血清DMEM 培养基,常规置于37℃、含5%二氧化碳CO2饱和湿度的培养箱中培养[10]。A549、A2780 细胞来源于南方医科大学基础医学院肿瘤研究所,HONE1(EBV+)细胞来源于香港大学。
1.2.2 外泌体提取分离工艺及其优化 番茄人工去皮,榨取的新鲜番茄汁放入低温高速离心机,4 000 r/min 离心20 min,去除大的残渣;9 000 r/min 离心1 h,去除细小植物碎片,留存上清。上清11 000 r/min离心1.5 h,收集沉淀,并用磷酸盐缓冲液(phosphate buffer saline,PBS)重悬。应用蔗糖密度梯度离心法继续分离纯化[11]。配制8%、30%、45%及60%质量分数的蔗糖溶液,在离心管中依次加入不同浓度蔗糖溶液,最后缓慢加入重悬液于8%蔗糖溶液[12-14]。36 000 r/min 离心1.5 h,合并收取上2 层条带并加水稀释,再进行离心除掉蔗糖,用PBS 重悬沉淀。鉴于第一步粗提过程外泌体损耗较多,对工艺适当优化:番茄汁25 000 r/min 离心1 h,收集沉淀,用PBS 重悬;浓缩后应用相同工艺,进行蔗糖密度梯度离心,收集目的条带,冻干称重。
1.2.3 外泌体纯化及表征 应用薄膜水化法进一步提取外泌体脂质成分,具体步骤:涡旋混匀外泌体,加入体积比为2 ∶1 的甲醇-氯仿混合液,混匀后加入等量氯仿混匀,最后加入与氯仿等体积去离子水后混匀,于4 000 r/min 离心10 min 分为有机相和水相,收集有机相、悬干,形成脂质薄膜;加入适量去离子水,浸泡过夜,超声水浴10 min,即得到脂质纯化后外泌体[15-17]。采用BCA 蛋白含量检测试剂盒测定外泌体蛋白浓度进行定量。应用动态光散射(dynamic light scattering,DLS)仪和透射电子显微镜(transmission electron microscope,TEM)检测薄膜水化法前后外泌体的粒径、电位及形貌等。
1.2.4 外泌体MTT 细胞毒性实验 应用蛋白含量检测试剂盒测定外泌体蛋白浓度并对其进行定量,分别用不同浓度的外泌体作用于A549、A2780 及HONE1(EBV+)细胞24 h,检测其细胞毒性作用。将细胞按2 000 个/孔铺于96 孔板,待细胞贴壁后加入浓度分别为1、2、3 及4μg/ml 的外泌体,共培养24 h 后,加入20μl 四甲基偶氮唑盐5 mg/ml,37℃孵育4 h,加入150μl 二甲基亚砜,混匀后,酶标仪测定490 nm处各孔光密度(optical density,OD)值,计算不同浓度条件下细胞活度值,绘制抑制曲线。
1.2.5 外泌体负载模型药物和目的基因 在2μg/ml 外泌体氯仿溶液中加入适量DiI 模型药物,混匀后旋干,加入去离子水,浸泡过夜,超声水浴10 min,即形成负载模型药物DiI 的外泌体。薄膜水化法纯化2μg/ml 外泌体,形成脂质薄膜层后,加入电转液浸泡过夜,超声水浴,加FAM 标记的或无标记的反义EBV-miRBART7-3p[18-19](10μl,20μmol/L),在400 V、125μF条件下进行电穿孔,于冰上孵育30 min,形成负载FAM标记反义EBV-miR-BART7-3p 的纳米基因药物[20-27]。 应用紫外分光光度法,分别建立DiI 在549 nm 和FAM 标记的反义EBV-miR-BART7-3p 在490 nm 处的浓度-吸光度值标准曲线,测定相应的OD 值确定外泌体负载模型药物和目的基因浓度,经检测纳米药物分别含有0.2μg/ml DiI 和0.1μmol/L 目的基因。
1.2.6 纳米药物的细胞摄取实验 以游离DiI 为对照,将负载DiI 的纳米药物分别与A549 和A2780 细胞共孵育4 h;按照其说明书制备DOTAP ∶DOPE 脂质液,按质量比1 ∶10 DNA 和脂质体配比,加入与10μl(20μmol/L)目的基因相应的脂质体量,混匀后制备DOTAP ∶DOPE 携带目的基因药物,将负载FAM 标记的反义EBV-miR-BART7-3p 纳米基因药物与HONE1(EBV+)共孵育4 h,4%多聚甲醛分别固定细胞,Hoechst 33342 染核,在荧光显微镜下观察不同细胞对纳米药物的摄取情况。
1.2.7 基因沉默实验 取对数生长期HONE1(EBV+)细胞接种于6 孔板中,待细胞贴壁,分别由外泌体和DOTAP ∶DOPE 负载反义EBV-miR-BART7-3p 瞬时转染细胞,PBS 洗细胞3 次后,分别加入不同基因药物与Opt-mem 培基,混匀,转染48 h 后裂解细胞,提取总RNA,用探针法荧光定量聚合酶链式反应检测不同载体组基因沉默效果。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均 数±标准差(±s)表示,比较用单因素方差分析,进一 步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 番茄外泌体性能表征
蔗糖密度梯度离心后有3 层条带,合并收集上层和中层产物,冻干后称重,得番茄外泌体为1.31 g/kg。DLS 仪测定结果表明,纯化前外泌体平均粒径经薄膜水化法纯化后,粒径变小。TEM 结果表明,外泌体呈典型的圆形或椭圆形杯状脂质双分子层结构,且纯化后粒子形状更加均一。见表1和图1~3。
表1 外泌体纯化前后性能表征 (±s)

表1 外泌体纯化前后性能表征 (±s)
时间 粒径/nm 分散系数 电位/mV纯化前 153.447±3.456 0.347±0.051 0.052±0.033纯化后 130.893±0.737 0.375±0.004 -0.307±0.346

图1 蔗糖密度梯度法分离后外泌体条带
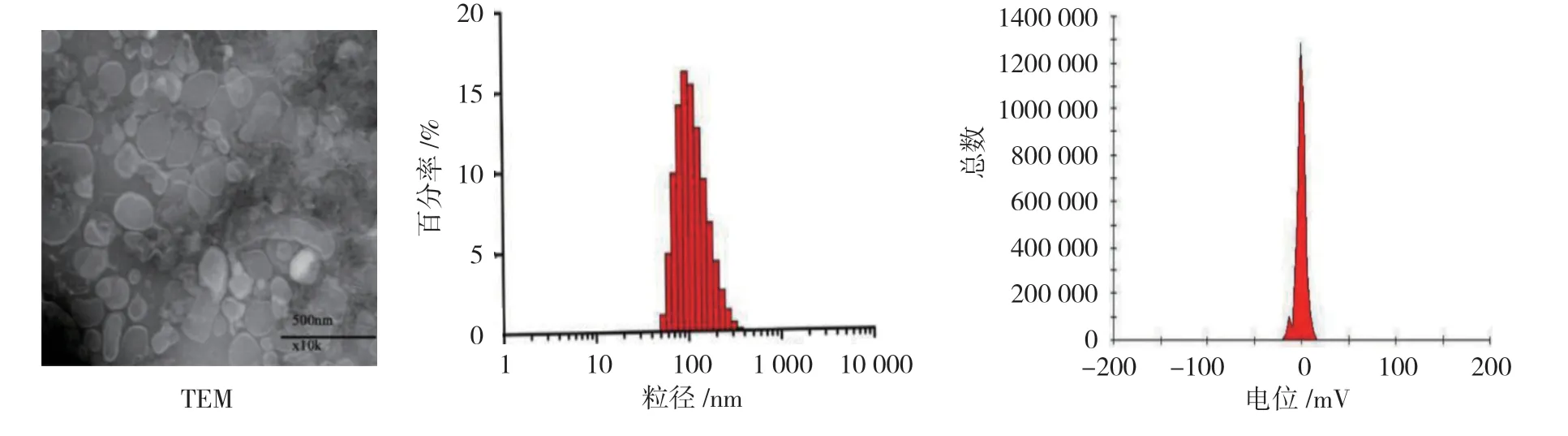
图2 纯化前外泌体性能表征

图3 纯化后外泌体性能表征
2.2 细胞毒性
MTT 法结果表明,细胞存活率≥100%。说明外泌体未表现出细胞毒性,外泌体具有良好的生物相容性。见图4。
2.3 细胞对纳米药物的摄取
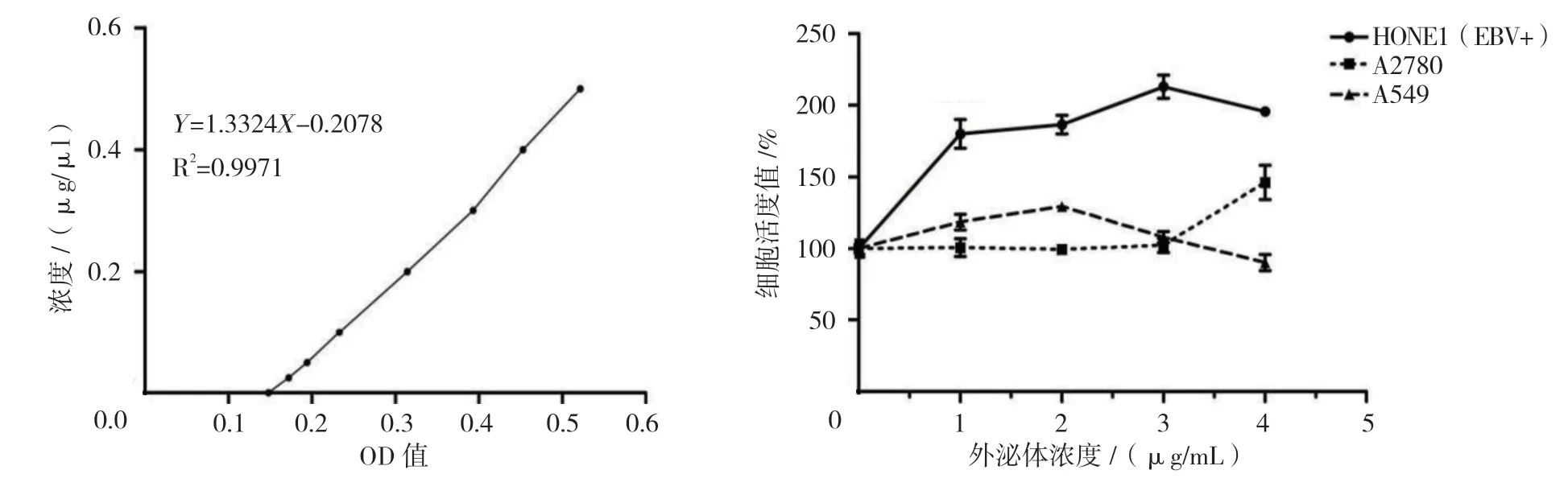
图4 BCA 定量标准曲线与外泌体细胞毒性实验
以外泌体为载体分别包裹脂溶性模型药物DiI 和FAM 标记的反义EBV-miR-BART7-3p,用游离DiI和DOTAP ∶DOPE 负载的目的基因作为对照组,考察其进入细胞的情况。外泌体携带模型药物DiI 在A549 细胞和A2780 细胞的摄取情况表明,与游离DiI 相比,外泌体能成功携带模型药物进入细胞。与DOTAP ∶DOPE 比较,外泌体携带的目的基因效果更好,说明外泌体是一种合适的基因载体,且无论是携带模型药物还是目的基因,所制备的纳米药物均分布在细胞的胞浆。见图5。
2.4 基因沉默实验
应用阳离子脂质体DOTAP ∶DOPE 包裹目的基因作为对照,考察外泌体携带目的基因的基因沉默效果。基因沉默结果显示,各组目的基因相对表达量以正常对照组结果为1,DOTAP ∶DOPE 组与外泌体组的基因相对表达量分别为(0.643±0.110)和(0.343±0.062)。3 组目的基因相对表达量比较,经单因素方差分析,差异有统计学意义(F=179.100,P=0.000),进一步两两比较经LSD-t检验,DOTAP ∶DOPE 组与正常对照组比较,差异有统计学意义(t=7.837,P=0.000);DOTAP ∶DOPE 组低于正常对照组。外泌体组与正常对照组比较,差异有统计学意义(t=20.430,P=0.000);外泌体组低于正常对照组。外泌体组与DOTAP ∶DOPE组比较,差异有统计学意义(t=7.631,P=0.000),外泌体组低于DOTAP ∶DOPE 组。相对于正常对照组,外泌体组和阳离子脂质体组均能较好地沉默EBV-miRBART7-3p,且外泌体组瞬转效率好于DOTAP ∶DOPE组。可见,番茄外泌体可经过电穿孔方法成功将基因导入细胞中,并影响其目的基因的表达。见图6。


图5 细胞对模型药物和基因药物的摄取 (×40)

图6 3 组目的基因相对表达量比较 (±s)
3 讨论
常用的合成类纳米载体,如纳米球、纳米囊、脂质体及胶束等因其具备小尺寸效应、表面效应,在体内能进行长效循环、可连接特异靶向分子等优势,已广泛用于各种药物的实验性或临床性递送。虽然这些合成类纳米载体有较好的效果,但因对组织机体存在安全性低、生物相容性差及需要大规模合成等缺陷,限制其临床应用前景。因此,目前亟待开发更具安全性、良好生物相容性的新型纳米载体。
外泌体可作为细胞间载体,携带生物分子在细胞间相互传递、交流信息等;另外,纳米尺寸的外泌体也可作为载体携带药物应用于各种疾病的研究,具有广阔的应用潜力。本研究从天然可食用植物番茄中提取外泌体,对提取工艺进行摸索和优化,旨在开发植物来源外泌体作为纳米级药物载体应用于各类疾病的治疗。
现有的外泌体分离方法主要包括多步差速离心、蔗糖密度梯度离心、试剂盒沉淀及免疫磁珠分选等。其中,试剂外泌体表面由类似于细胞膜的脂质双分子层组成,具有一定的疏水性,因此用外泌体提取试剂盒捆绑水分子,通过常规离心方法收集沉淀获取外泌体。这种快速提取外泌体的方法虽然简便快捷、样本需求少及对设备要求低,但其分离的沉淀成分复杂,可能掺杂一些未知的疏水大分子物质,获得的外泌体纯度并不高。相比较应用多步差速离心和蔗糖密度梯度离心提取外泌体,成本更加低廉且可增加收率,特别是两者结合的方法能进一步提高外泌体纯度。本文应用多步差速离心和蔗糖密度梯度离心法从食用植物番茄提取外泌体并进一步优化工艺,减少粗提过程中外泌体的损耗,从而提高收率至1.31 g/kg。
本研究得到的外泌体相比较传统纳米载体系统,生物相容性好、利用度高且安全无毒,并能成功携带模型药物和目的基因进一步应用于各种疾病的药物递送系统研究。笔者初步进行以外泌体为载体携带模型药物和目的基因,制备纳米药物,并考察不同细胞对以外泌体为载体的纳米药物摄取情况的研究,结果显示不同细胞对所制备的纳米药物均有良好的摄取能力,说明外泌体作为药物载体可行。
综上所述,相比较模型药物,外泌体携带目的基因进入细胞的能力更好,更加适宜作为基因载体,且以外泌体为载体的基因沉默效果优于常用阳离子脂质体DOTAP ∶DOPE。本研究仅开展体外细胞水平的考察,仍需体内实验进一步验证。

