氧化锡量子点的合成及对抗坏血酸的灵敏传感研究
曾慧慧,肖梅珍,晏根平,刘 芳,黄 检,陈 林,施卫国
(1. 萍乡学院 江西省工业陶瓷重点实验室,江西 萍乡 337055; 2. 萍乡学院 材料与化学工程学院,江西 萍乡 337055)
1 引 言
SnO2材料是一种典型的n型半导体,其禁带宽度为3.6 eV,属于四方晶系金红石结构。由于具有耐腐蚀性强、稳定性好、工作温度低等特性以及优良的光电性能,SnO2在催化、光电器件、电池材料、气体传感器等领域得到了广泛的应用[1-3]。到目前为止,已有很多关于SnO2纳米材料的报道。例如,Chiu等用水热法合成了高比表面积(约130 m2/g)的SnO2纳米材料,并将其应用于乙醇的检测[4];Song等报道了多孔SnO2中空纳米球对丙酮和2-氯乙醇良好的气敏特性[5];Kumar等发现SnO2/Au复合结构纳米材料可显著提高甲烷的检测灵敏度[6]。当SnO2纳米材料的粒径减小到1~10 nm之后,得到的氧化锡量子点由于体积小,比表面积大,在光、电、磁等领域表现出一些独特的理化性质,因而受到众多学者的青睐[7-8]。目前,报道最多的是利用氧化锡量子点的光电性能对气体进行检测,以及SnO2量子点在太阳能电池中的应用研究。例如,Chen等[9]利用放电等离子体烧结技术合成SnO2量子点玻璃。Song等[10]通过溶剂热法旋涂成膜并与无机配体结合制备了量子点气敏薄膜。Zhang等[11]通过把SnO2量子点作为阳极材料应用于量子点敏化光伏电池。总之,SnO2量子点由于其优异的光电性质,具有广阔的应用前景,其在生物探针技术中的潜力也被广泛认可。
抗坏血酸(AA)是人体必需的维生素,对维持人体正常生理机能起着至关重要的作用,是生命体中重要的抗氧化剂、辅酶因子及神经传递素相关酶的组成成分[12-13]。因此,建立方便、快速、准确的抗坏血酸含量检测的方法具有积极的意义。目前抗坏血酸的常用检测方法有电化学方法[14]、高效液相色谱法[15]和荧光分析法[16-17]等。与其他方法相比,荧光光谱法由于方便、快捷、操作简单、对样品没有破坏性而受到研究者们的青睐。到目前为止,一系列荧光探针已被开发作为抗坏血酸检测的传感平台。Yan等[18]报道了碲化镉量子点荧光探针,用于检测抗坏血酸的含量。Tang等[19]利用羟基氧化钴修饰的上转换纳米颗粒用于细胞内和活体中抗坏血酸检测和成像。Mao等[20]以MnO2为猝灭剂,猝灭7-羟基香豆素的荧光,再利用抗坏血酸将MnO2还原,使7-羟基香豆素的荧光恢复,构建一种“off-on”型荧光探针,用于抗坏血酸的定量检测。Yao等[21]以海藻酸钠和色氨酸为原料制备了一种含氮碳量子点(N-CNPs),利用抗坏血酸和N-CNPs表面官能团之间的空间效应和氢键作用,实现了AA的灵敏检测。然而,以上报道的纳米材料往往存在含毒重金属元素、或光漂白现象严重、或量子产率较低等不足。同时,材料的生物兼容性也限制其进一步用于临床检测。因此,寻找新的性能优异的荧光探针具有重要意义。
本文使用水热法合成了一种性能优异的SnO2量子点,在“正三”价Fe3+存在时,SnO2量子点的荧光被猝灭,利用抗坏血酸的还原性,Fe3+还原成Fe2+,材料荧光恢复,当AA浓度为500 μmol·L-1时,SnO2量子点荧光恢复率达到95.88%。基于此,我们构建了一种氧化锡量子点荧光探针来检测抗坏血酸,并将其应用于实际血清样中AA的检测。
2 实 验
2.1 药品和仪器
L-赖氨酸(Lys)、L-缬氨酸(Val)、L-精氨酸(Arg)、L-半胱氨酸(Lys)等试剂购自天津市光复精细化工研究所,其他药品有:多巴胺(DA)、尿酸(UA)、谷胱甘肽(GSH)、硝酸铁(分析纯)、Tris-HCl(国药集团化学有限公司)、抗坏血酸(AA)(天津市光复科技发展有限公司)、氢氧化钾(中国医药集团上海化学试剂公司),所有药品直接使用。实验主要使用的仪器设备有:布鲁克TENSOR27,紫外可见分光光度计,FL-4600荧光分光光度计,超声仪,Malvern Zetasizer Nano ZS90。
2.2 SnO2的合成
SnO2的合成采用参照文献并加以改进的方法[7]。具体的合成过程如下:往烧杯中加入35 mL的去离子水,在快速搅拌的条件下加入0.15 g SnCl2·2H2O,待形成均匀的混合物后,加入70 μL 30%的H2O2,反应一段时间后,缓慢加入2.5 mL的10 mol·L-1KOH溶液,溶液继续搅拌30 min后,放入容量为50 mL的不锈钢反应釜中,180 ℃加热12 h。
2.3 Fe3+的荧光猝灭
将20 μL SnO2量子点原材料、10 μL Tris-HCl(50 mmol·L-1,pH=7.4)缓冲液,10 μL Fe3+(10 mmol·L-1)加入到超纯水中,保持总体积为400 μL,放置20 min,检测荧光。
2.4 抗坏血酸的检测
将20 μL氧化锡量子点原材料、10 μL Tris-HCl(50 mmol·L-1,pH=7.4)缓冲液、10 μL Fe3+(10 mmol·L-1)和不同浓度的抗坏血酸加入到超纯水中,保持测试体积400 μL,放置20 min,检测荧光。
2.5 人血清中抗坏血酸的检测
将20 μL氧化锡量子点原材料、10 μL Tris-HCl(50 mmol·L-1,pH=7.4)缓冲液、10 μL Fe3+(10 mmol·L-1)、10 μL 1%人血清溶液和不同浓度的抗坏血酸加入到超纯水中,保持测试体积400 μL,放置20 min,检测荧光。
3 结果与讨论
3.1 物相结构
如图1(a)所示,合成的SnO2量子点为典型的四方金红石结构,其3个主要衍射峰(110)、(101)、(211)均与JCPDS卡片No.14-1445基本一致,且3个衍射峰峰值较高,说明SnO2的结晶性良好[22]。另外,在XRD谱中没有观察到Sn及其氧化物的杂峰,说明合成的SnO2量子点纯度较高。根据谢乐公式[23]D=Kλ/βcosθ,其中K为谢乐常数,λ为入射X射线波长,β为衍射峰半高宽,θ为衍射角,可以计算出SnO2量子点的平均粒径大概为4.25 nm左右,这一结果与粒径测试结果保持一致(图1(b))。如图1(b)所示,合成的SnO2量子点粒径分布呈现良好的正态分布,其粒径主要集中在5 nm左右。内插图为SnO2量子点的透射电子显微镜扫描图(TEM),从图中可以看出,SnO2量子点粒径分布均匀且尺寸大小为4~5 nm左右。以上表征结果证明了SnO2量子点已成功合成。

图1 SnO2量子点的XRD图(a)和粒径分布图(b)(内插图为SnO2TEM图)
3.2 光学性能
由图2(a)可知,在310 nm波长光激发下,SnO2量子点的最强发射波长位于15 nm左右(红线),这主要是由材料中氧空缺作为发光过程的激发中心而引起[24]。以415 nm光为监测波长,材料的最大激发峰在310 nm处,内插图显示合成的量子点水溶液在日光灯下为一种透明的液体(左),用365 nm紫外灯照射,样品呈现蓝绿光发射(右)。此外,我们对量子点的合成条件进行了优化,从图2(b)中可以看出,随着碱浓度的升高,合成的SnO2量子点荧光强度逐渐增大,当KOH的浓度达到25 mmol时,荧光强度最大。对于水热反应来说,反应温度也是一个影响材料光学性能的重要因素,从图2(c)中可以看出,水热温度为180 ℃时,合成的量子点的荧光最强。反应时间的优化结果显示(图2(d)),反应12 h可以获得最优的荧光性能。
对材料的稳定性考查结果如图3所示。SnO2量子点在不同NaCl盐浓度溶液中的荧光数据表明材料对高盐浓度有较强的稳定性,而pH测试实验结果证明这种量子点在强碱溶液中,荧光会有一定程度的降低,这主要是跟SnO2两性偏酸氧化物性质有关;而在中性或弱碱性环境中,量子点的荧光强度减弱小于10%,因此,量子点在弱碱性条件下的应用几乎不会受到影响。
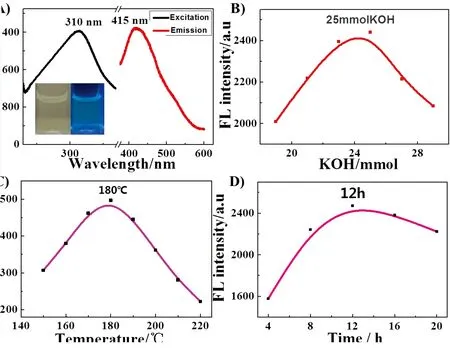
图2 (a)SnO2量子点的荧光光谱,λex=310 nm,插图为量子点水溶液在日光灯(左)与365 nm紫外灯(右)照射下的照片;KOH浓度(b)、温度(c)与反应时间(d)对合成SnO2量子点在415 nm的荧光强度的优化结果。
Fig.2 (a) Fluorescence spectra of SnO2quantum dots,λex=310 nm. Inset shows the photograph of SnO2under daylight(left) and a 365 nm UV lamp(right), respectively. The optimization of the concentration of KOH(b), temperature(c) and time(d) to synthesize SnO2with the fluorescence intensity of SnO2quantum dots at 415 nm as signal.
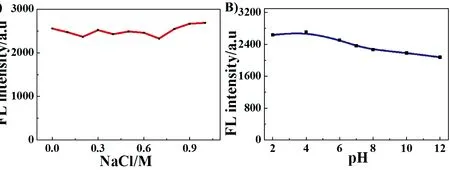
图3 不同浓度NaCl溶液(a)和pH溶液(b)中SnO2量子点的荧光强度
Fig.3 Studies on effect of salt concentration(a) and pH(b) upon SnO2quantum dots with the fluorescence intensity of SnO2quantum dots at 415 nm as signal
3.3 SnO2量子点对AA的检测原理及实验条件优化
如图4(a)所示,在Fe3+存在时,SnO2量子点的荧光被猝灭,加入AA后,材料的荧光峰强度可恢复,且AA浓度越高,荧光恢复越明显,当抗坏血酸浓度为500 μmol·L-1,材料的荧光恢复率可达95.88%(图4(a)红线)。图4(b)显示了不同Fe3+浓度时,SnO2量子点的荧光光谱,材料的荧光随着Fe3+浓度增大而逐渐减小,当Fe3+浓度为250 μmol·L-1时(图4(b)),材料的荧光猝灭率达到50%,继续增大Fe3+浓度,材料的荧光保持不变。在50 nmol·L-1~250 μmol·L-1浓度范围内,Fe3+浓度和材料的荧光强度猝灭率呈线性关系(图4(b)内插图),通过计算,其最低检测限为32 nmol·L-1。Fe3+猝灭材料荧光的机理通常被认为是材料受到激发后,电子从基态跃迁到激发态,当体系中存在过渡金属离子时,由于过渡金属离子具有空d轨道,材料激发态的电子进入了金属离子的空d轨道,从而使材料的荧光猝灭,这就是电子转移猝灭机理[25-26]。另外,我们对不同浓度Fe3+存在时SnO2量子点的光散射进行了分析,如图4(c)所示,随着Fe3+浓度的增大,材料的光散射强度逐渐减小,也就是说材料的尺寸在减小,这可能是由于原来分散的SnO2量子点在Fe3+的作用下发生了团聚,导致相互之间的距离减小[27]。为了证实这种推测,我们对SnO2量子点在加入Fe3+前后的Zeta电位进行了测试,实验结果发现,在加入Fe3+之后,材料的Zeta电位有少量的降低,结合光散射实验结果,我们认为,Fe3+引起的材料轻微团聚导致了Zeta电位的降低(图4(d))。而Fe3+猝灭SnO2量子点荧光,可能是由Fe3+诱导的材料团聚引起,这种由于材料团聚而导致的荧光猝灭现象通常被称为聚集诱导猝灭[28]。材料聚集诱导荧光猝灭现象已经被很多课题组发现并报道,例如,Chen等报道了一种石墨烯量子点的合成并用于Fe3+的检测研究,文章指出Fe3+引起了石墨烯量子点的团聚,并使其荧光发生猝灭[28];本课题组也报道了一种稀土铕掺杂纳米材料Y(V0.2P0.8O4)∶Eu3+,在Cr3+存在时,Y(V0.2P0.8O4)∶Eu3+发生显著的团聚,其荧光发生猝灭[27]。Zhang等则认为Fe3+猝灭石墨烯的荧光是通过电子转移机制实现的,但是包括Fe2+在内的其他金属离子,由于弱的吸电子能力并不能猝灭其荧光[29]。众所周知,Fe3+的外层电子结构为4s23d5,而Fe2+的外层电子结构为4s23d6,Fe2+的外围d轨道3个全满,因此,三价铁离子比二价铁离子具有更高的标准还原电势,也更容易捕获电子,从而更容易发生电子转移,猝灭荧光。因此,我们推断,在本实验中,Fe3+和Fe2+对SnO2量子点荧光的猝灭差异可能是由于它们不同的吸电子能力引起。基于这种差异,利用AA的还原性,将Fe3+还原成Fe2+,我们构建一个SnO2基“off-on”荧光探针用于AA的灵敏检测。
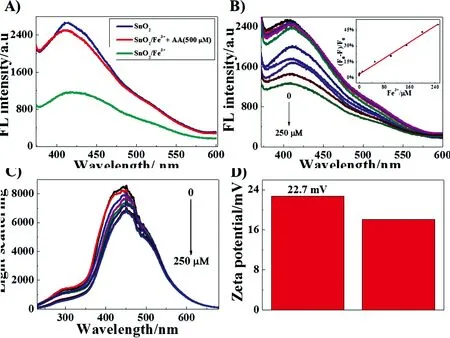
图4 (a)Fe3+和AA存在时,SnO2荧光光谱;(b)不同Fe3+浓度下SnO2荧光光谱;(c)不同Fe3+浓度下SnO2动态光散射图;(d)加入Fe3+前后SnO2Zeta电位。
Fig.4 (a) FL spectra of SnO2in the presence of Fe3+and Fe3+/AA. (b) FL spectra of SnO2in the presence of varying concentrations of Fe3+from 0 to 250 μmol·L-1. Inset shows the plot of (F0-F)/F0against the concentrations of Fe3+ranging from 0 to 10 μmol·L-1(whereF0andFare the FL intensities of SnO2at 415 nm before and after added Fe3+,respectively). (c) LS spectra of SnO2in the presence of Fe3+with different concentration. (d) ζ-potentials of SnO2before and after added Fe3+.
为了更好地实现AA灵敏传感,我们对反应时间和SnO2量子点浓度进行了优化。如图5所示,我们考查了不同浓度AA存在时反应所需的时间,从图中可以看出,随着时间的变化,SnO2量子点在415 nm处的荧光峰强度逐渐增大,反应时间为20 min左右,荧光强度基本不变,即使是AA浓度低至5 μmol·L-1,反应20 min后,材料荧光强度也可达到最大(图5(a))。对SnO2量子点浓度的优化结果如图5(b)所示,Fe3+浓度一定时(250 μmol·L-1),材料浓度减小,其荧光强度比值F/F0逐渐增大(F0为空白样荧光强度),当浓度为1 mmol·L-1时,F/F0不再变化,所以本实验中,我们将反应时间确定为20 min,SnO2量子点浓度确定为1 mmol·L-1。
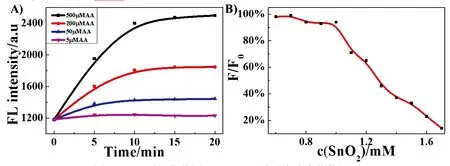
图5 (a)时间优化图;(b)SnO2量子点浓度优化图。
Fig.5 Reaction time study(a) and optimal SnO2concentration for AA detection(b) with the fluorescence intensity of SnO2quantum dots at 415 nm
在最优的实验条件下,我们对AA进行了线性检测(图6)。在SnO2/Fe3+体系中加入不同浓度AA(从下到上AA浓度依次为:0,0.05,0.1,0.5,1,10,50,100,200,500 μmol·L-1),随着AA浓度增大,SnO2在415 nm处的荧光峰强度逐渐恢复,且在0.05~500 μmol·L-1浓度范围内,AA浓度与SnO2荧光峰强度呈现一个良好的线性关系(图6内插图)。根据线性方程,我们可以计算出AA的最低检测限为0.27 μmol·L-1。我们将本方法与其他检测AA的方法做了对比(表1),从表中可以看出,该方法与其他方法相比具有较高的灵敏度。

图6 (a)不同浓度AA时,SnO2荧光光谱,内插图为AA浓度与SnO2荧光恢复率的线性关系;(b)SnO2对AA检测的选择性,各种干扰物的浓度保持为250 μmol·L-1。
Fig.6 (a) FL spectra of SnO2in the presence varying concentrations of AA from 0 to 500 μmol·L-1. Inset shows the plot of (F-F0)/(F′-F0) against the concentrations of Fe3+ranging from 0 to 10 μmol·L-1(whereF,F0andF′are the FL intensities of SnO2,SnO2/Fe3+and SnO2/Fe3+/AA at 415 nm, respectively). (d) Fluorescence intensity of SnO2at 415 nm in the presence of different biomolecules. The concentration of all biomolecules is 250 μmol·L-1.
此外,为了考查SnO2荧光探针对AA检测的实用性,我们对人血清样中的AA进行了检测,实验结果如表2所示。在不同血清样品中加入不同浓度AA,根据所得线性方程可以计算得到AA浓度,实验结果发现AA回收率在96.0%以上,这证明SnO2荧光探针可以很好地应用于实际血清样中AA的检测。为了验证SnO2量子点检测AA的准确性,我们用2,4-硝基苯丙胺方法对实验中4个血清样品中的抗坏血酸含量进行了检测[35]。

表1 检测AA的方法对比

表2 实际血清样品中AA检测结果
人血清稀释100倍。
实验结果如表2中所示,用2,4-硝基苯丙胺方法检测得到的血清样中AA的浓度与使用SnO2量子点作为荧光探针检测的AA浓度结果基本一致,这进一步证明了SnO2荧光探针的实用性。
4 结 论
本文合成了一种氧化锡量子点,在310 nm波长光激发下,其最强发射峰位于415 nm,且表现出良好的光学稳定性。Fe3+可有效猝灭SnO2量子点的荧光,利用抗坏血酸的还原性,Fe3+还原成Fe2+,猝灭的SnO2量子点荧光,在AA浓度范围为0.05~ 700 μmol·L-1时,AA浓度与SnO2荧光峰强度呈现一个良好的线性关系,其最低检测限为0.27 μmol·L-1。基于此,本文构建了一种‘off-on’荧光探针用于抗坏血酸灵敏检测。此外,我们对这种SnO2量子点荧光探针在实际血清样品中的抗坏血酸进行了加标回收实验,结果显示,SnO2材料有望成为一种实用型的AA传感器。

