酸、镉胁迫对金丝草种子萌发、幼苗生长及亚显微结构的影响
赵雅曼,陈顺钰,李宗勋,李启艳,侯晓龙,2,3*,蔡丽平,2,3
(1.福建农林大学林学院,福建 福州 350002;2.海峡两岸红壤区水土保持协同创新中心,福建 福州 350002;3.南方红壤区水土保持国家林业和草原局重点实验室,福建 福州 350002)
土壤酸化和重金属污染是社会和人民群众关注的主要环境问题之一,而一些金属矿开采废弃地土壤酸化和重金属污染往往同时存在[1-4]。不论土壤酸化还是重金属污染均会导致土壤结构变差、肥力降低,影响作物、林木等植物的生长发育,甚至导致其枯萎、死亡,同时也严重威胁到人类的身体健康,因此,土壤酸化和重金属污染的治理成为当前亟须解决的重大课题[5]。植物修复不仅可以快速增加植被覆盖,而且可以改良土壤,减少土壤污染,相比物理化学治理方法具有生态环保、经济实用等优点,受到人们的普遍青睐[6]。
植物修复的前提是富集和耐性植物的筛选,在此方面国内外学者做了大量研究,筛选出了不少适合酸性土壤或重金属污染废弃地应用的植物[7-9]。金丝草(Pogonatherumcrinitum)是从铅锌(Pb,Zn)矿区筛选出的一种Pb超富集植物,可以在土壤Pb含量小于20000 mg·kg-1的环境中正常生长,对Pb有强的耐性和富集能力[10]。金丝草为多年生草本植物,具有耐贫瘠、生长速度快、分布范围广等特点,在土壤Pb污染植物修复上有广泛的应用前景[11]。
种子萌发是植物生长的初始阶段,也是最关键和最脆弱的环节,容易受到病害、机械损伤和环境胁迫的影响,是进行抗逆性研究的重要时期之一[12]。低Pb浓度(50 mg·L-1)对金丝草种子萌发有一定促进作用,Pb胁迫对金丝草根长和芽长无显著影响[13]。金丝草生长的铅锌矿区土壤除了铅污染严重外,同时还存在土壤酸化和镉污染的问题[14],但是,金丝草是否对酸和镉胁迫具有一些特殊的响应策略尚不清楚。
鉴于此,以超富集植物金丝草种子为试验材料,设计不同pH(5.5、4.5、3.5)和Cd2+浓度(5、10、20 mg·L-1)的胁迫试验,在人工气候培养箱中开展金丝草种子对酸和镉胁迫的响应研究,测定不同酸和镉胁迫条件下金丝草种子萌发、幼苗生长、生物量、质膜完整性和细胞超微结构等指标,揭示金丝草种子萌发对酸和镉胁迫的响应,分析金丝草幼苗生长、生物量分配、质膜变化、细胞结构对酸和镉胁迫的响应策略,以期为植物修复复合土壤污染技术提供更多的科学依据。
1 材料与方法
1.1 试验设计
试验所用金丝草种子于2017年夏采自福建尤溪铅锌矿区的金丝草植株,种子采集后存于4 ℃冰箱。将采集的金丝草种子置于0.3%的高锰酸钾溶液中,室温条件下浸泡30 min后用纯水冲洗数遍,然后置于纯水中浸泡24 h。试验中酸和Cd胁迫溶液分别采用分析纯试剂CH3COOH和Cd(CH3CO2)2配制,试验处理分别为pH 5.5、4.5、3.5和Cd 5、10、20 mg·L-1,同时采用pH值为6.1的纯水作为对照。2018年1月在LT-ACC400人工气候箱中进行种子萌发试验,培养条件为温度25 ℃,空气湿度75%,光照强度10000 Lx,昼/夜光照时间为(14/10) h·d-1[15]。试验采用培养皿滤纸法进行,在9 cm培养皿中铺放两层滤纸并加入5 mL相应处理的胁迫液,选取50粒长势饱满、均一的种子于每个培养皿中,每个处理3个重复。试验期间每48 h更换一次滤纸和胁迫液以保证胁迫环境的稳定,以胚根突破种皮1 mm为发芽标志,每24 h统计一次发芽数,以连续5 d萌发数一致为种子发芽结束的标志。试验第4天统计发芽势,第13 天统计发芽率。
1.2 测定指标
1.2.1种子萌发指标测定[15]
发芽率=(萌发种子数/种子总数)×100%
发芽势=(发芽高峰期发芽的种子数/种子总数)×100%
发芽指数(germination index,GI)=∑(Gt/Dt)
活力指数(vigor index,VI)=GI×g
式中:Gt为在t时间内萌发数;Dt为相应的萌发天数;g为芽长度+根长度。
1.2.2胚根长、胚芽长和生物量的测定 萌发结束后,每盘选取20株长势相似的幼苗,参考鲁如坤[16]的方法测量其胚根长、胚芽长。并快速测量胚根和胚芽的鲜重,然后在105 ℃杀青30 min,80 ℃烘干至恒重后称量其干重。
1.2.3萌发抑制指数[15]
抑制指数(restrain index,RI)=(对照指标值-处理指标值)/对照指标值
当RI<0,酸、Cd胁迫对种子萌发和幼苗生长起促进作用;当RI>0,酸、Cd胁迫对种子萌发和幼苗生长起抑制作用;当RI=0,酸、Cd胁迫对种子萌发和幼苗生长无明显作用。
1.2.4测定质膜完整性和细胞相对活性 采用Evans blue染色的方法检测金丝草幼苗根尖质膜完整性[17]。从各处理组中分别取长度为2 cm左右的金丝草幼苗根尖,在4 ℃冷处理pH 4.5的 0.5 mmol·L-1CaCl2溶液中浸泡5 min后纯水洗净吸干,在4 mL 伊文思蓝溶液(0.025% 伊文思蓝溶于pH 5.6 的100 μmol·L-1CaCl2溶液中)中浸泡30 min,洗净吸干后在纯水中浸泡15 min,在LEICA M205 FA全电动荧光立体显微镜下观察拍照。
利用Image-J软件对根尖照片进行处理,细胞相对活性计算公式如下[18]:
V=A/At×100%
式中:V为细胞相对活性,A为根尖非染色区域面积,At为全根尖面积。
1.2.5胚芽超显微结构的测定 发芽试验结束后,在各处理组中各选取长势相似的3株幼苗,用4 ℃预冷的PBS(pH 7.4)溶液清洗1~2次,去除残留的杂质,然后将样品放入1 mL 2.5% 戊二醛溶液(用PBS配制)中,充分浸没组织,在 4 ℃固定过夜后立即用干冰保存,送于上海秉新生物科技有限公司使用透射电子显微镜(Tecnai G2 Spirit)对金丝草胚芽组织进行检测,并采用能谱仪(EDS)对胚芽组织选定区域(图中红色圆圈区域)进行扫描,对重金属含量进行定性分析。
1.3 数据处理
采用Microsoft Excel 2013和SPSS 19.0对数据进行统计分析,使用单因素方差分析(One-way ANOVA)和Duncan’s法在0.05水平上对数据进行多重比较分析,图表中数据以平均值±标准差表示,并用Origin 8.5作图。
采用隶属函数法对不同处理下的金丝草种子萌发和幼苗生长指标进行综合评价[19],计算公式如下:如指标与抗逆性呈正相关时:
指标与抗逆性呈负相关时,则用反隶属函数计算:
综合隶属函数值:

2 结果与分析
2.1 酸、镉胁迫对金丝草种子萌发指标的影响
由表1可知,酸胁迫下金丝草种子的各萌发指标均随pH的减小呈现先增后减的趋势,但不同酸胁迫处理金丝草种子的发芽率均与对照无显著差异(P>0.05);pH 5.5处理金丝草种子的发芽势与对照无显著差异(P>0.05),但发芽指数和活力指数均显著大于对照(P<0.05);pH 3.5处理,金丝草种子的发芽势、发芽指数和活力指数均显著小于对照(P<0.05);随Cd胁迫浓度的增大,金丝草种子的活力指数呈减小趋势,且不同处理均显著小于对照(P<0.05);Cd 5处理下金丝草种子发芽率、发芽势和发芽指数均与对照无显著差异(P>0.05),Cd 20处理下各萌发指标则均显著小于对照(P<0.05)。
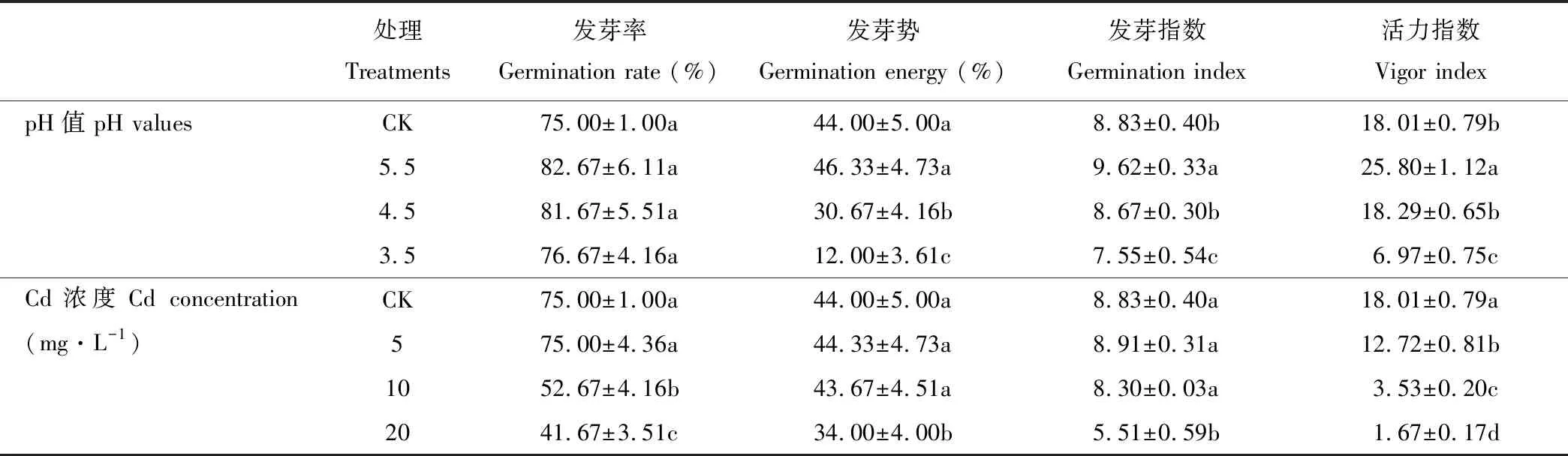
表1 不同酸、镉胁迫下金丝草种子的萌发指标
注:同列不同小写字母表示不同处理间差异显著(P<0.05)。
Note: The different lowercase letters in the same column indicate significant differences among different treatments atP<0.05 levels.
2.2 酸、镉胁迫对金丝草幼苗胚根长、胚芽长和根冠比的影响
由图1可知,pH 5.5和4.5处理金丝草幼苗的胚根长和根冠比均与对照无显著差异(P>0.05),pH 5.5处理显著大于pH 4.5处理(P<0.05),pH 3.5处理的金丝草幼苗的胚根长和根冠比均显著小于对照(P<0.05);酸胁迫对金丝草幼苗胚芽长无显著影响(P>0.05);随着Cd浓度的增大,金丝草幼苗胚根长、胚芽长和根冠比均呈减小趋势,不同Cd胁迫处理金丝草幼苗的胚根长、根冠比均显著小于对照(P<0.05),Cd 5处理的胚芽长与对照无显著差异(P>0.05)。
2.3 酸、镉胁迫对金丝草幼苗生物量的影响
由图2可知,酸胁迫下金丝草幼苗胚根鲜重呈减小趋势,且不同处理均显著小于对照(P<0.05);pH 4.5处理下金丝草幼苗的胚芽鲜重显著小于对照(P<0.05),其他处理则与对照无显著差异(P>0.05);pH 3.5处理金丝草幼苗胚根干重显著小于对照(P<0.05),胚芽干重则与对照无显著差异(P>0.05),但显著大于其他酸胁迫处理(P<0.05)。说明pH 3.5处理会抑制胚根干重,但会促进胚芽干重增加。 Cd胁迫条件下,金丝草幼苗的胚根重量呈减小趋势,Cd 5处理下胚根鲜重、干重均显著小于对照(P<0.05),胚芽鲜重、干重呈先增后减趋势,Cd 5处理下均显著大于对照(P<0.05);Cd 5处理下金丝草幼苗根系生物量受到抑制,但胚芽生物量则被促进;Cd 10和20处理下金丝草幼苗胚根和胚芽的生物量均显著小于对照(P<0.05)。
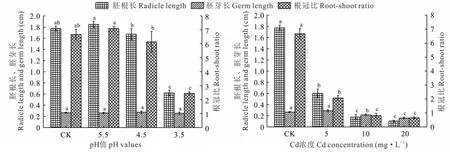
图1 不同酸、镉胁迫下金丝草幼苗胚根长、胚芽长和根冠比

图2 不同酸、镉胁迫下金丝草幼苗胚根和胚芽鲜重、干重
2.4 酸、镉胁迫对金丝草萌发指标和生长指标的抑制作用分析
由表2可知,酸胁迫可提高金丝草种子的发芽率,其中pH 5.5处理作用最明显;pH 5.5处理对金丝草的各萌发指标均为促进作用,而pH 3.5处理则对除发芽率外的其他萌发指标均有抑制作用;除了pH 5.5处理的胚根长、pH 4.5处理的胚芽长和pH 3.5处理的胚芽干重外,金丝草各生长指标均受到抑制作用,其中,胚根干重随pH值的减小受到的抑制作用逐渐增加,而胚芽干重则相反。
随着Cd浓度的增加,金丝草种子萌发指标和幼苗生长指标受到的抑制作用均逐渐增强,Cd 5处理对金丝草的发芽势、发芽指数、胚芽长、胚芽鲜重和胚芽干重具有一定促进作用,其他处理各指标均表现出抑制作用。
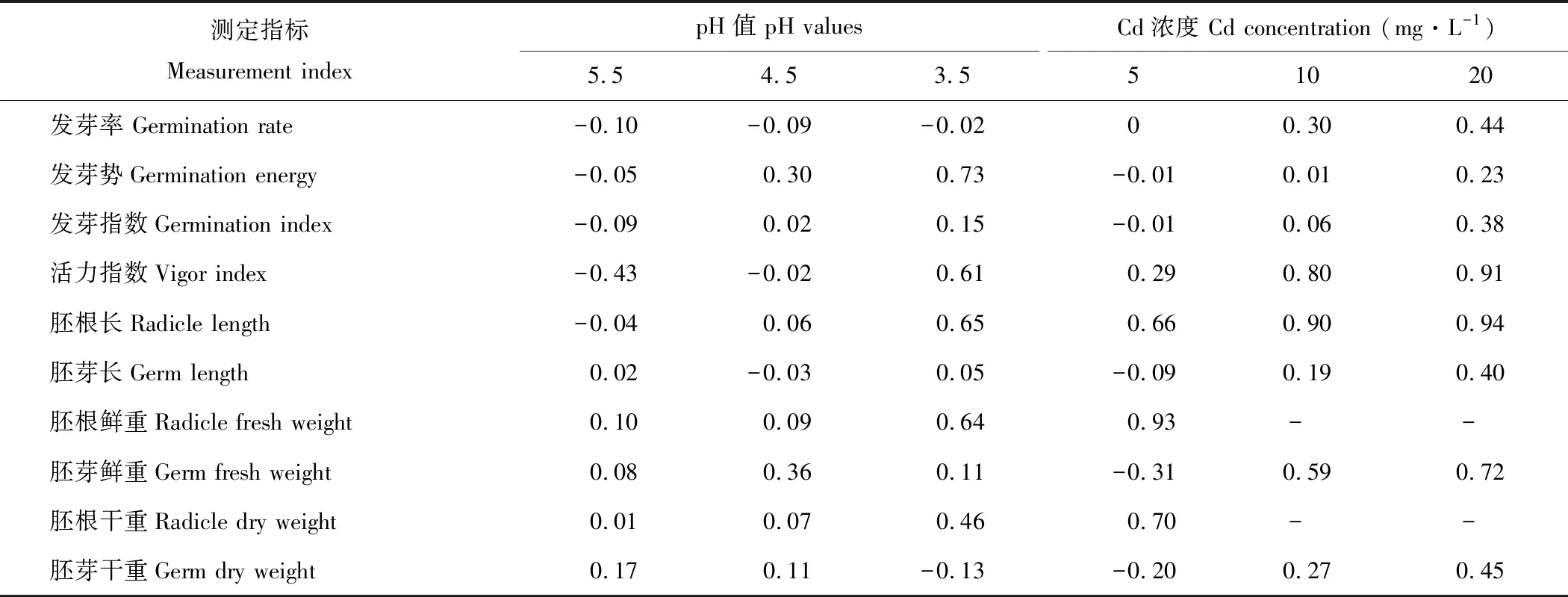
表2 酸、 镉胁迫处理金丝草萌发指标和生长指标的抑制指数
2.5 酸、镉胁迫对金丝草幼苗根尖质膜完整性的影响
由图3可知,对照组根尖无明显着色,随着酸、Cd胁迫程度的增加,根尖着色逐渐加深,在pH 3.5和Cd 20处理下的根尖质膜受到严重损伤,染色最深(细胞相对活性仅为10%左右),说明根尖细胞膜的破损程度逐渐增加。
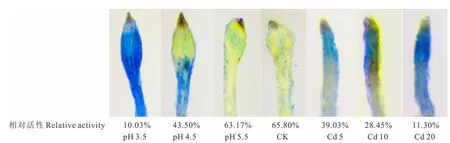
图3 酸、镉胁迫下金丝草幼苗根尖质膜完整性
2.6 酸、镉胁迫下金丝草幼苗胚芽细胞亚显微结构
2.6.1酸胁迫对金丝草幼苗胚芽细胞亚显微结构的影响 由图4可知,对照组金丝草胚芽细胞形态结构完整,细胞核核膜完整清晰,圆球形线粒体数量较多,内部管状嵴分布均匀,清晰可见,叶绿体基粒和类囊体结构清晰,排列整齐(图4-1,4-2)。pH 5.5处理下的部分胚芽细胞叶绿体外膜断裂,产生髓样结构(图4-3,4-4)。pH 4.5处理部分叶绿体内膜破损,基粒出现弯曲变形,线粒体数量减少,管状嵴密度降低(图4-5,4-6)。pH 3.5处理下细胞膜断裂,细胞核出现空泡化现象,部分叶绿体和线粒体等细胞器严重破裂,内部蛋白质和酶类等物质外流,细胞受损严重(图4-7,4-8)。
2.6.2镉胁迫对金丝草胚芽细胞亚显微结构的影响 由图5可知,相较于对照,Cd 5处理细胞出现明显的质壁分离现象,叶绿体变形皱缩成近球形,外膜断裂,基粒排列混乱,类囊体扭曲变形,细胞基质中开始出现大量黑色颗粒(图5-9, 5-10)。Cd 10处理下细胞受损加剧,叶绿体内膜破裂,基质外流,部分细胞细胞器破损严重,开始出现细胞空泡化现象,并且同样存在大量黑色颗粒(图5-11, 5-12)。Cd 20处理下细胞核、线粒体、叶绿体和内质网等细胞器皆破裂消失,细胞空泡化现象加剧,细胞壁周围沉积大量黑色颗粒(图5-13, 5-14)。对Cd胁迫下的金丝草胚芽细胞进行能谱分析发现(图6),胚芽细胞内均沉积了一定量的重金属Cd,其峰值低于Cl,且均吸附于0.3~0.6 keV和2.5~4 keV位点间,证明了Cd是存在于细胞壁和细胞基质中的黑色颗粒物的主要成分之一。
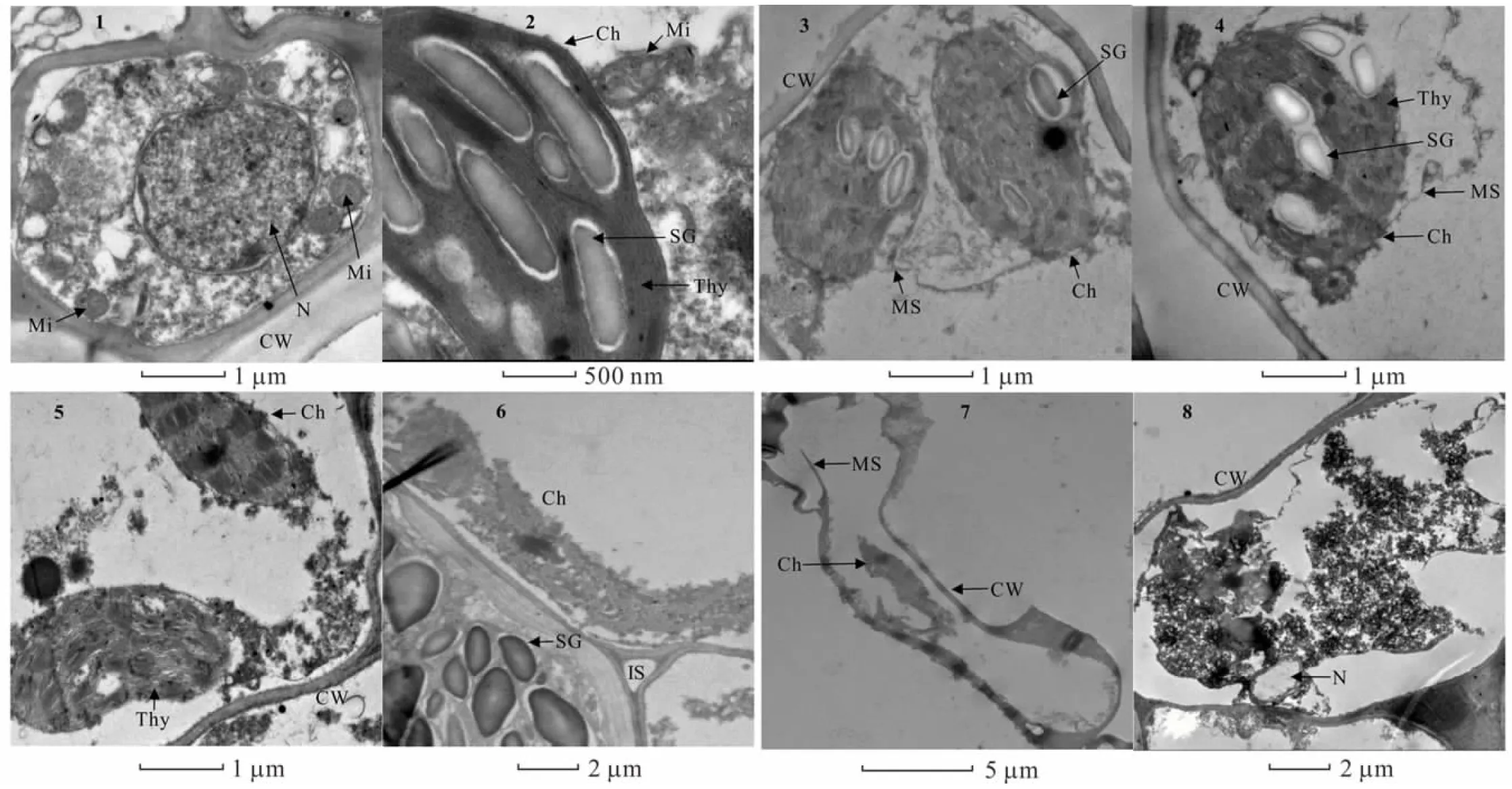
图4 酸胁迫下金丝草幼苗胚芽细胞亚显微结构
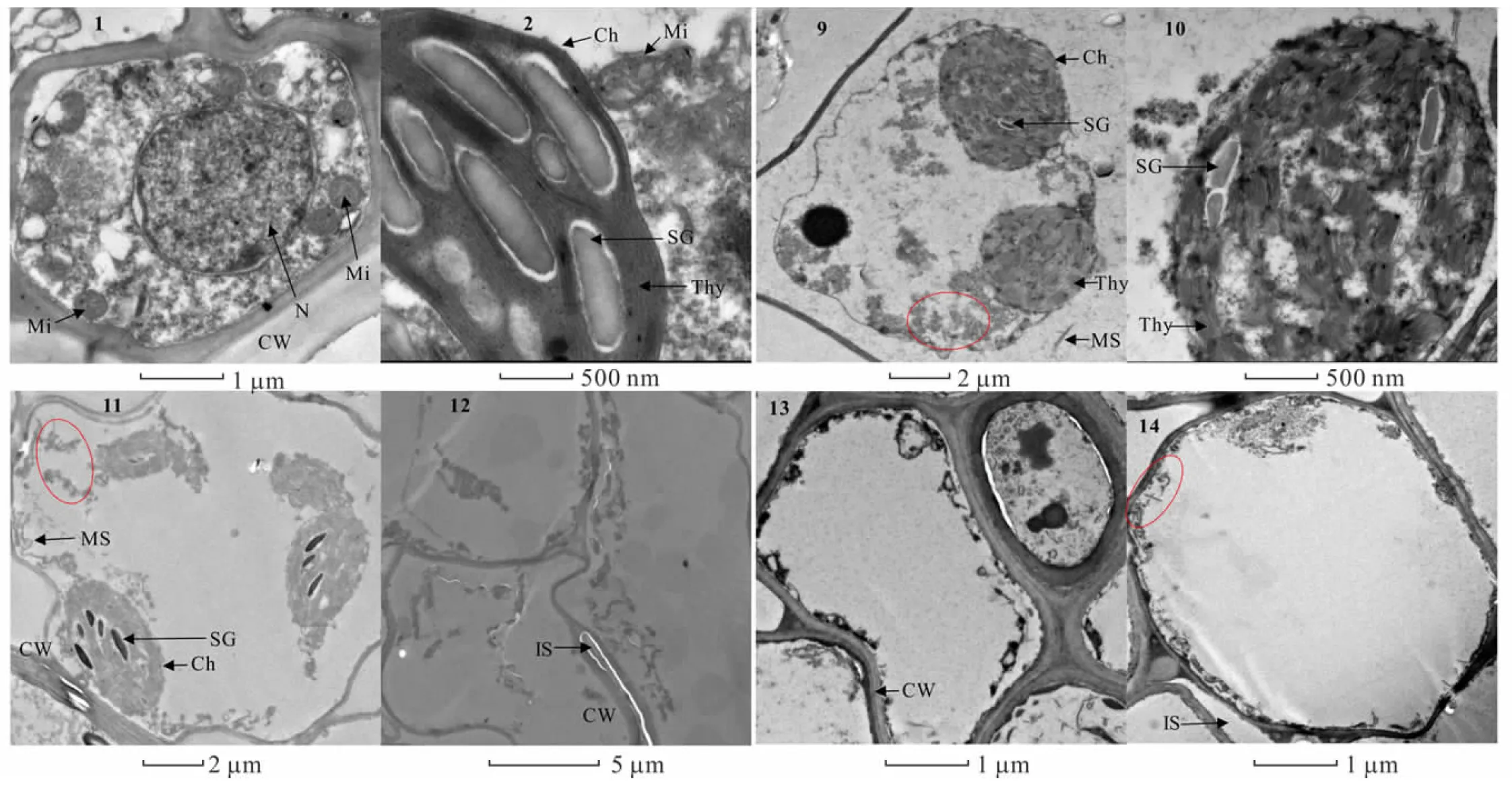
图5 Cd胁迫下金丝草幼苗胚芽细胞亚显微结构

图6 Cd胁迫下金丝草幼苗胚芽细胞能谱图
2.7 金丝草种子萌发和幼苗生长对酸和镉胁迫的耐性评价
2.7.1酸、镉胁迫处理下金丝草各萌发和幼苗生长指标的相关性分析 由表3可知,各形态指标之间、指标和处理之间均存在不同程度的相关性,其中发芽率、发芽指数、芽长、芽干重和处理间均有显著相关性(P<0.05),且发芽率和芽长与处理间为极显著负相关(P<0.01);另外,发芽率和芽长呈极显著正相关,活力指数和根长、根干重极显著正相关,根长和根鲜重、根干重极显著正相关(P<0.01)。而发芽势与处理和其他各指标间均无显著相关性(P>0.05)。发芽率和芽长可作为判断金丝草耐酸和Cd胁迫程度的关键指标。

表3 酸、镉处理下金丝草种子萌发和幼苗生长各形态指标之间的相关性
注:** 表示在 0.01 水平(双侧)上显著相关,* 表示在 0.05 水平(双侧)上显著相关。
Note: ** indicates significant correlation at 0.01 level (both sides), * indicates significant correlation at 0.05 level (both sides).
2.7.2酸、镉胁迫下金丝草各形态指标的隶属函数值 根据相关性分析的结果,运用隶属函数法对有显著相关性的萌发和生长指标进行综合评价。由表4可知,不同处理下的金丝草萌发和幼苗生长指标的综合隶属函数值大小为pH 5.5>CK>pH 4.5>Cd 5>pH 3.5>Cd 10>Cd 20。酸、Cd胁迫下的综合隶属函数值均随胁迫的增强而减小,且仅有pH 5.5处理的综合隶属函数值大于对照,是对照的1.034倍,说明弱酸处理有助于金丝草的种子萌发和幼苗生长;Cd处理的综合隶属函数值均小于对照,其中Cd 20处理对金丝草的种子萌发和幼苗生长的抑制作用最大。
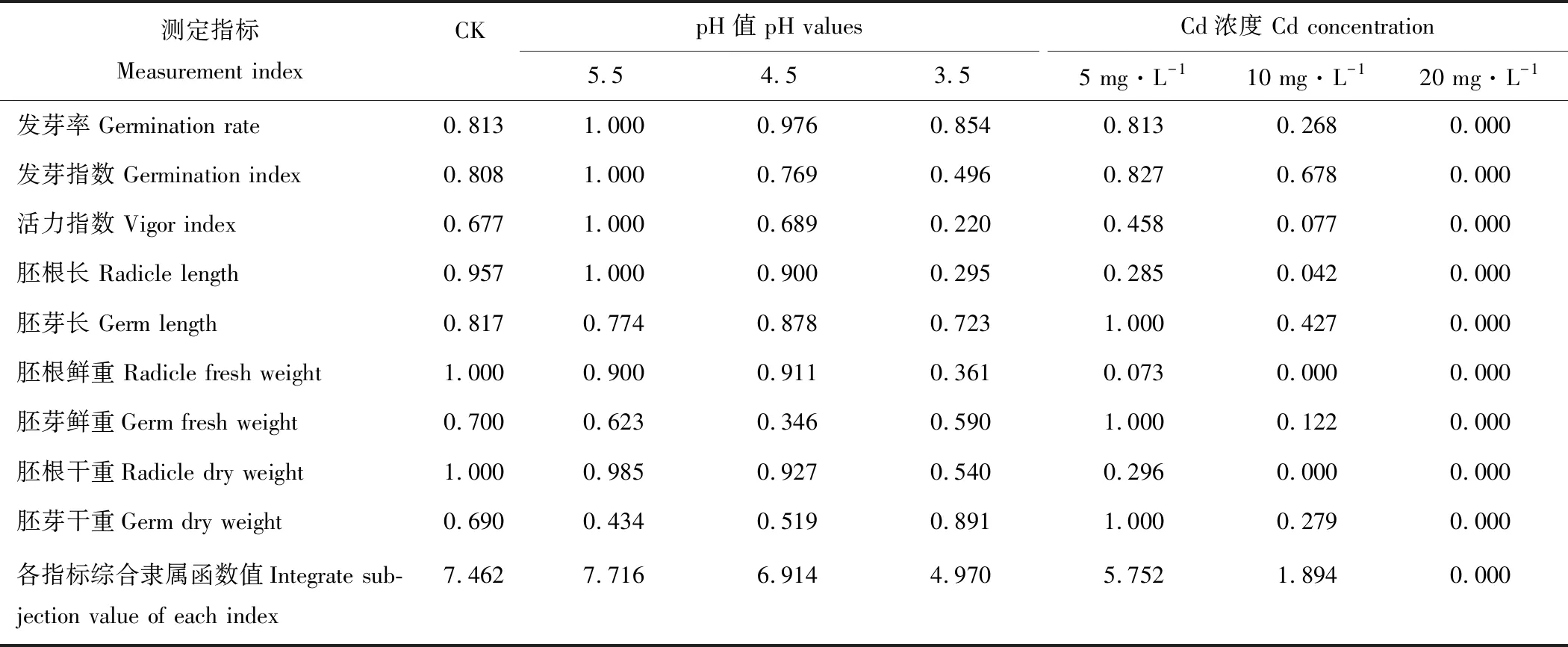
表4 不同酸和镉胁迫下金丝草各萌发和生长指标的隶属函数值
3 讨论
逆境胁迫环境会对植物的生长发育产生一定的影响,本试验采用不同pH和Cd溶液对金丝草种子进行胁迫处理,结果发现,酸处理均会促进种子的萌发,且胁迫下金丝草种子萌发指标呈先增后减趋势,均在pH 5.5达到最大值, 呈现“低促高抑”现象;酸胁迫对萌发指标的抑制作用表现为pH 3.5>pH 4.5>pH 5.5。欧阳玲[20]研究发现白三叶(Trifoliumrepens)种子的萌发指标均随酸度的增加(pH 7.0~2.0)呈先增加后减小趋势,在pH 6.0达到萌发指标的最大值,本试验研究结果与其一致。杨舒贻等[21]对强酸胁迫下大叶相思(Acaciaauriculiformis)幼苗的抗性生理机制进行研究发现,在pH值为3.0和2.0环境下,幼苗丙二醛(MDA)含量无显著变化,且谷胱甘肽-S-转移酶和谷胱甘肽过氧化物酶在pH 2.0胁迫下无显著变化,但在pH 3.0胁迫下会显著上升等,pH 3.0可能是大叶相思幼苗耐强酸胁迫的生理调节阈值。另外,本研究中发现pH 6.1~4.5处理对金丝草幼苗胚根长、胚芽长、胚根干重无显著影响(P>0.05),但胚根长随酸度的增加呈先增后减趋势,在pH 5.5达到最大值;且胚根长、胚根干重随pH值的减小(pH 5.5~3.5)受到的抑制作用逐渐增强,胚芽干重则相反。张玉秀等[22]研究发现,紫穗槐(Amorphafruticosa)根长在pH 3.0~4.5 处理间迅速增加,然后随着pH的升高逐渐减小,且在pH 4.5~5.0达到最大值,pH 3.0胁迫明显抑制根生长。张海艳[23]研究发现,pH 5.0~2.0胁迫环境对玉米幼苗生长没有显著抑制作用,pH 1.0胁迫对玉米幼苗根系的抑制作用大于地上部分,本试验研究结果与其一致。这可能是因为在弱酸处理下金丝草将有限的养分资源优先分配到根部来适应逆境,使根长得到补偿增长来维持根系正常的生理功能,而低pH值可能导致根尖细胞分裂速度减慢或无法正常分裂,从而对根的伸长产生抑制。
Cd胁迫对金丝草的种子萌发指标和幼苗生长指标的抑制作用均表现为Cd 20>Cd 10>Cd 5,其中Cd 5处理会促进种子的发芽势、发芽指数、胚芽长、胚芽鲜重和胚芽干重。徐雅梅等[24]对野生垂穗披碱草(Elymusnutans)种子在Mn、Pb处理下的响应研究发现随着Mn、Pb溶液浓度的升高,种子发芽指标和胚根、胚芽长出现了不同程度的减小趋势;孙金金等[25]研究发现黑麦(Secalecereale)、燕麦(Avenasativa)、高丹草(Sorghumbicolor×Sorghumsudanense)和无芒雀麦(Bromusinermis)等禾本科草类的相对发芽率、发芽指数和活力指数,以及幼苗的相对芽长、根长、芽重和根重均随Cu、Cd和Pb胁迫浓度的增大呈降低趋势,黑麦草(Loliumperenne)和高羊茅(Festucaarundinace)在高浓度胁迫下甚至出现“无根苗”现象,本研究结果与其一致。这可能是因为过量的重金属离子会造成种子和幼苗产生过氧化毒害,造成细胞膜脂过氧化,甚至导致植物体内活性氧自由基的产生和抗氧化防御系统之间的失衡,影响植物的正常生长发育[26-27]。
伊文斯蓝染色通过植物染色深浅来评价其质膜完整性,植物在受到逆境胁迫后积累的活性氧会导致植物MDA含量升高,而MDA 是细胞膜脂过氧化的主要产物,也是判断植物细胞膜破损程度的重要指标之一[28]。李黎等[29]研究发现,细茎柱花草(Stylosanthesguianensisvar.intermedia)体内的丙二醛含量随低温处理时间的增加而逐步升高。罗洁文等[30]研究发现,类芦(Neyraudiareynaudiana)根系体内的MDA含量随Cd、Pb 胁迫浓度的增加呈增长趋势,其根系质膜的着色变化与MDA含量变化相同,且在Cd、Pb浓度为100 μmol·L-1时着色最深。本试验对金丝草幼苗根尖进行染色发现,随着胁迫浓度的增加,染色程度逐渐加深,说明根尖细胞膜的破损程度逐渐增加,进一步在组织化学的层面上证明了酸、Cd处理对金丝草幼苗根系的影响,与以上研究结果一致。另外,有研究发现,植物在逆境环境下会对体内细胞器产生一定的损伤,特别是叶绿体、线粒体、细胞核等细胞器,导致细胞壁被破坏,叶绿体基粒膨胀、溶解、数量减少,线粒体膜破损,内嵴断裂等现象发生[31-32]。本研究发现,在CK处理下,叶肉细胞组织结构完好,随着胁迫浓度的增加,细胞质壁分离严重,叶绿体膜破裂,出现髓状物质,基粒弯曲变形,线粒体管状嵴排列混乱甚至消失,且在Cd 20处理下出现细胞空泡化现象,且Cd胁迫下的叶肉细胞的细胞壁、细胞质中均可检测出重金属Cd颗粒,可能是细胞壁固持作用达到了饱和或受到了破坏,使Cd离子进入到细胞内[33]。
4 结论
不同酸胁迫均对金丝草种子发芽率具有促进作用,pH 5.5处理对金丝草种子萌发和幼苗生长具有促进作用,但pH 3.5处理则表现出较大抑制作用;5 mg·L-1Cd处理下金丝草种子发芽率、发芽势和发芽指数与对照无显著差异,生物量显著大于对照,但随Cd胁迫浓度的增加,金丝草种子萌发和幼苗生长指标表现出抑制作用且呈逐渐增大趋势;pH 大于3.5,Cd浓度小于10 mg·L-1对金丝草根尖质膜和胚芽超微结构影响较小,反之则破损严重,为金丝草耐受酸和Cd胁迫的阈值。

