脑脊液鼻漏的定位及修补12例报告*
——附
栾 宁 朱 丽 徐驰宇
(北京大学第三医院耳鼻咽喉科,北京 100191)
脑脊液鼻漏(cerebrospinal fluid rhinorrhea,CSFR)是脑脊液经蛛网膜下腔破损口流入鼻腔、鼻窦,再经前鼻孔或鼻咽部流出[1]。随着鼻内镜鼻颅底技术的逐渐发展,鼻内镜以术野清晰、创伤小、手术径路短等优点成为CSFR修补术的首选方法。术前准确定位,尤其是小漏口的定位是手术成功的关键。我科2010年11月~2019年3月鼻内镜下修补术后中小型漏口(漏口直径≤10 mm)[2]CSFR 12例,报道如下。
1 临床资料与方法
1.1 一般资料
本组12例,男7例,女5例。年龄22~66岁,平均47岁。左侧5例,右侧7例。病程1个月~72个月,中位数6个月。外伤性5例,其中1例脑外伤后14年,1例脑外伤后2年,3例脑外伤后立即出现(1例合并2型糖尿病10年);自发性7例,其中空蝶鞍4例,余3例无明确病因(1例合并原发性高血压15年)。均有患侧鼻腔流清亮液体且头低位时加重病史,其中1例伴患侧嗅觉下降,2例伴反复发热(1例就诊前反复发热1个月,腰穿证实为化脓性脑膜炎)、头痛(1例4年前因发热、头痛、右侧鼻腔流清亮液体,外院行腰穿证实为化脓性脑膜炎,经卧床、腰穿并留置引流半个月后好转,此后上述症状反复发作2次,均经卧床、腰穿并留置引流1个月后好转,4个月前再次发作,上述治疗4个月无好转,就诊),1例伴双侧溢泪。2例查体见嗅裂处清亮水样分泌物,1例蝶筛隐窝处清亮水样分泌物,余未见明显异常。术前行鼻内镜检查、高分辨CT(HRCT)扫描和MR水成像。鼻内镜检查:2例蝶筛隐窝清亮液体溢出;4例中鼻道搏动清亮液体溢出(图1);3例嗅裂处清亮液体溢出,压迫同侧颈内静脉液体量增多;3例内镜下无明显异常,其中1例可见中鼻甲黏膜肥厚。HRCT检查:7例颅底骨质缺损或连续性中断(图2),4例窦内黏膜肥厚、积液或软组织密度影,1例表现未见异常。MR水成像:在T2WI成像上,9例见鼻腔或鼻窦内长T2信号与颅内CSF信号相连(图3),其中4例脑组织疝入窦腔内,其余3例仅表现为窦内长T2信号(图4);4例提示空蝶鞍。CSF生化检查葡萄糖含量均≥1.7 mmol/L。
病例选择标准:①符合CSFR诊断标准[3](鼻腔清亮液体经CSF生化检查葡萄糖定量分析≥1.7 mmol/L,完成鼻内镜检查、HRCT、MR水成像检查);②保守治疗4~8周无效(保守治疗包括[4]:取头高脚低半坐位,避免擤鼻、打喷嚏、用力等颅压增高活动,保持大便通畅,低盐饮食、限制饮水量,应用可通过血脑屏障的抗生素预防颅内感染,对颅压较高者应用甘露醇降颅,且术中证实漏口直径≤10 mm);③除外鼻腔、颅内占位性病变及精神疾病无法配合治疗者。
1.2 方法
经口气管插管全身麻醉。仰卧位,头略偏向右侧。1%肾上腺素+丁卡因棉片收缩鼻腔黏膜,置入0°或70°鼻内镜(德国Karl Storz公司)。根据术前漏口定位及鼻腔情况选择手术入路[5]:①来源于中鼻道、嗅裂或筛板的CSF,采用从前向后的Messerklinger术进行探查;②来源于蝶窦的CSF或有前期鼻腔手术史,鼻腔内结构破坏,可选Wigands术从后向前探查,直接切除部分中鼻甲或将中鼻甲骨折后暴露筛顶或蝶窦;③额窦CSFR根据情况选择DrafⅡ或Ⅲ术式,如果漏口位于额窦外侧或较大, 联合应用额窦钻孔术[6]。将漏口周围3~5 mm处黏膜烧灼形成新鲜创面,或暴露周围骨质,形成良好“移植床”,如有脑组织膨出,同时烧灼膨出脑组织。4例漏口直径<5 mm行单层修补,应用游离或带蒂鼻腔黏膜瓣外置法;8例行多层修补,其中5例漏口直径≥5 mm,应用鼻腔自体骨片联合阔筋膜、鼻腔黏膜内置法修补,3例蝶窦内漏口应用大腿外侧肌肉或颞肌筋膜联合阔筋膜外置法。见表1。
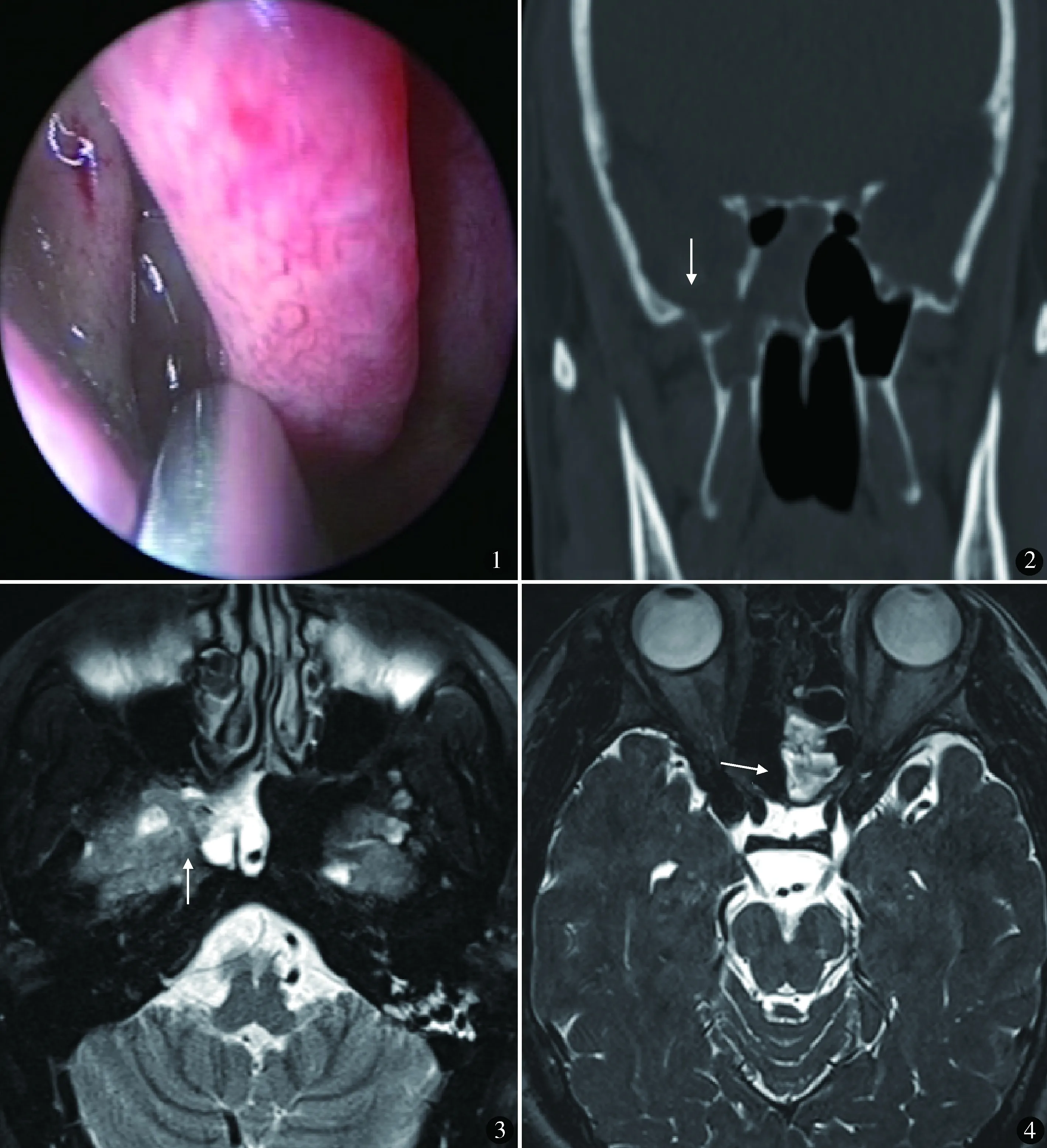
图1 鼻内镜下见右侧中鼻道清亮液体流出 图2 HRCT冠状位骨窗右侧蝶窦外侧壁局部可见骨质缺损 图3 MRI水平位T2WI右侧蝶窦旁隐窝与中颅窝线状长T2信号,示脑膜及CSF自缺损处进入蝶窦 图4 MRI水平位T2WI左侧蝶窦内环形长T2信号,示蝶窦内CSF潴留
术后采取半卧头高30°体位7~10 d。使用甘露醇降颅压,避免打喷嚏、咳嗽等用力动作,保持大便通畅,可适当给予通便药物。术后2 d全身使用通过血-脑屏障的抗生素头孢曲松钠预防感染。监测水、电解质,记录出入量。根据患者情况,术后1周逐渐下床。术后8~14 d取出鼻腔填塞碘仿纱条。同时注意观察患者术后有无发热、头痛、意识障碍和脑膜刺激征等,以及术后1周是否有鼻腔反复清亮液体流出。
2 结果
2.1 漏口定位
12例术中发现均为单个瘘口,其中筛顶4例(漏口大小分别为5.0 mm×2.3 mm,4.0 mm×5.0 mm,9.0 mm×5.0 mm,3.0 mm×3.0 mm),侧板2例(漏口大小分别为1.2 mm×4.2 mm,4.3 mm×3.0 mm),额窦后壁2例(漏口大小分别为4.0 mm×8.0 mm,5.0 mm×5.0 mm),蝶骨平台1例(漏口大小3.5 mm×1.4 mm,见图5),蝶窦外侧壁1例(漏口大小3.0 mm×3.0 mm),蝶窦旁隐窝1例(漏口大小10.0 mm×6.0 mm),蝶骨大翼1例(漏口大小4.0 mm×4.5 mm),见表1。
鼻内镜检查发现CSF流出范围均与术中漏口位置一致,检出率75.0%(9/12),符合率75.0%(9/12)。HRCT检查有骨质缺损的7例中,与术中一致5例(蝶骨大翼1例,蝶骨平台1例,额窦后壁2例,筛顶1例);余2例中,蝶窦顶壁1例但术中证实漏口为侧板,蝶窦后壁1例同时伴右前筛条索状软组织影,但术中证实漏口位于筛顶,蝶窦后壁有骨质缺损无漏口,检出率58.3%(7/12),符合率41.7%(5/12)。MR水成像检查明确漏口位置的9例中,均与术中漏口位置一致,检出率75.0%(9/12)。

表1 12例CSFR修补情况
9例术前检查见骨质缺损或线状高信号影。其余3例中,1例鼻内镜正常,CT见蝶窦顶壁骨质缺损,但MR水成像仅表现为后筛、蝶窦内长T2信号,我们考虑为蝶骨平台,术中证实为蝶骨平台。1例鼻内镜下见右侧嗅裂流出水样分泌物,但HRCT仅表现筛窦黏膜肥厚,MR水成像示前筛长T2信号,我们考虑漏口可能位于筛板、筛顶处,术中证实为筛顶。1例鼻内镜示中鼻道水样分泌物流出,HRCT示前筛条索状软组织影,蝶窦后壁骨质欠连续,MR水成像示蝶窦少许液体影,鞍窝扩大,少许长T2信号,我们考虑漏口可能位于筛板、筛顶周围和蝶窦后外侧壁,但术中探查漏口位于筛顶,蝶窦后外侧壁有骨质缺损但无液体漏出。
2.2 术中、术后情况
12例均一次修补成功,手术时间见表1。术后住院7~12 d,平均9.8 d。术后鼻腔清水样物消失时间0~8 d,平均2.3 d。术后无颅内感染、气颅、视力下降等严重并发症发生。取出碘仿纱条后,内镜下见修补黏膜瓣均成活,周围无清水样分泌物流出。12例随访6个月~5年,平均39个月,1例术后3年因其他疾病身故,其余均无复发。
3 讨论
经鼻内镜CSFR修补术因手术时间短、径路短、创伤小等优点已成为CSFR修补的首选方法。手术成功的关键在于适应证的选择、术前漏口的准确定位及术中修补材料和修补方法的选择以及术后的治疗。
3.1 术前定位
临床常用的漏口定位诊断方法有HRCT、MR水成像、脑池造影、椎管内注射荧光剂和放射性核素显像等。
鼻内镜是一种简洁、无创的检查方法,可见流动清亮液体经中鼻道、嗅裂或蝶筛隐窝等部位溢出,且Valsalva法时液体增加[7~9],根据CSF漏出的部位判断漏口的大致范围,且漏口周围多表现为黏膜水肿、淡粉色肉芽组织形成,增加颅内压可见CSF流出增加[10]。本组12例,9例术前鼻内镜检查发现相应部位CSF流出,检出率为75%,但不能明确判断漏口位置,仅能大致判断漏口所在范围,考虑与鼻内镜检查视野较小,由于黏膜肿胀及解剖学特点,不能明确检查鼻颅底相关鼻窦各壁情况。HRCT可重建三维图像,通过颅腔与鼻腔或鼻窦之间的窦壁骨质缺损或颅底骨折并且该鼻窦腔内有积液或软组织影[7~9]明确窦口位置,常作为首选方法[11],可很好地显示骨折或骨质缺损处,但对漏口的位置显示不佳,而颅底骨折或骨质缺损并不一定导致CSFR,故准确性欠佳。本组HRCT检出率与符合率较低(58.3%、41.7%),可能因为本组患者漏口均<10 mm,骨质缺损较小,且边缘效应和部分容积效应,特别是当骨缺损<2 mm时,诊断率将降低,甚至出现假阳性或假阴性的结果。CSFR者MR水成像CSFR可见颅腔CSF高信号影与鼻腔或副鼻窦内高信号液体影之间有线状高信号影相连[7~9],可准确显示漏口位置,对骨质信号显示欠佳。本组MR水成像检出率与符合率均为75.0%(9/12),可准确定位,不能确定骨质缺损或骨折位置。将MR水成像与HRCT结合,对漏口的定位符合率可达90%[12]。脑池造影、椎管内注射荧光剂和放射性核素显像等检查方法,因有创患者依从性差,且检查后并发症较多,目前临床已较少使用。本组患者结合病史、鼻内镜检查、HRCT、MR水成像,术前均准确判断瘘口位置,并于术中得到证实。
3.2 修补材料及方式的选择
CSFR修补材料包括自体组织和非自体组织,自体组织又包括带蒂黏膜瓣和游离黏膜瓣,鼻腔内自体组织,因取材方便、创伤小、血运丰富、抗感染能力强已广泛应用于临床,成为理想的修补材料。吴瑕等[13]报道对于<5 mm漏口多采用鼻中隔软骨膜或中、下鼻甲黏膜瓣外置法。本组漏口位于蝶窦的小型漏口,先以肌肉组织或颞肌筋膜覆盖骨质缺损处,再以游离或带蒂黏膜瓣、阔筋膜覆盖缺损处,行多层修补;对于除蝶窦外的其他小型漏口,以游离或带蒂黏膜瓣,行外置法单层修补;对于中型漏口(漏口直径5~10 mm),先以自体骨片置入硬脑膜外颅底骨质缺损下方起支撑作用,再以游离或带蒂黏膜瓣、筋膜覆盖骨片和周围新鲜骨面上,速即纱压实边缘,行内置法多层修补。临床中我们体会不同的自体组织材料与手术成功与否无明显关系,现我们多选用鼻腔黏膜组织:漏口略大、颅压较高或不规则细长小漏口,以带蒂黏膜瓣修补为好,如鼻中隔带蒂黏膜瓣、中鼻甲或上鼻甲带蒂黏膜瓣;微小漏口,仅选用游离黏膜瓣,如上鼻甲、中鼻甲、鼻中隔黏膜瓣。对于带蒂黏膜瓣的选取,我们根据需要修补的位置及大小,按照足够大、路径短、损伤小原则,对于缺损在筛板的中小型漏口,选择附近鼻中隔舌型带蒂黏膜瓣修补;对于筛顶、额窦处中小型漏口,多选择中鼻甲内侧带蒂黏膜瓣进行修补。本组10例修补后2例术后有CSF流出,1周内停止。12例均一次修补成功,取得良好疗效,无并发症发生。
3.3 术后治疗
CSF修补术失败的重要因素为颅内压增高,因此,术后的颅内压管理尤为重要。陈红江等[14]建议对自发性CSFR患者行围术期腰池引流及术后1个月的药物控制颅压,可降低术后复发、失败的机率。因腰池引流易引起头痛、颅内感染、颅内积气等并发症,其在鼻内镜CSFR修补术中的应用存在争议[15~17]。毕智勇等[3]报道鼻内镜修补术后未应用腰池引流,术后愈合佳。本组12例术后均未应用腰池引流,常规给予甘露醇降颅压,并要求患者尽量卧床1周,并根据患者是否有头痛、电解质紊乱以及鼻腔是否有水样分泌物流出而适当调整甘露醇的用量、卧床时间及碘纺取出时间,对于>5 mm漏口,早期我们应用甘露醇的时间较长,起始剂量从125 ml q6 h,应用3 d,逐渐减少应用次数,发现易引起低钾血症及头痛等不适,尤其对于微小漏口或外伤性CSF患者,我们适当减少甘露醇的用量及次数,患者的耐受性及依从性更佳。鼻腔内碘仿纱条的留置时间根据患者是否耐受、感染征象、鼻腔有无CSF流出,一般术后7~30 d取出,本组12例为中小型漏口,术后7~14 d取出,取出后均无脑脊液流出。
综上,鼻内镜下CSFR鼻漏修补术是治疗小漏口的首选方法,具有创伤小、恢复快、成功率高等优点。术前准确定位、手术方式的选择以及术后的处理是手术成功的重要因素。

