三七素提取工艺及检测方法的优化
段绍凤 陈庚 闫静 覃忠明 张广辉 梁艳丽

摘 要 本研究以三七(Panax notoginseng)植株及其产品和近缘种为研究对象,采用L9(34)正交试验对三七素的提取工艺进行了优化,然后利用HPLC法检测三七素含量,并对各样品中的三七素含量进行了比较分析。结果表明:优化后的三七素提取条件为超纯水、料液比1∶20(g/mL),提取1次(10 min);三七素在三七花蕾中的含量最高,其次是根状茎和主根,但是三七茎叶中也有较高含量的三七素,说明三七花蕾和茎叶均可作为三七素的提取原料;在三七产品中三七花的三七素含量最高,达到3.33%,其次是剪口(根状茎)、筋条(侧根)和须根;但三七素的含量与三七个头大小(头数)并无明显的相关性;在三七近缘种姜状三七(P. zingiberensis)和野三七(P. vienamensis var. fuscidiscus)主根、珠子参(P. japonicus var. major)根状茎中的三七素含量显著低于三七主根三七素含量,也显著低于三七其他部位的三七素含量,说明三七是最佳的三七素来源植物。三七素的含量主要受到物种和部位的影响,与产品规格无关。本文所建立的三七素提取方法和HPLC检测方法,能够快速简便、稳定可靠测定样品中三七素含量;并可为三七素相关标准的建立奠定基础,为三七的综合利用开发提供依据。
关键词 三七;三七素;HPLC;超声提取
中图分类号 R284 文献标识码 A
Abstract The extraction process of dencichine in Panax notoginseng was optimized by the L9(34) orthogonal test, and the content of dencichine was determined by HPLC. The optimized extraction condition for dencichine was extracted once with ultrapure water at solid-to-liquid ratio of 1∶20 (g/mL) for 10 min. Flower bud had the highest dencichine content, followed by rhizome, main roots and leaves. The content of dencichine in flower buds was 3.33%. There was no significant correlation between the content of dencichine and the rhizom size. The content of dencichine in the rhizome of P. zingiberensis and P. vienamensis var. fuscidiscus was significantly lower than that of the main root of P. notoginseng. It was also significantly lower than that of other parts of P. notoginseng, indicating that P. notoginseng was the best source of dencichine. The content of dencichine was mainly affected by species and parts, and had nothing to do with product specifications. The extraction method and HPLC detection method established in this paper could quickly and easily determine the content of dencichine. It can lay a foundation for the establishment of related standards of dencichine and provide a basis for the comprehensive utilization and development of P. notoginseng.
Keywords Panax notoginseng; dencichine; HPLC; supersonic extraction
DOI 10.3969/j.issn.1000-2561.2019.11.021
三七素是三七[Panax notoginseng (Burk.) F. H. Chen]中的一种非蛋白游离氨基酸,化学名称为β-N-草酰-L-α, β-二氨基丙酸(β-N-Oxalyl-L- α, β-diaminopropionic acid, β-ODAP)。三七素具有止血活性成分,通过增加体内血小板数量止血,并缩短凝血和出血的时间,被广泛用于外伤出血治疗等,是云南白药等多种传统药方的有效成分[1-2]。低剂量三七素可以止血,高剂量则引发神经毒性,而人畜过度食用会导致不可逆瘫痪[3]。三七素存在于五加科人参属植物中,如三七[P. notoginseng (Burk.) F. H. Chen]、人参(P. ginseng)、西洋参(P. quinquefolium)等[4-7],还存在于山黧豆(Lathyrus sativus)中。三七素含量的检测方法,包括氨基酸自动分析仪[8-9]、柱前衍生化HPLC法[10-13]、HPLC-ELSD法[14]、直接高效液相色谱法[15-16]、毛细管区带电泳法[17]、多孔石墨化碳柱分析法[18]、荧光衍生后薄层扫描[19]等。在上述方法中氨基酸自动分析仪、HPLC-ELSD法、毛细管区带电泳法中存在仪器昂贵、应用不广泛、分析过程复杂、特异性强等问题,特别是用毛细管区带电泳法时会存在无关的峰,对三七素测定有一定的影响。荧光衍生后薄层扫描的衍生化产物不稳定,扫描定量中引起误差的因素较多,影响分析结果的准确性。除了测定方法外,三七素的提取方法也至关重要,常用的提取方法有超声提取、冷浸提取、回流提取和水煎煮法。但是三七素对温度有一定的要求,温度过高会使三七素变质。现有的方法对三七素的提取和测定都存在着一定的不足之处,并且现在对三七素的研究相对少,而我国药典中三七药材质量标准不包括三七素,但美国FDA已将三七素作为三七质量控制指标[20],因此,研究三七及其产品中三七素的含量分布特点,对于相关标准的制定有重要指导意义。本研究使用超声提取三七素,且用高效液相色谱進行测定。并且本研究中所使用提取方法和检测方法,能够快速简便、稳定可靠测定三七素含量,为三七中三七素的质量标准控制提供参考及原料的选择及开发利用提供重要的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试植物材料 不同年份的三七植株(经杨生超教授鉴定)采自红河州弥勒县东山镇,分为剪口(根状茎)、主根、须根、茎、叶片、花蕾等部位。三七的野生近缘种姜状三七(P. zingiberensis)采自普洱市镇沅县九甲乡,野三七(P. vienamensis var. fuscidiscus)采自红河州金平县铜厂乡,珠子参(P. japonicus var. major)采自大理州祥云县九鼎山,均为4年生植株,采集时间为2017年8—10月。样品均于55 ℃烘干,用于三七素含量测定。市售三七商品,包括20~90头(单位“头”是指每市斤三七中的三七个数)不同规格的三七主根,以及剪口(根状茎)、筋条(侧根)、须根和三七花,均购买自文山三七国际综合交易市场。
1.1.2 仪器与试剂 Agilent 1260系列高效液相色谱仪(G1311C四元泵、G1329B自动进样仪、G1315D光电二极管阵列检测器),Agilent Chem Station工作站,美国Agilent 公司。
三七素标准品(纯度大于98%,生产批号wkq17022 207),维克奇生物科技有限公司;乙腈(HPLC级),Fisher公司;四丁基氢氧化铵(纯度大于98%),Sigma公司;水为超纯水;其他试剂均为分析纯。
1.2 方法
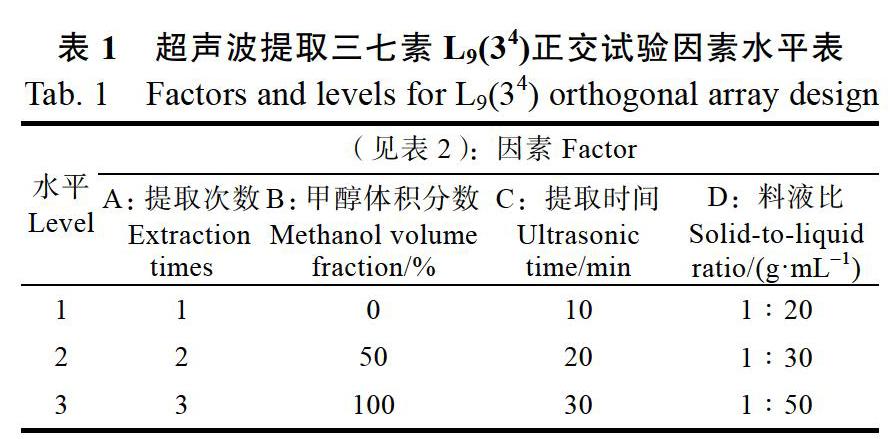
1.2.1 供试样品溶液制备 取样品约0.5 g(过65目筛),各3份。精密称定,置于具塞锥形瓶中,精密加入超纯水10 mL,称定重量,超声处理(功率180 W,频率40 kHz)10 min,静置放冷,再称定重量,超纯水补足减失的重量,摇匀。3500 r/min离心3 min,取上清液适量,经0.22 μm的微孔滤膜滤过后,取续滤液作为供试溶液。取对照品适量,精密称定,甲醇定容到10 mL,摇匀,制得浓度为401 μg/mL的对照品溶液,4 ℃保存待用[19]。并选择对水溶性物质三七素提取量有意义的因素水平,采用L9(34)正交试验优化提取工艺条件因素与水平(表1)[20]。
1.2.2 HPLC测定条件 色谱柱为Hypersil GOLD(250 mm×4.6 mm,5 μm),流动相为0.3%四丁基氢氧化铵(A)(磷酸缓冲液调pH至4.0)-乙腈(B),梯度洗脱[15]。流动相比例变化为0~ 12 min,98%~98% (A);2%~2% (B),12~18 min,98%~90% (A),2%~10% (B),流速为0.8 mL/min,检测波长为220 nm,柱温30 ℃,进样体积5 μL。
1.2.3 线性关系及方法学考察 (1)标准曲线与线性范围和回归方程。精密吸取对照品溶液(配制见方法1.2.1)0.1、1、5、10、15、20、25 μL分别进样分析。以色谱峰峰面积为纵坐标(Y),以进样含量(μg)为横坐标(X)绘制标准曲线进行线性回归分析,在0.0401~8.001 μg范围内线性关系良好,三七素含量测定回归方程为Y=611.3700X+3.9238,r=0.9999。
(2)方法学考察。精密吸取对照品溶液,连续进样6次,进样体积10 μL,得出三七素响应信号的相对标准偏差(RSD)为1.0%,表明仪器精密度良好。取采自3年生三七主根样品,制得的供试品溶液5份,按上述HPLC色谱条件分别在0、2、4、6、12、24、48 h进样测定,得出三七素响应信号的RSD为0.4%,表明供试样品溶液中的三七素48 h内稳定性良好。取采自3年生三七主根样品,按上述条件制得的供试品溶液5份,按上述HPLC色谱条件分别进样测定,计算含量,得出三七素响应信号的RSD为0.2%,表明该方法重复性良好。取已测定含量的3年生三七主根粉末约0.5 g,6份,精密称定,分别精密加入三七素质量的80%、100%和120%的对照品中,平行3份,再按上述方法制得供试溶液进样测定。测定结果表明,三七素加样回收率平均值为104.41%,RSD为1.2%,表明方法准确度良好。
1.3 数据处理
数据使用Microsoft Excel 软件和SPSS 17.0软件进行整理和分析。
2 结果与分析
2.1 三七素提取工艺优化
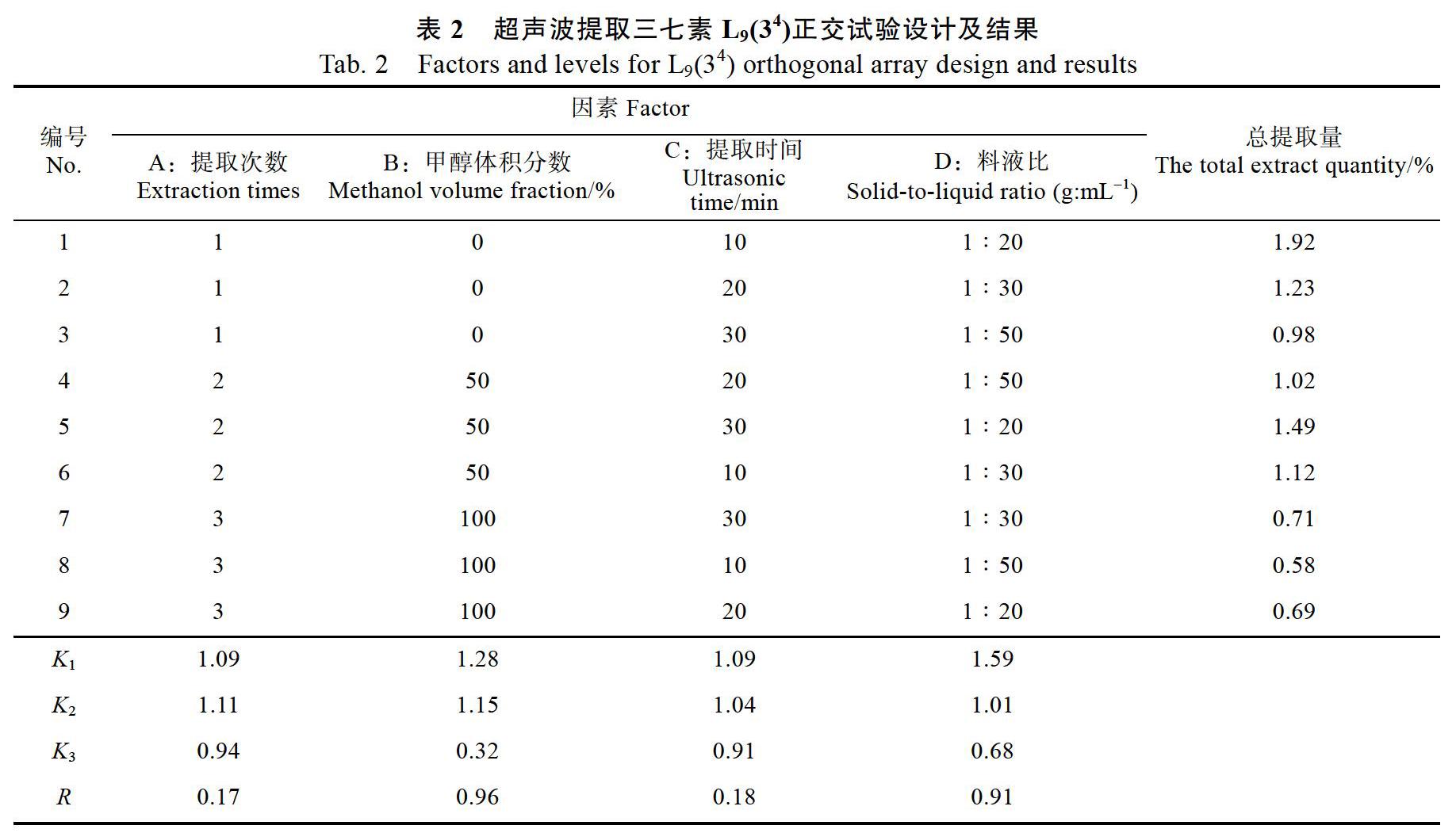
由表2的极差分析结果可以看出,RB>RD> RC>RA,4个因素对三七中三七素提取率的影响大小依次为:甲醇体积分数(B)>物料比(D)>提取时间(C)>提取次数(A)。4个因素中,物料比和甲醇体积分数的影响较为显著,其中甲醇体积分数的提取作用最为显著,在试验设计验证范围内,根据直观分析得到三七中三七素提取的最佳工艺条件为:甲醇体积分数为0、料液比1∶20提取时间10 min、提取次数1次。
2.2 三七素在市售三七产品中的含量分布
取三七素对照品溶液、供试品溶液5 μL在上述色谱条件下注入液相色谱仪,结果如图1所示,供试样品中的三七素峰形与对照品中的峰形相对称。
市售三七产品中,三七花中三七素含量最高,达3.33%,须根中三七素含量最低,仅为1.22%。不同规格三七主根中三七素含量不同,其中20头大小的三七主根三七素含量最高,為1.23%;90头大小的三七主根中的三七素含量最低,为0.94%;但是,头数与三七素的含量无明显的相关性(表3)。
2.3 不同產地含量测定
三七种植存在严重的连作障碍,导致适合种植三七土地不断减少,而红河是种植三七的另一大的产地,称取三七(3年生)样品,称取不同部位主根、须根、剪口、茎、叶子、花蕾,分别按1.2.1节下制备供试样品溶液,在1.2.2节液相条件下进行测定,结果见表4。结果发现红河州产地的三七的主根、须根、花蕾的三七素含量比文山州的高0.26%~0.83%且差异显著。其部位剪口、叶、茎的三七素含量差异不显著。
2.4 三七素在三七植株和近缘种中的分布
研究发现,三七素在三七植株的所有部位均有分布,其中三七素在花蕾中的含量最高,其次是根部和剪口,三七幼苗以及茎和叶片也有较高含量的三七素,因此,价格低廉的三七茎叶也可以作为提取三七素的原料之一。同时研究也发现,三七植株主要部位,如花蕾、主根、须根、叶片中三七素的含量均随着年龄的增长而提高,并且存在显著差异(表5)。
比较三七主根与姜状三七、野三七主根和珠子参根状茎的三七素含量,发现这3个近缘种中三七素的含量均显著低于三七,特别是珠子参中三七素含量最低,仅为0.29%(表6)。说明三七是三七素的最佳来源植物。
3 讨论
本文预试验中考察了分析柱Agilent ZOR?BAX SB-C18、Agilent Extend-C18、Nova-pak C18、Hypersil GOLD对三七样品溶液中三七素的分离度、保留时间以及峰形,发现Hypersil GOLD(250 mm4.6 mm,5 μm)可以提高三七素分离度,峰形良好。与文献报道相比[20],我们同时考察乙腈水、甲醇水、离子对试剂四丁基氢氧化铵流动相体系,发现铵离子能够导致三七素在Hypersil GOLD柱上的保留时间延长,有效地改善了峰形,提高了分离度,最终选择了乙腈0.3%四丁基氢氧化铵;采用了反相离子交换原理,会对待测弱酸的负离子(羟基端),从而达到增加保留、提供分离度,该分析方法能够快速、准确地对三七素进行定性定量检测、并且方法学验证良好。
与文献[9]相比我们进行了L9(34)正交试验优化提取条件,最终确定的超纯水超声波条件提取三七素含量最高,其中超声次数增多,三七素含量降低,可能由于三七素受热不稳定发生了脱羧反应而减少。甲醇体积分数增加,提取的三七素含量降低,这可能由于三七素相对分子质量小、极性大、水溶性好的特性。1∶20、1∶30、1∶50这3个物料比中,1∶20提取率最高,增加溶剂导致三七素提取量降低,可能由于三七水溶性好,在一定的溶剂量下就可以趋向平衡[21]。
前人测定药材市场上人参属植株商品中三七素含量[7],测定主要集中在人参、高丽参、西洋参,而本文测定了与前者不同的同属植株主根中三七素含量,也发现三七中三七素含量最高[9]。本研究测定的三七素含量结果发现花蕾中三七素含量最高,分析可能是三七花蕾为三七素积累的主要部位,因此,笔者推断可以通过比较不同部位基因表达差异,能进一步为发现与三七素合成途径相关基因提供参考基础,也能够揭示不同部位三七素含量差异。本文还研究了不同产地三七中三七素的含量,发现红河州产地的主根、须根、花蕾中的三七素含量比文山州产地的高,与前人的研究有点差异[9],但都有一定的参考价值,能为今后选择适宜的三七种植地提供一定的参考。并且本文采用色谱法系统测定具有快速、准确、重现性好等优点,全面考察了三七不同规格、生长年限、产地、部位以及同属植株三七素含量的影响,为三七中三七素的质量标准控制提供参考。目前三七素还没有开发利用,对三七研究主要集中在三七的药用部位主根,本研究结果显示三七花蕾、叶中三七素含量较高,尤其是花蕾部位中含量达2.98%~3.33%。在2012—2013年,三七茎叶的年产量达800万kg,但其利用率却只有5%[22]。针对此三七花蕾、叶中三七素含量高,做到物尽其用,提高三七的综合利用率,为合理开发利用三七药用资源具有重要意义。
参考文献
[1] Kosuge T, Yokota M, Ochiai A. Studies on antihemorrhagic principles in the crude drugs for hemostatics. II. On antihemorrhagic principle in Sanchi Ginseng Radix[J]. Yakugaku Zasshi,1981, 101(7): 629-632.
[2] 赵国强, 王秀训. 三七止血成分dencichine[J].中草药, 1986, 17(6): 34-35.
[3] Yan Z Y, Spencer P S, Li Z X, et al. Lathyrus sativus (grass pea) and its neurotoxin ODAP[J]. Phytochemistry, 2006, 67(2):107-121.
[4] 郑毅男, 李向高, 帅 绯, 等. 人参属植物止血成分比较分析[J]. 吉林农业大学学报, 1989(1): 24-27, 102.
[5] Kuo Y H, Ikegami F, Lambein F. Neuroactive and other free amino acids in seed and young plants of Panax ginseng[J]. Phytochemistry, 2003, 62(7): 1087-1091.
[6] Koh H L, Lau A J, Chan E C. Hydrophilic interaction liquid chromatography with tandem mass spectrometry for the determination of underivatized dencichine (β-N-Oxalyl-L-α, β-diaminopropionic acid) in Panax medicinal plant species[J]. Rapid Communications in Mass Spectrometry, 2005, 19(10): 1237-1244.
[7] Qiao C F, Liu X M, Cui X M, et al. High-performance anion-exchange chromatography coupled with diode array detection for the determination of dencichine in Panax notoginseng and related species[J]. Journal of Separation Science, 2013,36(15): 2401-2406.
[8] 李向高, 郑毅男, 魏春雁. 人参止血成分的化学研究[J]. 吉林农业大学学报, 1989(2): 32-35, 122.
[9] 吴锦忠, 李向高, 杨继祥. 鲜人参与红参中氨基酸成分比较研究[J].中药材, 1990(5): 27-28.
[10] Geda A, Briggs C J, Venkataram S. Determination of the neurolathyrogen β-N-Oxalyl-l-α,β-diaminopropionic acid using high-performance liquid chromatography with fluorometric detection[J]. Journal of Chromatography A,1993, 635(2): 338-341.
[11] Chen X, Wang F, Chen Q, et al. Analysis of neurotoxin 3-N-oxalyl-L-2,3-diaminopropionic acid and its α-isomer in Lathyrus sativus by high-performance liquid chromatography with 6-aminoquinolyl-N-hydroxysuccin- imidyl carbam?ate(AQC) derivatization[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3383-3386.
[12] 朱 静, 刘三康, 付春梅, 等. 柱前衍生化高效液相色谱法测定三七及其制剂中三七素含量[J]. 中国中药杂志, 2006(22): 1865-1868.
[13] 杨玲娟, 高二全, 焦成瑾. 柱前衍生HPLC法测定三七中的三七素[J]. 资源开发与市場, 2015, 31(1): 1-3, 34.
[14] 宋丽丽, 张玉萍. HPLC-ELSD法测定三七中三七素的含量[J]. 北京中医药, 2010, 29(3): 216-217.
[15] 付春梅, 朱 静, 刘三康, 等. HPLC法测定三七及其制剂中三七素[J].中草药, 2006(1): 68-69.
[16] 刘 光, 刘云江, 胡炜彦. 高效液相色谱法测定三七芦头中三七素的含量[J]. 云南医药, 2009, 30(2): 203-204.
[17] 郑 萍. 毛细管区带电泳法测定三七药材中的三七素[J]. 华西药学杂志, 2012, 27(4): 453-454.
[18] 付春梅, 刘三康, 李章万. 多孔石墨化碳柱分析强极性化合物三七素[J]. 色谱, 2007(6): 834-837.
[19] 崔秀明, 徐珞珊, 王 强, 等. 三七中三七素的含量测定[J]. 中国药学杂志, 2005(13): 1017- 1019.
[20] 李 琳, 王承潇, 曲 媛, 等. 反相离子对色谱法测定三七中的三七素含量[J].中国中药杂志,2015, 40(20): 4026-4030.
[21] 张玉萍, 余 琼. 三七中三七素的提取分离及含量测定[J]. 山西中医, 2009, 25(10): 55-56.
[22] 周家明, 崔秀明, 曾鸿超, 等. 三七茎叶的综合开发利用[J]. 现代中药研究与实践, 2009, 23(3): 32-34.

