返魂草颗粒抗氧化部位分析及活性研究
贾东旭,唐 燕,周婷婷,王春驰,高 娜,朱迪夫,高其品,3*
(1.吉林大学生命科学院,长春 130012;2.吉林省吉测检测技术有限公司,长春 130117;3.长春中医药大学药学院,长春 130117)
返魂草(senecionis cannabifolii herba, SCH)又名青菀、紫倩等,为菊科千里光属多年生草本植物,主要分布在我国东北、西北和华北地区,具有抗病毒、抗菌、抗急性肺损伤、抗炎、抗氧化、镇痛、调节免疫、解热抗胃溃疡等活性,因此被广泛应用于止咳平喘、肺部急性炎症、慢性炎症的治疗,返魂草颗粒是由返魂草为原料经水提得到的的单方制剂[1-3];此外,祁海燕等[4]证明了以返魂草提取物为主要成分的返魂草颗粒(肺宁颗粒)可以上调AECOPD大鼠模型中超氧化物歧化酶(superoxide dismutase, SOD)水平,提示返魂草在抗氧化方面具有一定潜力,但目前对返魂草提取物中的抗氧化成分及其作用机制的研究还不深入。
酚酸(phenolic acids)是一类含有酚环的有机酸,主要存在于蔬果和谷物中,具有抗氧化,抗肿瘤,抗炎,杀菌,调节机体免疫力和保护心血管等生物功能[5,6]。陈萍红[7]采用LC-Q-TOF-MS和LC-IT-MS检测到肺宁颗粒中的87种成分里面有多种酚酸类成分,并对检测出11种物质具有抗炎活性,前期研究鉴定出返魂草提取物醇洗部分含有绿原酸等10种含量较高的酚酸,而目前,对返魂草中酚酸类物质的抗氧化组分和活性还不明确。16HBE细胞系为永生的人支气管上皮细胞,具有正常人呼吸道上皮细胞的功能,同时具有良好的遗传稳定性,被广泛应用于急性肺损伤、肺部炎症、氧化应激等方面的研究[8-9]。因此,本实验采用16HBE细胞系来研究返魂草颗粒的抗氧化活性及作用机制。
本研究利用1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除实验,确定返魂草抗氧化部位,并筛选出9种具有抗氧化活性的酚酸类物质,在此基础上更进一步研究返魂草的抗氧化活性,为返魂草颗粒在抗氧化和慢性支气管炎、喘息性支气管炎、急性呼吸道感染等抗炎方面的临床应用提供理论依据。
1 仪器与材料
1.1 实验仪器 BSA224S-CW型分析天平(德国赛多利斯股份有限公司),HH-2水浴锅(江苏省金坛市友联仪器研究所),UV-5100型紫外可见分光光度计(上海元析仪器有限公司),SW-CJ-2D双人净化工作台(苏州净化设备有限公司),MCO-230AICUVL-PC型二氧化碳培养箱(日本松下公司),iMark酶标仪(美国BIO-RAD),Ti-2型荧光倒置显微镜(日本尼康),普力菲尔分型超纯水机(上海富诗特仪器设备有限公司)等。
1.2 材料与试剂
1.2.1 材料 返魂草颗粒,由吉林益民堂制药有限公司提供(产地大兴安岭)。16HBE细胞系购自北纳生物创联生物技术研究院,资源编号BNCC338044。
1.2.2 试剂 D101大孔树脂、DPPH、Vc、无水乙醇、甲醇、95%乙醇、二甲基亚砜(国药集团化学试剂有限公司);DMEM培养基、胎牛血清、胰蛋白酶(美国Gibco公司);3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide)(MTT)(美国Sigma公司);ROS、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所);金丝桃苷、绿原酸、异槲皮苷、紫云英苷、原儿茶酸、异绿原酸A、异绿原酸B、异绿原酸C、隐绿原酸、隐绿原酸标准品(中国食品药品检定研究院)。
2 实验方法
2.1 返魂草提取物的分离 称取5 g返魂草颗粒,加蒸馏水适量溶解,注入稀释液至装有大孔树脂D101的柱子(2.5 cm×20 cm)中,用蒸馏水洗脱至溶液澄清,洗脱液浓缩,蒸干,得样I(SCHE-I)。再用60%乙醇洗脱大孔树脂柱,至溶液澄清,洗脱液浓缩,蒸干,得样 II(SCHE-II)。
2.2 返魂草抗氧化部分的筛选 按照文献[10]所述的方法,配制浓度为10~50 μg/mL的Vc溶液以及样品溶液,以维生素C(Vc)为对照,分别考察SCHE-I、II清除DPPH自由基的能力。取各对照品溶液和样品溶液2 mL与2 mL DPPH乙醇溶液混合摇匀,室温下放置30 min后测517 nm处的吸光值,记为A1;取各对照液和样品溶液2 mL与2 mL无水乙醇混合摇匀,室温下放置30 min后测定吸光度值,记为A2;以2 mL无水乙醇加入2 mL水混合摇匀作为空白调零,2 mL无水乙醇加2 mL DPPH乙醇溶液混合摇匀测定吸光度值,记为A0。根据以下清除率公式计算清除率:清除率(%)= [1 -(A1-A2)/A0]×100%
以浓度(μg/mL)为横坐标,清除率SA(%)为纵坐标作图,计算IC50值。
2.3 SCHE-II中抗氧化组分的筛选 按2.2操作方法,配制浓度为20~100 μg/mL的Vc溶液以及样品溶液。以Vc为对照液。测定和从SCHE-II中鉴别出含量较高的10种酚酸类物质清除DPPH自由基的能力。
2.4 16HBE细胞氧化应激模型的建立与评价 按照文献[11]所述方法,取处于对数生长期的细胞接种于96孔细胞培养板上,细胞密度为5~7×104个/mL,每孔100 μL。根据文献[12]报道,高温可以诱导细胞氧化应激和细胞凋亡,而48.3℃可以可以引起支气管受损,将其分为空白组和高温组(分别设50℃、54℃、58℃、62℃),每个温度设6个复孔,分别培养24 h、48 h。以细胞活力为指标通过MTT实验考察高温对16HBE的影响,并根据试剂盒说明书测定细胞上清液中SOD活力。
2.5 SCHE-II对高温诱导的16HBE细胞活力的影响 按2.4操作方法,分为空白组、模型组和SCHEII低、中、高剂量组,采用54℃处理模型组和给药组5 min后分别用37℃的完全培养基和含有SCHE-II浓度为0.1 mg/mL、0.25 mg/mL、0.5 mg/mL、0.75 mg/mL和1 mg/mL的完全培养基继续培养细胞24 h后测定细胞活力。
2.6 16HBE胞内活性氧簇水平检测 实验分组与2.5分组方法相同,将细胞接种于12孔板中,细胞密度为5×104~7×104个/mL,每孔1000 μL,培养24 h后,根据试剂盒说明书配制浓度为10 μmoL的工作液,每孔加100 μL于37℃避光孵育15~30 min,结束培养后用PBS清洗细胞3次,并向板内加入PBS溶液50 μL后于10×10倍镜下观察荧光强度并拍照。
2.7 样本制备和抗氧化指标测定 收集细胞上清液于4℃高速3000 rpm离心10 min,取上清保存于- 20℃,待测。根据试剂盒说明书测定细胞上清液中T-AOC、GSH水平和抗氧化酶SOD、CAT活力。
2.8 数据统计与分析 采用SPSS16.0处理数据,用均数±标准差()表示结果。利用T-Test实验检验显著性,当P<0.05时,数据有明显差异;当P<0.01时,数据有显著性差异,当P<0.001时,数据有极显著性差异。
3 实验结果
3.1 返魂草提取物对DPPH自由基清除率的检测结果 返魂草颗粒中水溶性和醇溶性部分(SCHE-I和SCHE-II)对DPPH自由基清除效果见表1。
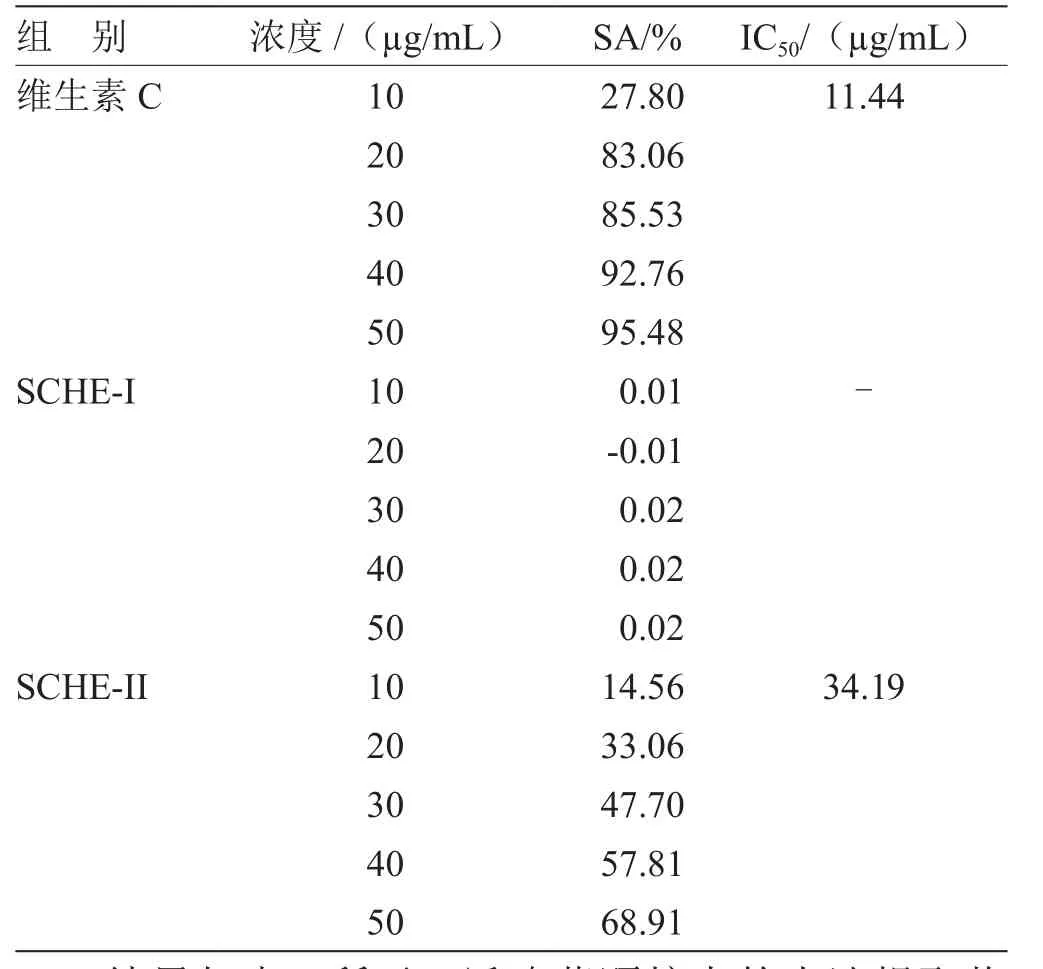
表1 SCHE对DPPH清除率的影响
结果如表1所示,返魂草颗粒中的水洗提取物SCHE-I在浓度10~50 μg/mL范围内无清除DPPH自由基的效果,而SCHE-II对DPPH的IC50为34.19%,其浓度为30 μg/mL时抗氧化能力与10 μg/mL的Vc相当。该结果说明,返魂草颗粒具有抗氧化功能,其中醇溶性部分为有效部位。
3.2 SCHE-II中10种组分单体对DPPH自由基清除率的检测结果 为了进一步分析返魂草中的有效抗氧化组分,选取已经被鉴定出的相对含量较高的10种酚酸类成分,以维生素C(Vc)为对照,分别考察其对DPPH自由基清除效果,实验结果见表2。
实验结果表明10种单体成分具有抗氧化作用,除紫云英苷单体其他9种单体化合物均具有较强的抗氧化能力,均与Vc的抗氧化能力相当。由此可见,SCHE-II表现出的抗氧化能力是多种组分协同作用的结果。
3.3 高温诱导16HBE氧化应激模型的评价 根据MTT实验和细胞上清液中SOD活力筛选建立16HBE细胞氧化损伤模型的温度,实验结果见表3。
由表3可知,高温建模温度在50~62℃范围内对细胞活力和SOD活力呈温度依赖性下降趋势。其中,50℃处理细胞后,16HBE细胞活力在48 h恢复到与37℃相当,而54℃、58℃和62℃均可以引起16HBE在48 h内细胞活力显著下降,为了避免过高温度引起细胞凋亡,采用54℃为建模温度。

表2 SCHE-II中各单体成分对DPPH清除率的影响
表3 高温对16HBE细胞活力及SOD活力的影响( ,n = 6)

表3 高温对16HBE细胞活力及SOD活力的影响( ,n = 6)
注:与空白对照组(37℃)比较,# P<0.05;## P<0.01;### P<0.001
组 别 24 h 48 h OD490 SOD/(U/mL) OD490 SOD/(U/mL)37℃组 0.649±0.041 172.4±10.8 0.681±0.066 160.8±5.1 50℃组 0.560±0.066# 165.8±12.1 0.646±0.080 154.6±4.9 54℃组 0.535±0.085## 132.0±7.4## 0.557±0.052### 120.8±8.4###58℃组 0.467±0.069### 128.1±14.6### 0.397±0.037### 97.4±10.5###62℃组 0.420±0.048### 110.8±8.3### 0.271±0.058### 102.9±2.4###
3.4 SCHE-II对高温诱导的16HBE细胞活力的影响 采用MTT实验测定SCHE-II对高温损伤后的16HBE细胞活力的影响。根据图1可知,经过高温处理后,模型组细胞活力较空白组显著下降(P<0.01),经过SCHE-II治疗后,细胞活力较模型组发生显著提升:其中,提取物浓度为1 mg/mL和0.1 mg/mL时细胞活力较模型组没有显著变化;提取物浓度在0.75~0.25 mg/mL范围内可以有效恢复由高温诱导的16HBE细胞活力下降的问题。根据细胞活力测定结果,确定SCHE-II作用浓度为0.25 mg/mL,0.5 mg/mL和0.75 mg/mL。
3.5 SCHE-II对16HBE胞内氧化应激水平的影响 为了考察返魂草提取物对16HBE胞内的氧化应激水平的影响,进行DCFH-DA染色实验。活性氧分子(reactive oxygen species, ROS)是氧代谢过程的副产品,在氧化应激阶段,ROS水平显著增加,进而导致细胞结构的重大破坏[13]。ROS测定结果见图2,绿色荧光强度代表ROS水平,模型组细胞数量较其他组有明显减少现象,并且在ROS水平较空白组显著增加;而SCHE-II剂量依赖性降低16HBE细胞内由高温引起的氧化应激状态。3.6 SCHE-II对16HBE中抗氧化活性物质的影响 根据表3可知,16HBE经过54℃高温培养基孵育5 min后,细胞的总抗氧化能力(T-AOC)、抗氧化酶SOD和CAT以及抗氧化物还原型谷胱甘肽(GSH)较空白组均有明显下降(P<0.05),说明高温可以诱导16HBE细胞氧化水平增加。与模型组相比,16HBE细胞经过SCHE-II孵育24 h后,各项抗氧化指标均以剂量依赖性方式显著提升,其中SCHE-II对SOD活力作用最显著,可以将SOD活力提升至空白组的5倍以上。

图1 SCHE-II对高温诱导的16HBE细胞活力的影响

图2 SCHE-II对16HBE胞内ROS水平的影响(100×,比例尺100 μm)
表3 SCHE-II对16HBE中抗氧化酶和GSH的影响( ,n = 3)

表3 SCHE-II对16HBE中抗氧化酶和GSH的影响( ,n = 3)
注:与空白组比较,# P<0.05,## P<0.01, ### P<0.001;与模型组比较,△△ P<0.01,△△△P<0.001
组 别 T-AOC/mM SOD/(U/mL) CAT/(U/mL) GSH/(μmol/L)空白组 0.118±0.087 159.6±17.9 116.1±10.3 68.4±13.2模型组 0.077±0.121### 123.8±12.5# 88.5±15.0## 58.2±4.20#SCHE-110.25 mg/mL 0.090±0.088△△ 839.3±84.5###△△△ 104.9±16.2△△ 60.6±3.31 SCHE-110.50 mg/mL 0.116±0.113△△△ 984.3±47.7###△△△ 120.1±8.9△△△ 80.7±6.34△△SCHE-110.75 mg/mL 0.125±0.206△△△ 1292.1±21.6###△△△ 132.6±12.8#△△△ 93.5±8.54##△△△
4 讨论
本研究通过DPPH自由基清除实验筛选出返魂草颗粒有效的抗氧化部位为60%乙醇洗脱D101大孔树脂得到的提取物(SCHE-II),其对DPPH自由基清除作用的半数抑制浓度(IC50)为34.19 μg/mL。经前期实验鉴定,SCHE-II中金丝桃苷、绿原酸、异槲皮苷、原儿茶酸、异绿原酸A、异绿原酸B、异绿原酸C、隐绿原酸、新绿原酸等9种含量较高的酚酸组分对DPPH的IC50均在10~15 μg/mL之间,具有与Vc相当的抗氧化活性。
SCHE-II在16HBE氧化损伤模型中发挥较强的抗氧化作用。通过54℃高温孵育5 min可以使16HBE细胞活力和SOD活力下降至80%左右,造成细胞的氧化损伤。SCHE-II以剂量依赖性降低高温诱导的16HBE胞内氧化应激水平,显著增加细胞的总抗氧化能力,并提升细胞GSH水平和SOD及CAT活力。GSH是机体内含量最高的非酶性抗氧化物,能够防止活性氧对细胞的损伤[14,15],而SOD和CAT作为抗氧化酶在机体内可以通过氧化还原反应抑制自由基氧化损伤,达到预防氧化应激所造成的各种老化性疾病[16]。另外,氧化应激还参与细胞及机体的炎症、凋亡、免疫调节等生理活动,特别是免疫系统细胞更易因氧化应激遭受损伤,导致机体稳态平衡的破坏[17,18],此外,氧化应激反应是炎症反应的一部分,其会导致中性粒细胞炎性浸润,进而诱导局部炎症[19,20]。
由此提示,返魂草提取物可有效改善支气管上皮细胞的氧化应激状态,提升抗氧化酶活力和机体的自由基清除能力,为明确返魂草抗氧化的功效物质基础以及在抗氧化和抗炎方面的开发应用提供了理论基础。

