电针对抑郁模型大鼠不同脑区miRNA-16及5-羟色胺转运体的影响*
赵 俊,田会玲,李昱颉,罗 彤,艾丽雅,房毓敏,赵江豪,赛音朝克图,李志刚△
(1.北京中医药大学,北京 100029; 2.内蒙古自治区国际蒙医医院,内蒙古 呼和浩特 010065)
抑郁症(depression),在临床属于精神类疾病。由生物学因素、个体性格因素和社会心理因素综合作用的结果,正是由于复杂的病因,使得抑郁症的治疗变得非常棘手。多数患者主要表现为持续的心情低落、喜欢独处、焦虑和认知能力下降、自杀率高等,给患者和家庭带来了严重经济负担和精神压力[1]。目前,全球约有3.5亿人患有抑郁症[2],世界卫生组织(WHO)预测到2030年抑郁症将会成为全球疾病的头号杀手[3],严重威胁人类的身心健康。
上个世纪50年代,有人提出了抑郁症的“单胺代谢异常假说”,认为抑郁症的病因可能是神经突触间的单胺递质浓度不足所致,进一步认为增加突触间隙神经递质的含量是临床治疗抑郁症的快速有效途径之一。目前临床治疗的相关药物大多基于单胺类假说设计,并且已观察到抑郁症患者大脑内的5-HT含量明显低于正常人[4]。
microRNA(miRNA)是一类内源性非编码的单链RNA,广泛存在于真核生物细胞中[5]。其可通过与靶基因mRNA3′非翻译区(3′- untranslated region,UTR)结合,引起mRNA的降解,或者影响翻译抑制,从而调节相应蛋白的表达。研究还发现一些miRNA特异性的在大脑中表达[6-7],在神经元可塑性特别是中枢神经系统发育等方面发挥着特殊作用。miRNA-16等作为5-HT系统上游的miRNA,成为潜在的抗抑郁靶点。
此外,Baudry[8]首次揭示了miRNA-16在氟西汀发挥抗抑郁效应中的关键角色 :通过上调 miRNA-16,进而抑制5-羟色胺转运体(SERT)表达,改善抑郁样大鼠行为。
基于此,本课题主要研究电针对CUMS抑郁模型大鼠海马、中缝核miRNA-16表达的影响,并探讨其5-HT系统尤其是对SERT的调控机制。现将研究结果汇报如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年健康雄性SD大鼠40只,体质量为(180±20)g。由北京维通利华实验动物公司提供,合格证编号 :SCXK(京)2016-0006。饲养在北京中医药大学动物实验中心,饲养室自然光照,通风良好,温度(22±2)℃,相对湿度RH(35±2)%,条件相对较为稳定。饲养7天以适应环境。
1.1.2 实验试剂及药物 盐酸氟西汀胶囊(批号 :J20170022,礼来苏州制药有限公司);miRNA提取试剂盒(QIAGEN公司,批号 :148013644);miRNA反转录试剂盒(ABI公司,批号 :1405269);蛋白质分子量Marker(美国Bio-rad,批号 :310007919);SYBR mix试剂盒(罗氏公司,批号 :39088900);PVDF膜(德国Millipore,批号 :K1EA1531FK);感光胶片(美国柯达,批号 :020901701);SERT一抗(美国abcam公司,货号 :ab130130);GAPDH一抗(美国abcam公司,货号 :ab8245);辣根过氧化物酶标记兔抗山羊IgG(北京中杉金桥生物技术有限公司,批号 :127917)。
1.1.3 主要仪器 根据Weaver[9]的实验方法,强迫游泳桶(高为50 cm,直径为25 cm的圆柱形)。针具 :选用0.25 mm×25 mm型中研太和牌一次性针灸针;韩氏电针仪(LH202,北京华卫产业有限公司);Real-Time PCR仪(美国ABI 7500);稳压稳流电泳仪(美国Bio-Rad);垂直电泳槽(美国Bio-Rad);紫外分光光度计(德国Eppendorf)。
1.2 分组、造模及干预方法
40只实验大鼠,按照随机数字表法分为正常对照组、模型组、氟西汀组、电针组,共4组,每组10只。
除正常对照组大鼠群养以外,其余各组须单笼孤养,并结合慢性不可预见性温和应激方法[10]制备抑郁大鼠模型,即每天随机安排1种应激方式,刺激顺序随机抽签产生,同一刺激不能连续应用,持续28天。分别为 :禁食24 h;禁水24 h;4 ℃冷水游泳5 min;昼夜颠倒24 h;夹尾3 min;潮湿环境24 h;束缚3 h。
所有干预均于每日上午10点进行,具体操作为 :正常组正常饲养,自然饮水食,不接受刺激;模型组每日接受随机慢性应激造模刺激处理;氟西汀组每日应激刺激后1 h,用生理盐水配制1 mg/mL的氟西汀,按照2 mg/kg灌胃给药;电针组应激刺激1 h后,固定于自制鼠套中,参照张露芬[11]主编《实验针灸学》选取相当于人体解剖部位的“百会”穴和“印堂”穴,局部消毒后,选用0.25 mm×25 mm一次性针灸针刺激,针刺深度为5~10 mm,“印堂”向鼻部方向刺入,“百会”穴向后头部刺入,小幅度轻捻转后,针柄接韩氏电针仪,选用连续波,频率设为2 Hz,电流强度1 mA,以引起大鼠头部肌肉轻微颤动而不嘶叫为宜,留针20 min,每天1次,连续28天。
1.3 检测方法
1.3.1 强迫游泳试验 通过记录大鼠在水中被动漂浮时间,评价大鼠的绝望水平。适应性训练1天后 :将大鼠放入强迫游泳桶中(直径25 cm,高50 cm)强迫游泳6 min。于第2天的同一时间,将大鼠再次放入同一游泳桶中,为避免主观因素干扰,实验时应保持安静,采用盲法,将大鼠头部面向桶壁缓慢放入桶内,通过摄像机拍摄测试视频并记算大鼠强迫游泳6 min,后4 min内不动时间(即被动漂浮,受试大鼠仅有尾巴和前爪小幅度轻微运动)的时间。每只大鼠测试后,须更换清水再进行下一只大鼠的试验。于应激前1天、应激后1天进行2次强迫游泳试验并记录数据。
1.3.2 RT-PCR技术 实验第29天,大鼠称重后予10%水合氯醛(0.4 mL/100 g)腹腔麻醉后迅速断头,在冰浴状态下祛除颅骨,暴露脑组织,取出海马、中缝核,分装在编号的冻存管中,迅速放入-80℃冰箱中冻存。按照相应试剂盒说明,采用RT-PCR技术进行指标检测。
miRNA提取试剂盒(QIAGEN公司)提取海马、中缝核总RNA,用nanodrop(美国thermo scientific 公司)测定其浓度及纯度;取2 μg RNA进行反转录,获得的cDNA用于下一步的实时定量荧光PCR扩增。实时定量荧光PCR扩增程序为: 预变性 94℃ 10 min;PCR反应:94℃ 15 s,60℃ 60 s,循环45次。用2-ΔΔCT公式计算各个样本目的基因的表达变化,并通过标准曲线法获得每个样本的miRNA-16含量,所得数据用对应的U6进行校正。引物序列见表1。

表1 RT-PCR引物序列
1.3.3 Western blot法测定 将海马、中缝核组织从液氮中取出,放入预冷的研钵中进行快速研磨,然后将粉末装入预冷的EP管中,每管加入细胞裂解液50 uL,冰上放置20 min。然后4℃,10 000 r/min离心10 min,将上清移至另一预冷的EP管中,沉淀弃之,BCA法测定蛋白含量后,将剩余蛋白样品加入等体积的2×SDS上样缓冲液,沸水中煮5 min。再进行制胶和上样、电泳、蛋白质的电转移和膜封闭;封闭结束后,用TBS-T漂洗液洗膜10 min×3次,将膜移入杂交袋中,加入用适当漂洗液稀释的抗体(SERT为1∶1 000;GAPDH为1∶5 000),封口,4℃孵育过夜;再用大量TBS-T漂洗液洗膜10 min×3次,然后将PVDF膜移入另一新的杂交袋,加入漂洗液稀释的辣根过氧化物酶标记的二抗(SERT为1∶2 000;GAPDH为1∶10 000),37℃振荡60 min,大量TBS-T漂洗液洗膜10 min×3次;滴加ECL发光液,于凝胶成像仪上采集分析数据。
1.4 统计学方法

2 实验结果
2.1 强迫游泳试验情况
实验应激前1天,各组间大鼠强迫游泳后4 min不动时间均无显著性差异(P>0.05)。实验应激结束后1天,与正常对照组比较,模型组后4 min不动时间延长(P<0.01),大鼠提前表现绝望;与模型组比较,氟西汀组和电针组不动漂浮时间减短(P<0.05),大鼠延迟放弃挣扎,表现较活跃。见表2。
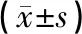
表2 各组大鼠应激前后强迫游泳后4 min不动时间比较
注:与正常对照组比较,*P<0.01;与模型组比较,#P<0.05;与氟西汀组比较,△P<0.05。
2.2 RT-PCR结果
与正常对照组比较,模型组大鼠中缝核miRNA-16含量升高(P<0.01),差异有统计学意义;与模型组比较,氟西汀组和电针组miRNA-16含量降低(P<0.05);与氟西汀组相比较,电针组miRNA-16含量显著降低,差异有统计学意义(P<0.05)。见图1。

注 :与正常对照组比较,*P<0.01;与模型组比较,#P<0.05;与氟西汀组比较,△P<0.05。图1 各组大鼠中缝核miRNA-16的相对表达量
与正常对照组比较,模型组大鼠海马miRNA-16含量升高(P<0.01),差异有统计学意义;与模型组比较,氟西汀组miRNA-16含量降低(P<0.05),电针组miRNA-16含量也降低(P<0.05);与氟西汀组相比较,电针组miRNA-16含量降低,但无统计学差异(P>0.05)。见图2。

注 :与正常对照组比较,*P<0.01;与模型组比较,#P<0.05。图2 各组大鼠海马miRNA-16的相对表达量
2.3 Western blot结果
与正常对照组比较,模型组大鼠中缝核SERT蛋白表达升高,差异有统计学意义(P<0.01);与模型组比较,氟西汀组表达无统计学差异(P>0.05);与模型组比较,电针组SERT含量有所下降,差异有统计学意义(P<0.05);电针组与氟西汀组相比较,表达无统计学差异(P>0.05)。见图3、图4。

注 :与正常对照组比较,*P<0.01;与模型组比较,#P<0.05。图3 各组大鼠中缝核SERT蛋白的相对表达量
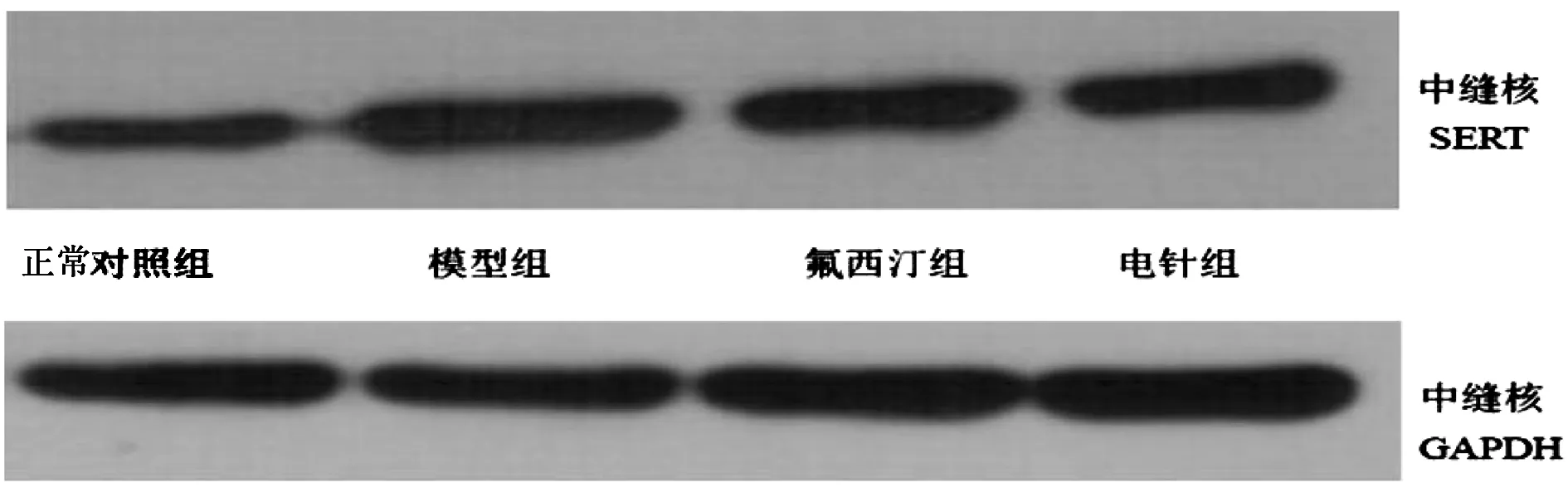
图4 各组大鼠中缝核SERT蛋白表达含量比较
与正常对照组比较,模型组大鼠海马SERT蛋白表达升高,差异有统计学意义(P<0.01);与模型组比较,氟西汀组表达无统计学差异(P>0.05);与模型组比较,电针组SERT含量有所下降,差异有统计学意义(P<0.05);电针组与氟西汀组相比较,表达无统计学差异(P>0.05)。见图5、图6。

注 :与正常对照组比较,*P<0.01;与模型组比较,#P<0.05。图5 各组大鼠海马SERT蛋白的相对表达量

图6 各组大鼠海马SERT蛋白表达含量比较
3 讨论
关于抑郁症,普遍认为是一种涉及多系统、多通路的疾病。《素问·六元正气大论》认为土郁、木郁、金郁、火郁、水郁皆可致郁,并提出“郁极而发,待时而作”。《素问·本病论》曰 :“人忧愁思虑即伤心”。金元时期,朱震亨提出“六郁”之说,气、血、痰、湿、火、食的六郁理论。直至明代《医学正传·郁证》才首提“郁病”病名,认为郁病是包括情志、外邪、饮食等因素所致的广义的郁。故情志之郁,在中医中属于狭义的“郁病”范畴。
病位初起脾胃,后及心脑、肝胆,终及于肾。病因多为思虑不遂,忧思伤脾,日久导致气机郁滞、气血生化乏源、阴阳失调,其核心病机为心血不足。中医辨治抑郁症,可涉及心、肝、脾、肾、脑,而脑属肾,属水。督脉,中也,起源于胞中,行于脊背正中,上达到巅顶穴,是阳脉之总纲,与脑的关系密切。百会和印堂为督脉的要穴,百会为一身之宗,百神之会也,且是足太阳膀胱经的交会穴,并因太阳膀胱经上的背俞穴(如心俞、肝俞、脾俞、肾俞;神堂、魂门、意舍)而与五脏六腑关系密切,故能调和五脏神志,协调阴阳,通调髓海,大有百脉朝宗之效。而印堂穴具有安神醒脑、益智定惊之功。正所谓“经脉所过,主治所及”,因此选取督脉上的大穴对与脑有关的神志疾病有一定的治疗作用,符合中医治病必求于本之说[12]。
虽然抑郁症发病机制不明确,但病理因素与中枢神经递质密切相关。现代研究表明电针印堂穴后,神经冲动可直接入脑,引起单胺类等神经递质的释放[13],从而产生抗抑郁效应;电针百会穴能兴奋上行激活系统[14],进而解除脑细胞的抑制状态。神经递质是中枢神经系统中传递神经冲动的化学介导物质,主要包含单胺类,如五羟色胺(5-HT)等参与了中枢神经系统的生理反应[15]。SERT是一种对5-HT有高亲和力的跨膜转运蛋白,存在于大脑边缘系统、肥大细胞、胃肠道嗜铬细胞膜和5-HT能神经元的突触上[16],神经末梢突触前膜分布较为广泛。它从神经末梢突触间隙中重新再摄取5-HT进入突触前神经元进行转输,直接影响着突触间隙5-HT的浓度及作用时间,从而有效终止了5-HT的信号传递[17]。5-HT再摄取抑制剂(SSRIs)氟西汀是临床治疗抑郁症的重要药物。已有研究发现[18],经过长期氟西汀治疗后,抑郁模型大鼠中缝核的miRNA-16表达水平有所升高,而SERT蛋白水平却降低了;而将氟西汀注入中缝核区,与注射前比较,该区miRNA-16的水平亦升高。另外,向大鼠中缝核注入miRNA-16,可观察到抑郁模型小鼠抑郁样行为的改善现象[8]。宋明芬等[19]建立大鼠抑郁模型,测定中缝核SERT水平,将其与对照组进行比较,结果表明,中缝核SERT高于对照组。
综上,可以假设miRNA-16调节SERT表达的重要部位是中缝核,或者说中缝核在参与miRNA-16调节SERT的过程中发挥重要作用,miRNA-16可能通过影响中缝核SERT功能发挥其在抗抑郁药疗效以及抑郁症发病机制中的作用。但张逸等[20]在母爱剥夺模型组大鼠海马中发现miRNA-16的相对表达量明显高于对照组。另有一项研究中[21],经过长期治疗,氟西汀能降低小鼠海马miRNA-16。朱维煜等[22]在讨论miRNA-16对5-HT再摄取的研究中,发现模型组海马miRNA-16低于正常组,而经氟西汀治疗后,大鼠海马内miRNA-16有所升高。基于不同模型不同部位miRNA-16表达的结果不同,Launay等[23]鉴定出作用于中缝核5-HT能神经元的氟西汀可降低海马中miRNA-16的表达水平,且氟西汀的作用与海马中miRNA-16的变化相当。
因此,设计实验研究,以氟西汀为药物对照组,对比电针组治疗后调控不同脑区miRNA-16表达水平与SERT的关系,以此来参照判定电针治疗抑郁症的可能机制及治疗效果。
研究结果显示,模型组大鼠中缝核、海马SERT含量升高,表现抑郁样行为。而电针组一方面可明显改善抑郁大鼠的行为学,另一方面降低了大脑SERT含量。这可能是电针抗抑郁症的作用途径之一,即电针能抑制脑区SERT的表达,进而减弱对突触间隙5-HT的重摄取,细胞外的5-HT浓度回升表现出抗抑郁作用。但模型组miRNA-16在中缝核和海马区均升高,经过氟西汀和电针干预后,miRNA-16的表达水平下降。
分析本研究的结果 :①未探索抑郁模型大鼠海马和中缝核miRNA-16水平改变的可能原因 :在机体反馈机制作用下,电针从基因水平上下调中缝核miRNA-16,使SERT表达逐渐降低,对5-HT重摄取减弱,海马细胞外5-HT增多,继而海马miRNA-16也下调,降低海马SERT的表达;②未比较抑郁模型大鼠不同时间节点海马和中缝核miRNA-16水平差异,miRNA-16可能作为辅助确诊抑郁症的指标之一,但miRNA-16的变化是否是一个动态的过程,而经过长时间的干预后,应激状态下的miRNA-16达到峰值;③miRNA-16的靶基因不确切,是否还经过其他通路调控SERT。
此外,张艳华等[24]通过对抑郁症患者尸脑和抑郁动物模型的研究表明,miRNA对突触可塑性、信号转导通路关键性元件的基因表达调控有重要影响。而miRNA-16除能影响5-HT系统SERT蛋白基因的表达水平外,与抑郁症的神经可塑性是否有关联。国内尚没有从神经可塑性的角度研究miRNA-16表达与抑郁症的关系,因此,拟从miRNA-16与抑郁症的关联性出发,为揭示针刺治疗抑郁症的新机制作一尝试值得深入研究。

