运动和魔芋多糖对改善2型糖尿病大鼠糖脂异常及骨代谢的机制研究
李寿邦 阮凌
摘 要:探討运动和魔芋多糖对2型糖尿病(T2DM)大鼠血糖、血脂、血清骨代谢标志物、骨细胞形态结构及骨代谢蛋白相关表达的影响。方法:将SPF级雄性SD大鼠分为普通安静对照组(NC)、2型糖尿病模型组(DM)、2型糖尿病运动组(DE)、2型糖尿病魔芋多糖组(DK)和运动联合,魔芋多糖干预组(EK),共5组。运动组每次运动时间60 min,每周运动5 d,共计8周。魔芋多糖饲料喂养组,共计8周。干预8周后测试血糖、血脂指标、血清胰岛素、胰岛素样因子-1(IGF-1)、血清骨代谢标志物及骨密度;通过电镜观察成骨细胞和破骨细胞形态和结构;采用Western-blot方法检测骨骼肌中骨代谢相关蛋白IRS-1和IRS-2蛋白表达。结果:与DM相比,所有干预组2型糖尿病大鼠血清TG、TC、FFA含量均降低且血清骨钙素和瘦素水平增加,联合干预组BMD含量增加;与DM相比,上调IRS-2蛋白表达,下调IRS-1蛋白表达,增加钙质的沉积。综合各指标发现,DE较DK效果好,而EK则优于其他各组。结论:1)运动和魔芋多糖单独或联合干预均可降低血糖、血脂,提高血清骨钙素和瘦素水平,其中仅有联合干预组BMD含量提高。2)通过运动和魔芋多糖干预,电镜观察骨细胞凋亡数目一定程度上减少,其中联合干预组效果最好。3)运动和魔芋多糖一定程度上调节血清骨形成的标志物水平,其机制可能是运动和魔芋多糖通过上调IRS-2蛋白表达,下调IRS-1蛋白表达,提高胰岛素的敏感性,降低血糖,促进细胞对钙的摄取,提高骨钙素水平和增加钙质的沉积,从而在一定程度上提高2型糖尿病大鼠的骨密度。
关键词:运动;魔芋多糖;2型糖尿病;骨代谢
中图分类号:G 804.7 学科代码:040302 文献标识码:A
Abstract:Objective: To study the effects of exercise and konjac polysaccharide on blood glucose, and blood lipid metabolism, serum bone metabolism markers, bone cell morphology and related the bone metabolism protein expression in type 2 diabetes(T2DM) rats. Methods: SPF male Sprague Dawley rats were divided into normal control group (NC), type 2 diabetes control group (DM), type 2 diabetes with exercise group(DE), type 2 diabetes with konjac polysaccharide group (DK), type 2 diabetes with konjac polysaccharide and exercise intervention group(EK). 60 min per day and 5 days per week for 8 weeks in exercise groups. Konjac polysaccharide groups feed for 8 weeks. Blood glucose, serum insulin, insulin-like growth factor-1, serum lipids, bone metabolic markers and bone mineral density were measured after 8 weeksintervention. Osteoblasts and osteoclasts were observed by a transmission electron microscope. The protein expression of IRS-1 and IRS-2 in skeletal muscle was detected by Western-blot. Results: Compared with the DM group, TG, TC, FFA levels and the protein expression of IRS-1 were reduced and serum osteocalcin, leptin levels and the protein expression of IRS-2 were increased in the other groups, while the content of BMD was increased in the EK group; compared with DM, the expression of IRS-2 protein was increased, IRS-1 protein decreased, and calcium deposition increased, and the index of the DE group is better than the DK group, while that of EK group was superior to other groups. Conclusions: 1) Exercise and konjac alone or in combination group could reduce blood glucose and blood lipids and serum osteocalcin and leptin levels were increased, and the contents of BMD were increased only in the EK group. 2)In DK, DE and EK groups the apoptosis of bone cell was reduced. Moreover, the EK group had the best effect. 3)The possible mechanism of bone metabolism was improved by exercise or konjac which due to the increasing the protein expression of IRS-2, and decreasing IRS-1, increasing insulin sensitivity, and decreasing blood glucose levels, so as to promote the uptake of calcium by cells, then increase BGP, calcium deposition, and increase bone mineral density in type 2 diabetic rats.
1.6.5 蛋白免疫印记检测蛋白表达
采用western blot检测各组大鼠骨骼肌中的IRS-1和IRS-2蛋白表达情况,每100 mg股四头肌组织中加入1 mL的RIPA和10 μL 100 mmol/L的PMSF和10 μL的磷酸酶抑制剂。匀浆机匀浆后将样品高速离心,将上清移到干净无菌离心管中,置于-20 ℃冰箱保存。取肌肉组织裂解液,并加电泳上样缓冲液,电泳(5%浓缩胶90 V,12%分离胶110 V,不恒定电流),约1.5 h,取分离胶进行转膜(90 V,90 min),然后打开电转仪,取出硝酸纤维膜(NC),去离子水洗涤,洗液平衡后用5%脱脂奶粉(TBS稀释)室温封闭30 min,加已稀释好的鼠抗兔抗IRS-1和IRS-2(美国Santa Cruz公司),4 ℃过夜,PBS洗膜,再加5 mL的1:5 000稀释(稀释液含2%脱脂奶粉)羊抗兔二抗(广州威佳),37 ℃反应1 h,把NC上PBS吸干,加入ECL化学发光试剂,完全浸透后,放于胶片上,盖上保鲜膜,放入X射线暗盒,应用Quantity One凝胶电泳图像软件系统分析,以胶片中(蛋白条带中的灰度值/内参β-action灰度值)的比值大小表示。
1.7 数据处理
采用软件SPSS 20.0进行试验数据统计分析,实验结果用平均数±标准差(M±SD)表示,采用双因素方差分析,P<0.05为差异具有显著性,P<0.01为差异具有非常显著性。
2 结果
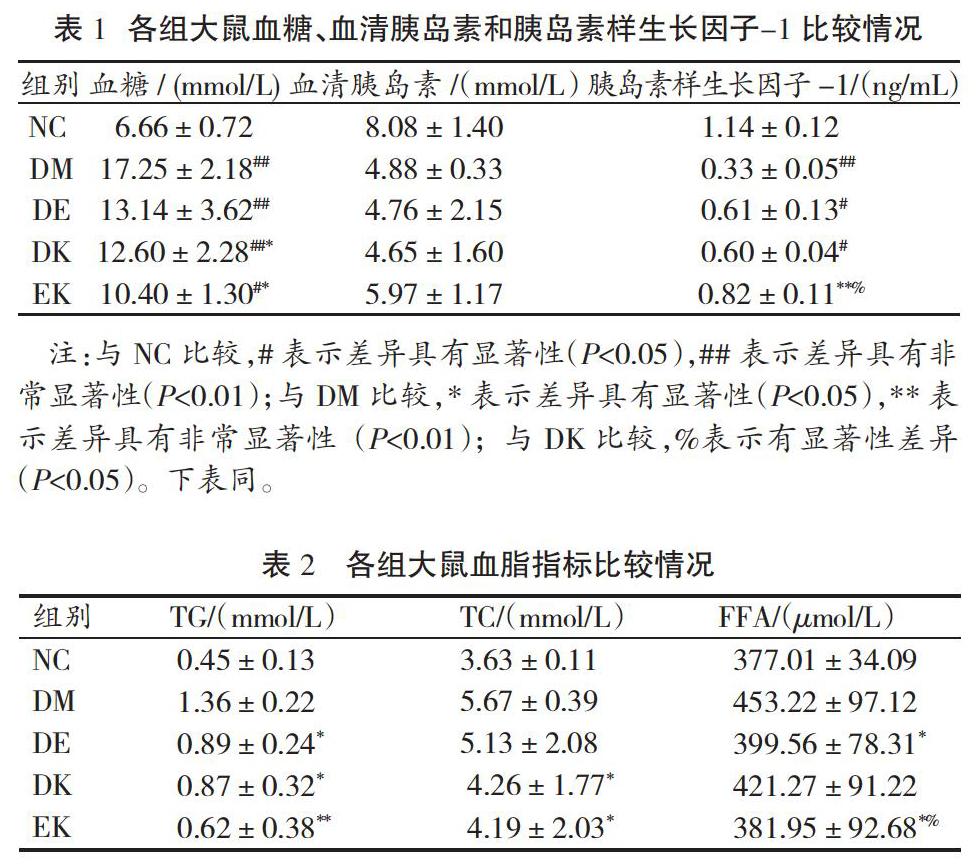
2.1 各组大鼠血糖、血清胰岛素和胰岛素样生长因子-1比较
如表1所示,与NC比较,DM、DE、DK大鼠血糖指标均非常显著升高(P<0.01),EK大鼠血糖指标显著升高(P<0.05);与DM相比,DE和EK大鼠血糖均显著降低(P<0.05)。各组血清胰岛素水平未见显著差异(P>0.05)。与NC比较,DM大鼠胰岛素样生长因子-1非常显著降低(P<0.01),DE和DK大鼠胰岛素样生长因子-1显著降低(P<0.05);与DM相比,EK大鼠胰岛素样生长因子-1非常显著升高(P<0.01);与DK相比,EK大鼠胰岛素样生长因子-1显著升高(P<0.05)。
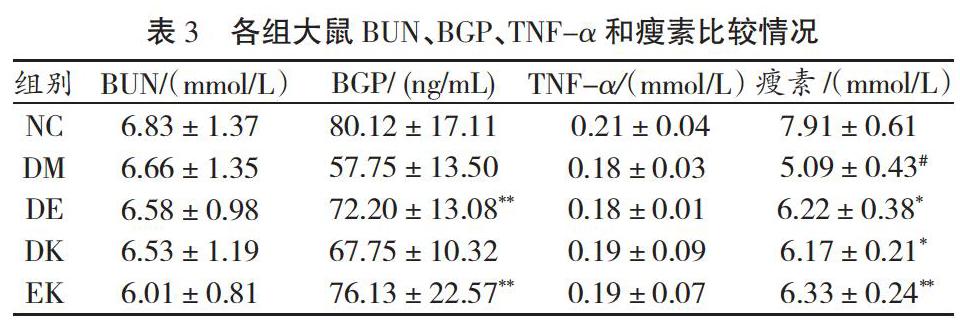
2.2 各组大鼠血脂比较
如表2所示,与DM比较,其他各组大鼠TG、TC和FFA均降低。与DM比较,DE和DK 大鼠TG显著降低(P<0.05),EK大鼠TG非常显著降低(P<0.01);与DM比较,DK和EK大鼠TC显著降低(P<0.05);与DM比较,DE和EK大鼠FFA显著降低(P<0.05)。与DK比较,EK大鼠FFA显著降低(P<0.05)。
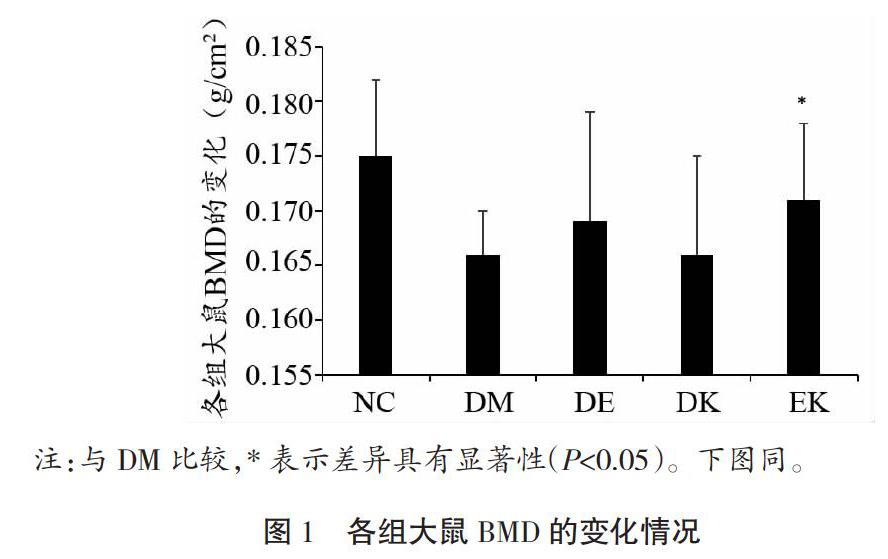
2.3 各组大鼠BUN、BGP、TNF-α和瘦素比较
如表3所示,与NC比较,其他各组大鼠BUN虽有降低(联合干预组降低最明显),但各组间未见显著性差异(P>0.05)。与DM比较,DE和EK大鼠BGP非常显著升高(P<0.01)。与NC比较,其他各组大鼠TNF-α未见显著性差异(P>0.05)。与NC比较,DM大鼠瘦素显著降低(P<0.05);与DM比较,DE和DK大鼠瘦素显著增加(P<0.05),而EK大鼠瘦素非常显著增加(P<0.01)。
2.4 各组大鼠BMD比较
与NC比较,各组大鼠BMD虽然降低,但未见显著性差异(P>0.05);与DM比较,DE、DK大鼠BMD虽增加,但未见显著性差异(P>0.05),EK大鼠BMD显著增加(P<0.05),如图1所示。
2.5 各组大鼠成骨细胞的变化情况
NC成骨细胞结构完整,凸起明显,如图2A所示;DM骨细胞出现凋亡,如图2B所示;其他各组较DM骨细胞凋亡程度有所改善,如图2(C-E)所示。
2.6 各组大鼠破骨细胞变化情况
NC破骨细胞含少量黑色溶酶体,如图3A所示;DM 破骨细胞含大量溶酶体、核膜不完整,如图3B所示;其他各組破骨细胞胞浆均含有大量溶酶体,如图3(C-E)所示。
2.7 各组大鼠骨骼肌IRS-1和IRS-2蛋白表达比较
与DM比较, EK大鼠IRS-1蛋白表达显著降低(P<0.05)。与DM比较,EK大鼠IRS-2蛋白表达显著升高(P<0.05)。
3 讨论
3.1 运动和魔芋多糖对2型糖尿病大鼠糖脂代谢的影响
有研究表明,不良的生活方式诱发的2型糖尿病占糖尿病发病率的90% [12-13]。2型糖尿病治疗的核心目标是:降低血糖,改善血脂,同时减少其他并发症的发生。因此,通过改变生活方式,包括运动和饮食等对2型糖尿病的治疗具有重要意义。最新研究显示,运动可以有效降低2型糖尿病血脂和血糖水平[14-15]。国外最新Meta分析研究[16]和国内学者吴志建等[17]的Meta分析显示出同样的结果。魔芋多糖是一种从魔芋精粉中提取的天然植物多糖,是一种可溶性的优质膳食纤维[18-20],它的降糖、减脂和润肠通便作用已被很多研究所确定[21-22]。关于魔芋多糖的降糖、降脂原理,目前认为是,魔芋多糖吸水膨胀,充盈胃肠道,减少食物摄入,黏附营养素,有利于代谢物的排出,有关证据支持膳食纤维改善代谢的作用[23-24]。
本研究根据运动和魔芋多糖的特性,对2型糖尿病大鼠进行单独或联合干预。前文表1和表2显示,2型糖尿病大鼠机体血糖、血脂代谢明显异常,表现为血糖、TG、TC和FFA等指标显著高于对照组;与2型糖尿病组相比,各干预组大鼠血糖、TG、TC和FFA均降低。同时魔芋多糖干预改善血糖和血脂水平,其中联合干预组改善效果具有叠加作用。
2型糖尿病导致患者骨代谢紊乱、骨质疏松或骨折,究其原因可能是:高血糖抑制细胞对钙的摄取,钙质沉积减少,最终导致骨密度下降,同时,高血糖抑制IFG-1的合成和释放。有研究显示,糖尿病大鼠成骨细胞数目正常,但骨矿物质有损伤,与骨软化相似,提示胰岛素不足是糖尿病合并骨质疏松的主要原因,胰岛素对骨合成代谢起重要作用[25]。Bowman等[26]研究发现,胰岛素缺乏受体时,成骨细胞分化严重受损,细胞凋亡明显增多,胰岛素信号作用于成骨细胞,促进骨的形成,同时促成骨钙素生成,而骨钙素通过调节胰岛素的敏感性,促进胰腺胰岛素的分泌,从而保持人体内的糖平衡。本研究中,大鼠胰岛素水平各组间并无显著性变化。胰岛素样生长因子-1被认为是骨代谢的关键调节因子,增加基质中的骨沉积和成骨细胞募集,并减少骨质丢失和胶原纤维的破坏[27]。临床上使用控制IGF-1释放的药物作为治疗骨质流失的方法之一[26]。 除IGF-1外,胰岛素也具有促进成骨的作用[28]。本研究表明,通过有氧运动和魔芋多糖干预后,2型糖尿病大鼠IGF-1升高,值得注意的是血液循环中的IGF-1水平在骨量的增加和维持上起关键作用,说明运动和魔芋多糖联合干预调节IGF-1和血糖的效果更为显著。
3.2 运动和魔芋多糖对2型糖尿病大鼠骨形成血清标志物与骨密度的影响
骨密度(BMD)是一项用于诊断骨质疏松症的测量指标,通过双能X线吸收测量法测定。在2型糖尿病患者中,BMD表达减少,骨折风险增加[26]。有氧运动可改善患者体内BMD含量,国内有研究发现:太极拳和药物干预后腰椎(L2-L4)与左股骨BMD、BGP水平较干预前明显上升[29]。另有研究表明,低强度全身振动可以改善骨强度,增加骨体积和骨密度[30]。本研究中BMD检测结果显示,8周运动或魔芋多糖单独干预没有显著增加2型糖尿病大鼠体内BMD含量,但联合干预组大鼠BMD含量增加(如图1所示),说明改善BMD含量的联合干预产生了叠加效果。
2型糖尿病大鼠骨超微结构发生退行性改变,可能与大鼠骨骼的代谢产物有关,尤其是血清标志物的变化。本研究中,与对照组比较,其他各组大鼠血尿素氮指标均降低,但未见显著差异。血清骨鈣素是成骨细胞分化比较成熟时期的表达产物,是骨形成的生化标志物,也是糖尿病和骨骼之间的一个潜在因素,但骨钙素是否影响骨与葡萄糖代谢之间的关系尚待明确[6,31]。本研究中,相比糖尿病模型组,运动组和联合干预组大鼠血清骨钙素表达显著升高,通过运动和魔芋多糖联合干预发现,血清骨钙素升高与血糖降低有一定的联系。
TNF-α为TNF家族重要成员之一,对破骨细胞的形成和活性具有重要的调节作用,是骨吸收生化标志物的代表性因子。但在本研究中,各组大鼠TNF-α比较,未见显著性差异。瘦素可促进成骨细胞生长,抑制破骨细胞分化,从而促进骨形成。2型糖尿病患者体内瘦素浓度降低,表现为瘦素抵抗,而当瘦素水平升高后BMD或骨折风险降低[32-33]。Hamrick等[34]的研究也发现,瘦素补充剂干预可降低骨折的发生率。本研究中,与对照组比较,2型糖尿病组大鼠瘦素水平降低,而运动组或魔芋多糖组大鼠较2型糖尿病组瘦素水平显著增加,联合干预组大鼠瘦素非常显著增加。从血清骨形成的标志物来看,本研究中运动和魔芋多糖对血清尿素氮和TNF-α的改变未见显著差异,而对血清骨钙素和瘦素水平起到调节作用,联合干预组大鼠骨密度含量显著升高。
3.3 运动和魔芋多糖干预对2型糖尿病大鼠骨细胞形态结构的影响
骨量和骨细胞形态的改变是糖尿病患者骨折发生的主要原因[34]。糖尿病与骨折之间的联系似乎是由复合途径介导的,包括胰岛素样生长因子系统,晚期糖基化终末产物在骨胶原中的积累,微血管病变,骨髓脂肪含量增加。骨密度和骨细胞数量的降低导致2型糖尿病患者骨骼脆性增加[35] 。因此,运动和魔芋多糖改变骨代谢水平,可能与血糖和胰岛素水平改善密切相关。
在本研究中,骨细胞NC(如图2A所示)样本显示,骨细胞结构完整、凸起明显、胞浆内溶酶体较少;DM(如图2B所示)骨细胞坏死、核消失、仅剩陷窝、胞浆中含大量溶酶体;DE(如图2C所示)较DM(如图2B所示)骨细胞结构完整,偶见凋亡早期的骨细胞,仅剩骨陷窝、染色质及细胞器溶解;DK(如图3D所示)骨细胞周围有钙化的结晶,出现星月形凋亡小体;EK(如图3E所示)骨细胞完整、胞浆空化。成骨细胞和破骨细胞产生并涉及骨吸收、形成和重塑。成骨细胞对骨骼的生长和维持是必需的,由于糖脂代谢紊乱造成骨细胞和破骨细胞功能衰竭而面临骨质疏松和骨折的风险[35-36]。在本研究中,2型糖尿病大鼠糖、脂代谢指标的异常伴随着骨超微结构的变化,其机制可能是:由于糖、脂代谢紊乱,尤其是糖代谢异常[36]、高糖血症导致骨重塑的动态平衡遭到破坏,造成骨吸收大于骨形成,骨量减少,BMD下降[34-35],骨的超微结构逐渐异常,最终影响骨代谢的功能,发生骨质疏松或骨折。通过运动和魔芋多糖联合干预,对骨代谢及骨细胞形态、结构的改善有一定作用,这可能与血糖和血脂降低及骨形成有关。
3.4 运动和魔芋多糖对2型糖尿病大鼠骨代谢相关蛋白表达的影响
胰岛素受体底物(IRS)是胰岛素信号传导通路中受体后的重要信号蛋白,在胰岛素抵抗(IR)中起重要作用[37]。IRS-1和IRS-2作为糖尿病合并骨质疏松胰岛素信号通路的相关因子。IRS-1对骨骼生长、骨转换及骨折愈合等均具有重要作用,为代谢性骨病和骨质疏松的防治提供了新思路。同时,还具有一定的调节胰岛素β细胞分泌胰岛素的作用。IRS-1主要存在于骨骼肌、胰腺、脂肪和肝脏等。在本研究中,DM大鼠IRS-1蛋白表达高于其他各组,DE、DK和EK较DM降低,其中EK组大鼠IRS-1蛋白表达显著降低。
IRS-2主要连接胰岛素受体(IR)和多种效应分子,介导细胞对胰岛素的反应,从而调节糖代谢。研究发现,运动可以提高IRS-2蛋白含量和磷酸化程度。其机制可能是:有氧运动可以降低血糖,显著提高胰岛素的敏感性,而IRS-2在胰岛素的信号介导体系中发挥重要作用是运动提高胰岛素敏感性的重要前提。在本研究中,魔芋多糖组大鼠IRS-2蛋白表达较2型糖尿病组升高,在一定程度上降低了血糖,提高了胰岛素的敏感性;而运动与魔芋多糖联合干预组在调节IRS-2蛋白表达上产生了叠加效果。
4 结论
1)运动和魔芋多糖单独或联合干预均可降低血糖、血脂,提高血清骨钙素和瘦素水平,其中联合干预可提高骨密度的含量。
2)运动和魔芋多糖干预在一定程度上可改善骨细胞的形态结构,联合干预改善效果最好。
3)运动和魔芋多糖在一定程度上可调节血清骨形成的标志物水平,其机制可能是运动和魔芋多糖通过上调IRS-2蛋白表达,下调IRS-1蛋白表达,提高胰岛素的敏感性,降低血糖,促进细胞对钙的摄取,提高骨钙素水平和增加钙质的沉积,从而在一定程度上提高2型糖尿病大鼠的骨密度。
参考文献:
[1] YAN P, SHUHONG C, XIAONAN L, et al. Efficacy of different antidiabetic drugs based on metformin in the treatment of type 2 diabetes mellitus: a network meta-analysis involving eight eligible randomized-controlled trials[J]. Journal of Cellular Physiology, 2018, 8(26): 1.
[2] GHOSAL S, SINHA B. Liraglutide and dulaglutide therapy in addition to SGLT-2 inhibitor and metformin treatment in indian type 2 diabetics: a real world retrospective observational study[J]. Clinical Diabetes Endocrinology, 2018, 5(9): 4.
[3] SCHWARTZ A V, VITTINGHOFF E, BAUER D C, et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes[J]. The Journal of the American Medical Association, 2011, 305(21): 2184.
[4] RAKEL A, SHEEHY O, RAHAM E, et al. Osteoporosis among patients with type 1 and type 2 diabetes[J]. Diabetes Metabolism, 2008, 34(3): 193.
[5] JANGHORBANI M, VANDAM R M, WILLTTT W C, et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J]. American Journal of Epidemiology, 2007,166(5): 495.
[6] RUSSO G T, GIANDALIA A, ROMEO E L, et al. Fracture risk in type 2 diabetes: current perspectives and gender differences[J].International Journal of Endocrinology, 2016, 16(1): 735.
[7] MA L, OEI L, JIANG L, et al. Association between bone mineral density and type 2 diabetes mellitus: a meta-analysis of observational studies[J]. European Journal of Epidemiology, 2012, 27(5): 319.
[8] RUBIN M R, PATSCH J M. Assessment of bone turnover and bone quality in type 2 diabetic bone disease: current concepts and future directions[J]. Bone Research, 2016, 4(1):1.
[9] OEI L, ZILLIKENS M C, DEHGHAN A, et al. High bone mineral density and fracture risk in type 2 diabetes as skeletal complications of inadequate glucose control: the rotterdam study[J]. Diabetes Care, 2013, 36(6): 1619.
[10] 王軍力.运动训练和白藜芦醇改善2型糖尿病骨骼肌胰岛素信号通路障碍和脂代谢异常SIRT1机制研究[D]. 广州:华南师范大学,2011.
[11] 杨芳.魔芋硒多糖对大鼠酒精性脂肪肝预防效果的研究[J].扬州大学学报(农业与生命科学版),2012,33(3):22.
[12] CHEN L, MAGLIANO D J, ZIMMET P Z. The worldwide epidemiology of type 2 diabetes mellitus-present and future perspectives[J]. Nature Reviews Endocrinology, 2011, 8(4):228.
[13] LIN C C, LI C I , LIU C S, et al. Impact of lifestyle-related factors on all-cause and cause-specific mortality in patients with type 2 diabetes: the taichung diabetes study[J]. Diabetes Care, 2012, 35(1): 105.
[14] COX E, KEATING S E, COOMBES J S, et al. Potential utility of self-report measures of affect to optimise exercise adherence in people with type 2 diabetes[J]. Current Diabetes Review, 2019, 15(4): 302.
[15] Solomon T P J.Sources of inter-individual variability in the therapeutic response of blood glucose control to exercise in type 2 diabetes: going beyond exercise dose[J]. Frontiers Physiology, 2018, 13(9): 896.
[16] TEO S Y M, KANALEY J A, GUELFI K J, et al. Exercise timing in type 2 diabetes mellitus: a systematic review[J]. Medicine Science Sports Exercise, 2018, 50(12): 2387.
[17] 吳志建,王竹影,宋彦李青. 不同运动处方对2型糖尿病患者改善效果的meta 分析[J]. 中国体育科技,2017,53(1): 73.
[18] DELZENNE N M, CANI P D. A place for dietary fiber in the management of the metabolic syndrome[J].Currrent Opinion Clinical Nutrition Metabolic Care, 2005, 8(6): 636.
[19] KRISTENSEN M, JENSEN M G. Dietary fibers in the regulation of appetite and food intake. Importance of viscosity [J].Appetite, 2011(56): 65.
[20] KACINIK V, LYON M, PURNAMA M, et al. Effect of PGX, a novel functional fibre supplement, on subjective ratings of appetite in overweight and obese women consuming a 3-day structured, low-calorie diet[J]. Nutrition Diabetes, 2011, 1(12): 1.
[21] REIMER R A, YAMAGUCHI H, ELLER L K, et al. Changes in visceral adiposity and serum cholesterol with a novel viscous polysaccharide in japanese adults with abdominal obesity[J]. Obesity, 2013, 21(9): 379.
[22] SOLAH V, BRANDMILLER J, ATKINSON F, et al. Dose-response effect of a novel functional fibre, Polyglycoplex, PGX, on satiety[J].Appetite, 2014, 6(77): 72.
[23] SOLAH V A, OMARA-WALLACE B, MENG X, et al. Consumption of the soluble dietary fibre complex polyglycoplex reduces glycaemia and increases satiety of a standard meal postprandially[J]. Nutrients, 2016, 8(5): 268.
[24] WANDERS A J, VAN DEN BORNE J J, DE GRAAF C, et al. Effects of dietary fibre on subjective appetite, energy intake and body weight: a systematic review of randomized controlled trials[J]. Obesity Review, 2011, 12(9): 724.
[25] PUIG-JUNOY J, RUIZ ZAMORA A. Socio-economic costs of osteoarthritis: a systematic review of cost-of-illness studies[J]. Seminars Arthritis Rheumtism, 2015, 44(5): 531.
[26] BOWMAN S, AWAD M E, HAMRICH M W, et al. Recent advances in hyaluronic acid based therapy for osteoarthritis[J]. Clinical and Translational Medicine, 2018, 7(1): 6.
[27] BARBOUR K, HOOTMAN J M, HELMICK C G, et al. Meeting physical activity guidelines and the risk of incident knee osteoarthritis: a population-based prospective cohort study[J]. Arthritis Care Res(Hoboken), 2014, 66(1): 139.
[28] BROSSEAU L, TAKI J, DESJARDINS B, et al. The ottawa panel clinical practice guidelines for the management of knee osteoarthritis. part two: strengthening exercise programs[J]. Clinical Rehabilitation, 2017, 31(5): 596.
[29] 彭冉東,邓强,李中锋,等.仙灵骨葆胶囊联合八段锦治疗绝经后2型糖尿病性骨质疏松症临床观察[J].河南中医,2018,38(5):769.
[30] 李汇明,李良.低强度全身振动与绝经后骨质疏松症[J].生物医学工程学杂志,2018,25(4):301.
[31] SEALAND R, RAZAVI C, ADLER R A. Diabetes mellitus and osteoporosis [J].Current Diabetes Reports, 2013, 13(3): 411.
[32] TANNA N, PATEL K, MOORE A E, et al. The relationship between circulating adiponectin, leptin and vaspin with bone mineral density (BMD), arterial calcification and stiffness: a cross-sectional study in post-menopausal women [J].Journal of Endocrinological Investigation, 2017, 40(12): 1345.
[33] GALLIERA E, MARAZZI M G, GAZZARUSO C, et al. Evaluation of circulating sRAGE in osteoporosis according to BMI, adipokines and fracture risk: a pilot observational study[J].Immunity & Ageing, 2017, 14(13): 1.
[34] HAMRICK M W. Role of the cytokine-like hormone leptin in muscle-bone crosstalk with aging[J].Journal of Bone Metabolism, 2017, 24(1): 1.
[35] POOANA C, CAPATINA C. Fracture risk assessment in patients with diabetes mellitus[J]. Journal of Clinical Densitometry, 2017, 20(3): 432.
[36] SAKI F, SHEIKHI A, OMARANI G H R, et al. Evaluation of bone mineral density in children with type i diabetes mellitus and relationship to serum levels of osteopontin[J].Drug Research, 2017, 67(9): 527.
[37] WANG J, YAN D D, HOU X H, et al. Association of bone turnover markers with glucose metabolism in chinese population[J]. 中国药理学报(英文版), 2017, 38(12): 1611.
[38] JINGWOEI L, HEUNGMAN L, YING W, et al. Interactome-transcriptome analysis discovers signatures complementary to GWAS Loci of type 2 diabetes[J].Scientific Reports, 2016, 10(18): 1.

