静养时间对扬州鹅应激后肉品质的影响
张舒翔 刘瑞 康大成 张丽丽 周光宏 张万刚


摘要:为研究宰前静养时间对扬州鹅应激后肉品质的影响,将30羽扬州鹅随机分为5组,每组6羽,运输2 h后静养,时间分组设置为0、3、6、9、12 h,其中0 h为对照组。结果显示,与对照组相比,静养6~9 h鹅肉的L*值显著降低(P<0.05),静养后a*值显著增大(P<0.05),b*值显著降低(P<0.05),静养9~12 h时,pH值显著增大(P<005),静养9 h时贮藏损失、蒸煮损失和剪切力显著降低(P<0.05);静养3、9、12 h时血液中促肾上腺皮质激素和皮质酮水平显著下降(P<0.05),静养后血糖含量显著降低(P<0.05),静养6、12 h时乳酸含量显著降低(P<0.05),12 h 时肌酸激酶和乳酸脱氢酶后酶活显著下降(P<0.05);能量代谢方面,静养6~12 h时肌肉中乳酸含量下降明显(P<0.05),静养6~9 h时丙酮酸激酶和己糖激酶活性显著下降(P<0.05),静养9~12 h时ATP含量显著上升(P<0.05),静养9 h時ADP和AMP含量显著上升(P<0.05),静养12 h时IMP含量显著降低(P<0.05)。综上所述,9 h宰前静养处理可有效缓解应激,改善肉品质。
关键词:扬州鹅;静养时间;应激;能量代谢;肉品质
中图分类号: S835.4文献标志码: A
文章编号:1002-1302(2019)19-0183-05
收稿日期:2018-06-19
基金项目:江苏省农业科技自主创新资金[编号:CX(16)1007]。
作者简介:张舒翔(1993—),男,江苏宿迁人,硕士研究生,主要从事肉品质量安全控制研究。E-mail:2016808115@njau.edu.cn。
通信作者:张万刚,博士,教授,主要从事肉品质量安全控制研究。E-mail:wangang.zhang@njau.edu.cn。
我国是传统养鹅大国,鹅肉产量已达世界总产量的90%以上。扬州鹅是我国利用国内鹅种资源培育的第一个新品种,具有肉质鲜美、加工成品率高和适口性好等特点。相比于其他禽肉,鹅肉含有丰富的维生素和多不饱和脂肪酸,肉品质更加优良[1]。
研究表明,由运输造成的肉鸡死亡率在0.5%~3.0%[2],胴体损伤率甚至高达25%,造成经济损失较大。目前,国内外关于动物宰前管理的研究已较为成熟,但多局限于猪、牛、羊、鸡等,关于鹅的宰前管理研究鲜有报道。相比其他家畜,鹅体型较小,可能更易受运输应激影响,造成肉品质下降。因此如何缓解运输应激,使鹅肉品质得到最大限度的保持以降低经济损失,已成为企业急需解决的生产难题。
动物应激后,分泌大量激素类物质进入体液和血液,此时立即屠宰易致激素类物质滞留体内,造成宰后无氧酵解反应加剧[3],积累大量乳酸,从而导致宰后肌肉颜色苍白、质地松软、汁液流失严重[4]。而宰前静养可缓解应激,降低激素类物质在机体内的含量[5],降解机体内产生的乳酸,减弱糖酵解反应,从而减少宰后肌肉中乳酸的生成量,有利于肉的成熟,改善肌肉品质[6]。影响宰前静养的因素有很多,包括时间、温度、湿度等,其中静养时间的长短被认为是主要影响因素[7-8]。因此,本研究以扬州鹅为研究对象,从糖酵解途径角度出发,通过控制静养时间来探究其对机体应激后肉品质的影响,寻求最佳静养时间,从而为企业制定扬州鹅宰前静养及管理方案提供数据支撑和理论参考。
1 材料与方法
1.1 材料与试剂
选用78日龄扬州鹅30羽。促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮激素(corticosterone,CORT)试剂盒,购自赫澎(上海)生物科技有限公司;葡萄糖(glucose,GLU)、乳酸(lactic acid,LD)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、丙酮酸激酶(pyruvate kinase,PK)和己糖激酶(hexokinase,HK)试剂盒,购自南京建成生物工程有限公司;碘乙酸钠(Sodium iodoacetate),购自南京巨优科学器材有限公司;5′-三磷酸腺苷(adenosine triphosphate,ATP)钠盐标准品(纯度99%)、5′-二磷酸腺苷(adenosine diphosphate,ADP)钠盐标准品、5′-一磷酸腺苷(adenosine monophosphate,AMP)钠盐标准品和肌苷酸(inosincacid,inosinemonphosphate,IMP),购自Sigma公司;0.22 μm过滤器,购自Millipore公司。
1.2 仪器与设备
肝素钠一次性真空采血管,购于江苏宇力医疗器械有限公司;C-LM3B型数显式肌肉嫩度仪,东北农业大学工程学院;M2e多功能酶标仪,购于德国MD公司;FE20台式pH计,购于瑞士Mettler Toledo公司;CR-400便携式色差仪,购于日本Konica Minolta公司;BertinPrecellys Evolution生物样品均质器,购于法国Bertin Technologies公司;Waters 2695型HPLC仪,购于美国Waters公司;Agilentll00色谱仪,购于安捷伦科技有限公司。
1.3 试验方案
30羽扬州鹅随机分为5个处理组,运输时间为2 h,静养时间分别为0、3、6、9、12 h,其中0 h为对照组,每个处理组6羽鹅。
试验时间:2017年5月9—10日,试验地点:江苏省扬州市高邮市送桥镇五里桥天歌鹅业发展有限公司。
运输条件:用尼龙绳将鹅脚掌紧缚在一起,随机摆放在运输车(3.95 m×1.8 m×1.64 m)中,密度为0.24 m2/羽;运输车采用小型有蓬货车,平均车速45 km/h。运输前12 h禁食,不禁水,运输全程禁食禁水。
静养条件:货车到达屠宰场后,对照组立即宰杀取样,其余处理组安置在通风良好、温度18 ℃、湿度78%的鹅舍进行宰前静养,3羽/m2鹅,鹅脚掌不再紧缚,禁食不禁水。
宰杀流程:电击晕(10 V、800 Hz,倒挂头部浸水击晕)→颈动脉取血→放血→胴体热烫(60~62 ℃)退毛→剥离胸肌肉。
1.4 样品制备
1.4.1 血液样品 鹅电击晕后,用采血针从颈动脉收集 10 mL 血液于肝素钠抗凝管中,立即颠倒180°,混匀5 ~8次,在 3 500 r/min 离心5 min,取上清液分装于2 mL试管,并 -80 ℃ 保存待测[9]。
1.4.2 肌肉样品 第1次热烫褪毛后,在15 min内完整剥离左右2块胸大肌,其右侧胸肌用于测定宰后15 min的肌肉pH值、肉色,然后真空包装于4 ℃保存24 h后,测定肌肉保水性和嫩度,左侧胸肌于-80 ℃保存,用于測定能量代谢。
1.5 血液指标测定
ACTH和CORT含量用酶联免疫双抗夹心试剂盒测定;GLU、LD含量与LDH、CK活力用试剂盒测定。所有操作均依据试剂盒说明书进行。
1.6 肌肉指标测定
1.6.1 肉色(L*、a*、b*) 将样品放置平整,用手术刀横切出平整切面,于空气中暴露10 min。选取肉色较为均匀的平整切面,用校准后的色差仪测定胸肉色泽,记录亮度L*、红度a*、黄度b*。每个样品选取等距离的3个点进行测定,以其平均值作为肉色的测定结果[10]。
1.6.2 肌肉pH值 称取1 g样品,加入9 mL预冷匀浆缓冲液(5 mmol/L碘乙酸钠,150 mmol/L氯化钾,pH值为7),8 000 r/min 匀浆2×15 s,间隔5 s,将已校准的pH计插入匀浆液测定pH值[11]。
1.6.3 贮藏损失 将右侧胸肌边缘部分切去,剔除表面可见的筋膜、脂肪等组织并修整至形状规则(10 cm×5 cm×1.5 cm)质量约90 g的肉样,称质量(m1),真空包装后,4 ℃储藏24 h后取出样品,用吸水纸擦去样品表面渗出的水分,重新称质量(m2)。贮藏损失(purge loss)=(m1-m2)/m1×100%。
1.6.4 蒸煮损失 将测定贮藏损失后的肉样重新修整至形状规则(8 cm×4 cm×1.5 cm),质量约80 g的待测样品,准确称质量后(m1)密封在自封袋中,置于75 ℃水浴中,当中心温度达到72 ℃时取出肉块,流水冷却至室温,取出用吸水纸擦干,称质量(m2)[12]。蒸煮损失(cooking loss)=(m1-m2)/m1×100%。
1.6.5 剪切力 将测定蒸煮损失后的样品表面修整,沿平行于肌纤维方向切取4 cm×1 cm×1 cm肉样4~5块,使用肌肉嫩度仪测定肉样的剪切力值,上机试样时,刀口与肌纤维走向垂直[13]。
1.6.6 肌肉中LD含量、HK和PK活力 肌肉中LD含量及HK和PK活力均采用试剂盒测定,所有操作依据试剂盒说明书进行。
1.6.7 肌肉中ATP、ADP、AMP和IMP含量 宰后肌肉中ATP、ADP、AMP和IMP的含量采用高效液相法(HPLC)测定。取 1 g 样品,加入5 mL预冷的7%高氯酸,8 000 r/min匀浆30 s,4 ℃ 下15 000 r/min离心10 min。上清液用KOH调节pH值为6.8,4 ℃下15 000 r/min离心10 min,定容至20 mL,0.22 μm 滤膜过滤。检测波长254 nm,流动相为86.5%磷酸缓冲液(2.5 mmol/L四丁基硫酸氢铵,0.04 mol/L磷酸二氢钾,006 mol/L磷酸氢二钾,pH值7.0)和13.5%甲醇,流速 1 mL/min,进样10 μL。结果最后用外标法,通过保留时间和峰面积对核苷酸进行定性和定量分析。
1.7 统计分析
所有数据均采用SAS 9.2进行方差分析,采用最小显著性差异法(LSD)进行显著性(P<0.05)分析,结果以“均值±标准差”表示。
2 结果与分析
2.1 静养时间对扬州鹅肌肉品质的影响
由表1可知,随静养时间的延长,L*值和b*值均呈先减小后增大的趋势,静养6 h和9 h后,L*值显著低于对照组(P<0.05),静养12 h后,L*值显著高于其余处理组(P<0.05);静养6 h后,b*值显著低于其余处理组(P<0.05)且b*值所有静养处理组均显著低于对照组(P<0.05);静养处理后,各处理组间a*值无明显差异(P>0.05),但均显著高于对照组(P<0.05);静养9 h和12 h后,pH值显著高于对照组(P<0.05)。总体来说,6~9 h静养后,肉色改善明显。
由表2可知,贮藏损失和蒸煮损失均随静养时间延长呈先升高后降低再升高的趋势,静养6 h后,贮藏损失和蒸煮损失均显著高于对照组(P<0.05),静养9 h后, 贮藏损失和蒸煮损失均显著低于其余处理组(P<0.05);静养9 h后,剪切力值显著低于其余处理组(P<0.05),但3 h、6 h和12 h处理组的剪切力值均显著高于对照组(P<0.05)。综上,静养9 h后,肌肉保水性和嫩度恢复到较好水平。
2.2 静养时间对扬州鹅血液指标的影响
由表3可知,随着静养时间的延长,ACTH和CORT含量均呈先降低后增加再减小的趋势,静养3 h、9 h和12 h时,ACTH和CORT含量均显著低于对照组(P<0.05),说明静养9~12 h后,机体应激水平下降;Glu含量随静养时间的延长呈先降低后升高的趋势,静养6 h、9 h后,Glu含量显著低于其余处理组(P<0.05);静养6 h和12 h后,血液中LD含量显著低于其余处理组(P<0.05);静养12 h后,血液中CK活性显著低于其余处理组(P<0.05);LDH活性在静养9 h后显著高于其余处理组(P<0.05),静养12 h后显著低于对照组(P<0.05)。
2.3 静养时间对扬州鹅宰后能量代谢的影响
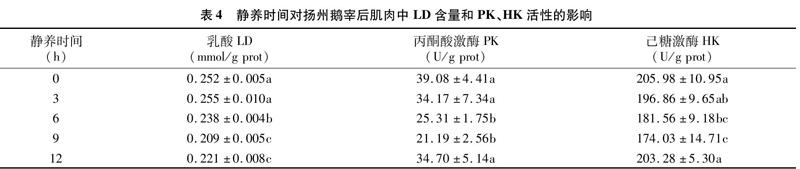
由表4可知,随静养时间的延长,肌肉中LD含量呈下降的趋势,静养9 h和12 h后,肌肉中LD含量显著低于其余处理组(P<0.05);PK和HK活性随静养时间的延长呈先下降后上升的趋势,静养6 h和9 h后,PK和HK活性低于其余处理组。
由表5可知,随静养时间的延长,肌肉中ATP、ADP、AMP和IMP含量均呈先升高后降低的趋势,静养9 h和12 h时,肌肉中ATP含量显著高于对照组(P<0.05),静养9 h时,ADP和AMP含量显著高于其余处理组(P<0.05);静养12 h后,IMP含量显著低于对照组(P<0.05)。
3 讨论
3.1 静养时间对扬州鹅肌肉品质的影响
肉色可直观反映肉品质,是影响消费者认可肉类产品的决定性因素之一。动物应激后,机体内产生大量的自由基和LD,破坏了细胞膜的结构和功能,肌肉表面汁液渗出[4],反射自然光增加,导致L*值增大,b*值增大,a*值减小[14-15]。随着静养时间的延长,机体应激得到缓解,糖酵解反应降低,肌肉中LD含量减少,细胞膜的功能结构得到一定程度的修复,肌肉系水力有所恢复,汁液渗出较少。此时,机体内有氧呼吸占主导,血液中氧含量增加,肌红蛋白增多。本研究发现6~9 h静养后肉色得到明显改善,这与柴晓峰等[16]和Smiecińska等[17]的发现相似。 但静养12 h后L*值显著提高, 其可能原因是过长时间的禁食导致机体内能量消耗殆尽,不足以支持细胞正常的生理代谢,细胞液逸出,肌肉表面湿润,L*值增大。pH值是肉品质评价的重要指标,可以反映动物宰后肌肉糖酵解的速率。动物糖酵解途径的最终产物是LD,当氧气不足时,LD会被运送到肌肉纤维外[18],令pH值降低。邹华峰等研究发现,宰前12 h的静养提高了屠宰后24 h肌肉的pH值[19]。本研究同样发现长时间静养后,肌肉的pH值有显著提高。pH值的快速下降会导致肌肉蛋白的变性,肌浆蛋白中糖原磷酸化酶和肌酸激酶变性后会沉积到肌原纤维蛋白上,同时较低的pH值也可能会抑制calpain的活性,影响关键骨架蛋白的降解,最终导致肌肉保水性下降。保水性是衡量肉品质的重要指标之一,它对肌肉的色泽、组织状态等有显著影响[20]。贮藏损失和蒸煮损失可以用来评价肌肉的保水性。本研究发现长时间静养后,贮藏损失和蒸煮损失明显下降,肌肉保水性提高,这与Ekiz等的研究结果[21]一致。但静养12 h后,贮藏损失和蒸煮损失又升高,其可能原因是长时间的禁食,导致机体虚弱,糖原含量减少,糖酵解水平下降,细胞内ATP供能不足,肌肉保水性下降,这一点与朱志盈等的发现[22]相似。也有研究认为,生猪的静养时间应大于12 h,从而减少肌肉的滴水损失,提高猪肉的系水力[23],这可能是因为动物种类的不同,对应激的耐受性不一样造成的。嫩度是评价肉品质的重要指标之一,剪切力值可以直接反映肌肉的嫩度。动物应激后,肌细胞内能量被大量消耗,肌动球蛋白因能量缺乏无法分离成肌动蛋白和肌球蛋白,导致肌肉收缩,剪切力变大,嫩度变差[24-25]。静养处理可缓解机体应激,使宰后能量代谢趋于平稳,肌肉得以舒张,提高了肌肉嫩度,使肉品质得到改善。但过长时间的禁食静养,易导致机体虚弱,糖酵解水平低,能量供应不足,肌肉进一步收缩,导致剪切力增大,嫩度下降,本研究结果也证实了这一点。
3.2 静养时间对扬州鹅血液应激指标的影响
动物受运输应激的影响,下丘脑-垂体-肾上腺(HPA)轴功能增强,血液中ACTH分泌增多,促使肾上腺迅速合成CORT,因此,ACTH和CORT含量可反映动物的应激水平[26-29]。王晓明等研究发现,随着休息时间的延长,ACTH和CORT含量呈现下降趋势[30]。在猪[31]和羊[32]的研究中也同样发现静养处理可降低动物的应激水平。但本研究发现,静养6 h时,ACTH和CORT含量显著高于其余静养处理组,与对照组无明显差异,其可能原因是长时间的禁食,使机体产生一定程度的应激反应,分泌更多的ACTH和CORT来促进糖酵解反应,从而维持正常的生理代谢,这一点在鸡的禁食研究中也得到证实[33]。宰后缺氧条件下,机体主要通过糖酵解途径,将糖原分解为LD来提供能量,而CORT可促进糖酵解反应[34]。Zhen等研究发现静养处理可以延缓猪体内糖原的降解[35]。本研究同样发现静养处理后,血液中Glu显著降低。但静养9 h时,血液中LD含量反而升高,可能是由于静养6 h时,ACTH和CORT含量的升高加剧糖酵解反应造成的,这与鲁耀彬等的发现[36]类似。CK和LDH是反应糖酵解水平的关键指标。动物应激时,产生大量LD使肌肉受损,肌细胞膜被破坏,细胞膜通透性增加,导致肌肉中CK和LDH逸出并进入血液,因此,CK和LDH活性的变化可以反映肌肉的损伤程度。本研究中静养9 h后,LDH活性反而升高,其可能原因是因为此时血液中LD含量的升高进一步激活了LDH,因此,LDH活性反而增大,这一点与Pérez等的研究结果[37]类似。静养12 h后,CK和LDH活性显著低于其余处理组,其可能原因是长时间的禁食导致机体内糖原含量减少,糖酵解反应较慢,同时细胞膜在静养过程中有所修复,CK和LDH活性降低,这与Warriss等的研究结果[31]类似。因此,我们发现长时间静养处理后,CK和LDH活性降低,说明肌细胞开始自我恢复,肌肉损伤得到修复,肉品质在一定程度上得到改善。
3.3 静养时间对扬州鹅宰后能量代谢的影响
动物无氧糖酵解反应的最终产物是LD[38]。在有氧条件下,LD会在LDH的作用下转變成丙酮酸,进入三羧酸循环,重新参与代谢。PK是糖酵解途径中的关键限速酶[39],对糖酵解速率的影响比较大。有氧呼吸占主导后,大量丙酮酸直接进入三羧酸循环,导致丙酮酸含量减少,PK活性降低,糖酵解反应减缓。HK是糖酵解途径中第一个关键限速酶,Glu浓度的升高,可激活HK,使HK活性增强[40-42],因此,HK活性与Glu浓度呈正相关。这些都与本研究中长时间静养后,血液中Glu含量低,肌肉中LD含量少,PK和HK活性低的发现相印证。无氧或缺氧条件下,动物体内的无氧代谢主要有2种方式:糖酵解和磷酸肌酸。ATP是细胞中普遍应用的能量载体,可为肌肉收缩提供能量,对宰后肌肉的能量代谢有重要的影响[43-44]。鲁耀彬等研究发现6 h静养处理后的鸭肉中ATP含量处于最高水平,IMP含量水平最低,PK和HK活性维持在较低水平[36]。本研究也发现9 h静养后,ATP、ADP和AMP含量显著提高,机体能量供应较为充足,有利于肉的成熟,增加肌肉的系水力,减少汁液流失。但过长时间的禁食也造成了机体虚弱,ATP、ADP、AMP和IMP含量呈下降趋势,肌细胞能量不足,使肌肉进一步收缩,嫩度下降。
4 结论
综上所述,静养9~12 h后,机体内血液应激指标和能量代谢指标均恢复至较好水平。但静养12 h后,因过长时间的禁食造成机体虚弱,使其肉品质下降,明显不如9 h静养处理组,因此宰前对扬州鹅进行9 h静养处理,易使机体应激得到最大程度缓解,肉品质得到明显改善。
参考文献:
[1]赖毓妍. 扬州鹅体脂特性的研究[D]. 扬州:扬州大学,2007:8.
[2]王泽仁. 高温季节商品肉鸡运办理应激原因及防治措施[J]. 当代畜禽养殖业,2014(9):11-11.
[3]齐晓巍. 浅谈肉的“冷却排酸”过程[J]. 食品研究与开发,2003,24(1):8-9.
[4]El R R,Babilé R,Fernandez X.Effect of ultimate pH on the physicochemical and biochemical characteristics of turkey breast muscle showing normal rate of postmortem pH fall[J]. Poultry Science,2004,83(10):1750-1757.
[5]Warriss P D,Brown S N,Edwards J E,et al. Time in lairage needed by pigs to recover from the stress of transport[J]. Veterinary Record,1992,131(9):194-196.
[6]Liste G,Miranda-De La Lama G C,Campo M M,et al. Effect of lairage on lamb welfare and meat quality[J]. Animal Production Science,2011,51(10):952-958.
[7]柴 进,彭 健,熊 琪,等. 宰前休息方式对猪福利、血液成分及肉质的影响[J]. 畜牧兽医学报,2009,40(11):1645-1650.
[8]王晓香,李兴艳,张 丹,等. 宰前运输、休息、禁食和致晕方式对鲜肉品质影响的研究进展[J]. 食品科学,2014,35(15):321-325.
[9]张 林,岳洪源,张海军,等. 不同强度的运输应激对肉仔鸡血液应激指标和肌肉品质的影响[J]. 动物营养学报,2009,21(3):288-293.
[10]Xing T,Xu X L,Jiang N N,et al. Effect of transportation and pre-slaughter water shower spray with resting on AMP-activated protein kinase,glycolysis and meat quality of broilers during summer[J]. Animal Science Journal,2016,87(2):299-307.
[11]Mcgeehin B,Sheridan J J,Butler F. Factors affecting the pH decline in lamb after slaughter[J]. Meat Science,2001,58(1):79-84.
[12]李 新,吴文锦,汪 兰,等. 宰前静养时间对鸭肉物理特性的影响[J]. 湖北农业科学,2013,52(21):5264-5267.
[13]Froning G W,Uijttenboogaart T G. Effect of Post-Mortem electrical stimulation on color,texture,pH,and cooking losses of hot and cold deboned chicken broiler breast meat[J]. Poultry Science,1988,67(11):1536-1544.
[14]姚軍虎. 应激引起PSE肉的机理及其营养控制[J]. 中国畜牧兽医,1994(6):28-30.
[15]余小领,李学斌,陈 会. 猪肉色泽和保水性的相关性研究[J]. 食品科学,2009,30(23):44-46.
[16]柴晓峰. 静养时间对肉牛运输应激消除作用的影响研究[D]. 保定:河北农业大学,2015:28-28.
[17]S[DD(-1][HT6]′[DD)]miecińska K,Denaburski J,Sobotka W. Slaughter value,meat quality,creatine kinase activity and cortisol levels in the blood serum of growing-finishing pigs slaughtered immediately after transport and after a rest period[J]. Polish Journal of Veterinary Sciences,2011,14(1):47-54.
[18]Tranulis M A,Dregni O,Christophersen B,et al. A glucokinase-like-enzyme in the liver of Atlantic salmon(Salmo salar)[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,1996,114(1):35-39.
[19]邹华锋,文美英,魏星华,等. 生猪宰前不同静养时间和屠宰方式对背长肌肌肉pH值和滴水损失的影响[J]. 肉类工业,2013(5):19-21.
[20]Koohmaraie M,Whipple G,Kretchmar D H,et al. Postmortem proteolysis in longissimus muscle from beef,lamb and pork carcasses[J]. Journal of Animal Science,1991,69(2):617-624.
[21]Ekiz B,Ekiz E E,Kocak O,et al. Effect of pre-slaughter management regarding transportation and time in lairage on certain stress parameters,carcass and meat quality characteristics in Kivirciklambs[J]. Meat Science,2012,90(4):967-976.
[22]朱志盈,闵成军,夏春厚,等. 生猪宰前静养损耗与猪肉品质研究[J]. 肉类研究,2008(12):20-23.
[23]刘国庆,张黎利,陈鸿书,等. 生猪宰前静养时间与屠宰工艺对肉质的影响[J]. 肉类工业,2015(6):41-45.
[24]赵改名,王艳玲,田 玮. 影响牛肉嫩度的因素及其机制[J]. 中国畜牧兽医,2000,27(2):35-40.
[25]王晓华,曹 恺,甘 泉,等. 肉品的嫩化机制、方法及其影响因素[J]. 中国农学通报,2008,24(9):94-98.
[26]Knowles T G,Brown S N,Warriss P D,et al. Effects on sheep of transport by road for up to 24 hours[J]. Veterinary Record,1995,136(17):431-438.
[27]Pettiford S G,Ferguson D M,Lea J M,et al. Effect of loading practices and 6-hour road transport on the physiological responses of yearling cattle[J]. Australian Journal of Experimental Agriculture,2008,48(6/7):1028-1033.
[28]Fisher A D,Colditz I G,Lee C,et al. The influence of land transport on animal welfare in extensive farming systems[J]. Journal of Veterinary Behavior-Clinical Applications and Research,2009,4(4):157-162.
[29]李留安,杜改梅,金天明. 运输应激对动物机体功能影响的研究进展[J]. 黑龙江畜牧兽医,2010(17):40-41.
[30]王晓明,王 鹏,李伟明,等. 夏季运输和休息时间对肉鸡应激及肌肉品质的影响[J]. 食品科学,2014,35(3):55-60.
[31]Warriss P D,Brown S N,Edwards J E,et al. Effect of lairage time on levels of stress and meat quality in pigs[J]. Animal Science,2010,66(1):255-261.
[32]Liu H W,Zhong R Z,Zhou D W,et al. Effects of lairage time after road transport on some blood indicators of welfare and meat quality traits in sheep[J]. Journal of Animal Physiology & Animal Nutrition,2012,96(6):1127-1135.
[33]王思丹. 禁食對宰后早期鸡肉能量代谢的影响机制研究[D]. 南京:南京农业大学,2013:7-7.
[34]Owens C M,Sams A R. The influence of transportation on turkey meat quality[J]. Poultry Science,2000,79(8):1204-1207.
[35]Zhen S B,Liu Y R,Li X M,et al. Effects of lairage time on welfare indicators,energy metabolism and meat quality of pigs in Beijing[J]. Meat Science,2013,93(2):287-291.
[36]鲁耀彬,吴文锦,李 新,等. 不同宰前静养时间对樱桃谷肉鸭能量代谢影响的研究[J]. 中国家禽,2014,36(23):37-43.
[37]Perez M P,Palacio J,Santolaria M P,et al. Influence of lairage time on some welfare and meat quality parameters in pigs[J]. Veterinary Research,2002,33(3):239-250.
[38]King L M,Opie L H. Glucose and glycogen utilisation in myocardial ischemia-changes in metabolism and Consequences for the myocyte[J]. Molecular & Cellular Biochemistry,1998,180(1/2):3-26.
[39]Shen Q W,Du M. Effects of dietary alpha-lipoic acid on glycolysis of postmortem muscle[J]. Meat Science,2005,71(2):306-311.
[40]Kashiwaya Y,Sato K,Tsuchiya N,et al. Control of glucose utilization in working perfused rat heart[J]. Journal of Biological Chemistry,1994,269(41):25502-25514.
[41]Manchester J,Kong X,NerbonneJ,et al. Glucose transport and phosphorylation in single cardiac myocytes:rate-limiting steps in glucose metabolism[J]. American Journal of Physiology,1994,266(1):326-333.
[42]王廣宇,刘 波,谢 骏,等. 鱼类糖代谢几种关键酶的研究进展[J]. 上海海洋大学学报,2008,17(3):377-383.
[43]Bekhit A E,Farouk M M,Cassidy L,et al. Effects of rigor temperature and electrical stimulation on venison quality[J]. Meat Science,2007,75(4):564-574.
[44]Ledwardd A. Post-slaughter influences on the formation of metyyoglobin in beef muscles[J]. Meat Science,1985,15(3):149-171.

