2018亚太工作组非静脉曲张上消化道出血(NVUGIB)共识解读
周雨迁
非静脉曲张上消化道出血(NVUGIB)近期有很多重要的进展,包括内镜诊疗前的管理,新的内镜止血方法的应用和需要面对新情况如日益增加的抗血小板聚集药物和抗凝药物的使用。而内镜下的黏膜切除(EMR)和黏膜下分离术(ESD)已经成为标准的内镜治疗方法,这些方法常伴随着显著的出血风险。基于上述原因,亚太工作组认为非常有必要升级2011年发表的NVUGIB管理共识意见。本次升级旨在为工作在社区医院和转诊医院的医生提供实用指导,对于2011版共识中的推荐意见本次共识未涉及的部分,本次升级认为其仍然有效,不再重复,但会强调基于近5~10年的新证据做出建议。本次共识意见将非静脉曲张上消化道出血的处理以内镜诊疗为中心,分为三部分:①内镜诊疗前管理;②内镜诊疗管理和③内镜诊疗后管理。
工作组由来自亚太10个国家和地区相关领域的专家组成,基于循证医学的基础,复习和讨论了近5年来(2012~2017)非静脉曲张出血的相关文献和进展,检索数据库包括Medline、EMBASE、Cochrane临床试验中心、ISI数据库以及亚太消化病周(APDW)、美国消化病周(DDW)、欧洲消化病周(UEGW)等会议文献。检索关键词包括消化道出血、消化性溃疡和亚洲。经过委员会讨论后的证据等级最终分为3级:(a)高水平证据:将来的研究非常不可能改变当前的评估结果;(b)中等水平证据:将来的研究对目前的评估结果有重要影响,从而可能改变当前的推荐意见;(c)低水平证据:将来的研究很可能对目前的评估结果有重要影响,从而可能改变评估结果。本次升级聚焦于非静脉曲张上消化道出血的临床管理而不是阐明临床概念,也尽可能减少与前次共识意见的内容重叠,因此本次共识意见升级会包括目前尚有争议的新方法和新策略,而之所以有争议是目前这些内容仍缺乏充分的文献依据支持。
1 共识意见陈述
1.1内镜诊疗前管理 陈述1:Glasgow Blatchford评分应当用于所有非静脉曲张上消化道出血病人的临床结果评估(接受 — 同意率:94.5%,证据等级-高)。
作为评估再出血和病死率的危险度分层工具,目前最广泛使用的评分方法为 Rockall评分(RS)、GBS评分和AIMS65评分,其次为Progetto Nazionale Emorragia Digestiva评分(PNED)。评分方法见表 1、2、3、4、5。既往 5年,很多文献对这些评分进行了比较。一项大规模的、多中心、前瞻性、队列研究入组了6家医院的三千例病人,比较内镜处理前简化RS评分、AIMS65评分和GBS评分;内镜处理后完全RS评分、PNED评分预测临床结果的能力,发现GBS评分系统在预测介入需求和病死率方面为最佳,在预测内镜治疗需求方面,GBS评分也优于简化RS评分和AIMS65评分[1]。
GBS评分>7分为预测需要内镜治疗的最佳评分。在这四个评分系统中,GBS评分在预测患者是否住院及病死率方面最准确。韩国的一项募集523例NVUGLB患者的研究,发现GBS评分在预测输血方面最准确[2]。其他多个RCT研究发现几个评分系统各有优缺点,但是综合这些研究来看,GBS评分系统尽管还有改善提高的空间,工作组认为在预测患者住院时的干预措施方面如输血、内镜治疗、外科手术方面仍是最佳选择,因此工作组推荐GBS评分作为评估NVUGIB患者临床结果的工具。患者如果评分为0~1分,则很少需要临床干预,可以酌情择期内镜检查,从而可以不需要住院。高GBS评分(比如10~12分)则常需要采取干预措施如输血和内镜治疗。关于此建议证据等级评级为高等级。
陈述2:GBS评分<1分的患者可以门诊治疗(接受 —同意率:94.5%,证据等级-高)。
大多数文献研究提示,GBS评分在评估上消化道出血患者是否需要住院干预方面,为目前的最佳工具。一项多中心研究发现,在鉴定低危患者的评分分界点(cut-off point)方面,如果分界点定为GBS评分<1和<2,则比将分界点定为0分有更高的特异性(40~49%vs 22%)。如果将低危患者的分界点判定标准设为GBS<2,虽然对上消化道出血的不良后果评估有最高的特异性,但是会遗失3%高危患者。因此作者认为GBS评分<1分最适合用来管理门诊病人[3]。尽管有研究认为GBS评分在预测不良结果方面特异性较低,但工作组认为将分界点定为GBS<1,大多数医院既可以减少不必住院的绝大多数的患者,同时又不会遗漏高危患者。但必须指出的是,再出血风险低并不意味着死亡风险低。患者仍可能死于与非出血相关的疾病如心脏和肺功能不全[4]。因此,GBS评分及其分界点不能作为预测死亡率的评分标准。

表1 上消化道出血Rockall评分

表2 上消化道出血Glascow-Blatchford评分
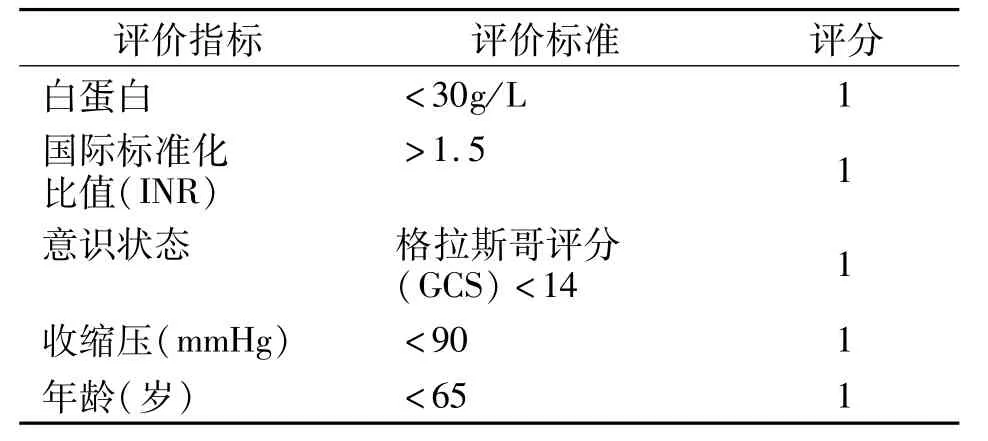
表3 上消化道出血AIMS65评分

表4 上消化道出血PNED评分

表5 美国麻醉医师协会手术风险分级评分(ASA评分)
陈述3:上消化道出血的管理中应限制输血(接受—同意率:100%,证据等级:中等)。
多个国家的多个大样本研究发现,输血会导致患者的再出血几率增加,具体原因不明,其可能的原因是输血也许会逆转出血后的高凝反应,从而导致再出血几率的增加。某些研究发现输血也会导致患者的病死率增加。需指出的是,这些研究采取的输血标准是当血红蛋白≤10 g/dL或≤9 g/dL时就输血,可能输血导致的病死率增加与此相关。亚太工作组推荐限制性输血策略,不管设定输血时血红蛋白的值定为<7 g/dL或8 g/dL。输血时应考虑临床差异。当患者有活动性心血管病时,输血时应基于患者的失血状况和心血管疾病状态考虑。当病人出血量巨大从而导致血压下降时应采取更实际的输血措施。
陈述4:输注血小板对服用抗血小板聚集药物所致的上消化道出血患者无益(接受-同意率88.9%,证据水平:低)。
目前作为心脑血管疾病的初级和次级预防手段,抗血小板聚集的药物,包括阿司匹林和噻氯吡啶类药物如氯吡格雷等的应用日益增加。血小板的寿命为8~10天,而这些药物应用后可以不可逆地阻断血小板聚集,其效果可以持续到急性出血患者停药后数天。很多医院会对这些患者输注血小板,即使患者的血小板计数正常。而一项病例-对照研究发现这一做法并不能降低出血率,反而可能会导致总的死亡率增加[5]。因此工作组不推荐对血小板计数正常的、服用抗血小板药物的患者在出血时输注血小板。因为目前相关的文献较少,证据等级相对较低。
1.2内镜诊疗管理 陈述1:上消化道出血患者出现血流动力学不稳定的休克和相关体征时,应该在复苏和生命体征稳定后再行急诊内镜(接受 — 同意率100%,证据水平:中等)。
对急性非静脉曲张上消化道出血的患者,何时行急诊内镜仍有争议。上一版的亚太共识意见推荐对高危患者在出血后的24小时内行内镜干预,但在24小时内的哪个时间段比如出血后的6小时、12小时还是24小时行内镜诊疗仍无明确意见。一项系统综述发现出血后的12小时内急诊胃镜并不能改善患者的预后,但该综述同时指出对极高危患者和呕血量巨大的患者,一旦复苏后血流动力学稳定,应尽快完善内镜处理[6]。来自英国的一项研究纳入了全国范围内的4478例患者,发现12小时内急诊内镜与24小时内急诊内镜比较,12小时内的急诊内镜诊疗并不能降低患者的病死率和外科手术率[7]。
亚洲的两个研究也关注了这个问题。新加坡的一项队列研究发现,对GBS评分>12分的高危上消化道出血患者,内镜时机是患者所有住院相关死因的最重要影响因素,改善此类患者生存的内镜时间分界点,为症状出现后的13小时内[8]。与之相对的是来自香港的一项研究,将GBS评分>12分的高危患者,随机分成症状出现后6小时内胃镜和24小时内胃镜进行比较,发现6小时内急诊胃镜患者并无明显获益。尽管出血后6小时内患者因为出血更活跃需要内镜止血,但是对防止再出血、死亡、降低输血需求和缩短住院日方面并无益处。作者因此认为,对所有急性非静脉曲张上消化道出血的患者,6小时内行急诊胃镜并无必要[9]。工作组认为内镜时机应酌情处理,对部分血流动力学不稳定或休克的高危患者,在复苏和血流动力学稳定后,在住院后12小时内应用急诊胃镜可能获益。不需要对所有患者行早期急诊内镜检查,证据等级为中等。
陈述2:内镜下喷洒止血粉末(如COOK公司的Hemospray)可以用于非静脉曲张上消化道出血患者的临时止血(接受 — 同意率83.3%,证据等级:低)。
止血粉易于使用并且相关副作用较少,既可单独用于止血,也可与其他止血方法联合使用。使用止血粉后第二天复查内镜,大多数止血粉会洗脱,留下清洁未出血的病变,从而可以进一步获得确切治疗。出血后局部喷洒止血粉效果较好,成功率可达80%-95%,但是也有10%~40%的再出血几率。目前止血粉的使用,临床研究均为回顾性的病例报道,缺乏大规模的随机对照RCT研究,本工作组仅作有限推荐。工作组建议在缺乏内镜专家或尝试其他效果确切的止血方法无效后,可以使用止血粉临时控制出血。止血粉既可用于口服抗凝药物导致的出血[10],对消化道恶性疾病导致的出血,也可以使用止血粉止血。
陈述3:内镜下吻合器OTSC(Over-the-scope-clipping devices)可用于常规内镜治疗难以止住的出血(接受—同意率94.4%,证据等级:中等)。
OTSC常用于消化道瘘口和术后伤口的闭合,对操作者的内镜技巧有一定要求。一项随机、对照、多中心的研究,比较了OTSC和内镜下常规夹子对消化性溃疡出血的止血效果,显示OTSC的止血效果更优(96.8%vs.62.5%),治疗后7天内再出血的几率差异不大(24.4%vs.33.3%)[11]。因此,工作组建议,如果常规的内镜止血方法如金属夹闭合、热凝、注射后仍难以止血,可以使用OTSC。有大血管破裂的消化性溃疡出血,OTSC可能可以作为一线治疗方法。
陈述4:EMS和ESD术后的迟发性出血内镜治疗方式与消化性溃疡相似(接受—同意率89%,证据等级:中等)。
内镜下的黏膜切除术(endoscopic mucosectomy EMS)和内镜黏膜下剥离术(endoscopic submucosal dissection ESD)正在世界范围内的三级医院内镜中心日益普及,手术相关的并发症,如迟发性出血也需要来自内镜专家的更多指导。一项荟萃了70多个研究的META分析阐明了EMS和ESD的相关危险因素[12]。有5.1%的ESD病人会出现术后出血;已明确的风险因素包括男性、抗凝药物应用史、慢性肝病或肾病、肿瘤大于2 cm或切除标本大于3 cm、病变位于小弯侧、平坦或凹陷性病变以及侵袭性肿瘤。手术时间长短是否ESD术后出血的危险因素并不明确,但是手术时内镜下止血不完全是一个明确的危险因素。
大多数的ESD术后出血发生在术后24小时内,出血来自于黏膜层和黏膜下层的局限性的灶性出血点,并未穿透固有肌层,因此,止血相对容易,其方式与消化性溃疡的止血方法也并无不同。术后再次内镜检查与术后出血的减少并无相关性,质子泵抑制剂是否优于H2受体拮抗剂目前也并无一致意见。
1.3内镜诊疗后管理 陈述1:高剂量的质子泵抑制剂口服可以作为辅助手段用于内镜治疗后再出血的预防(接受— 同意率:88.9%,证据等级:中等)。
高剂量的PPI静脉内给药是上消化道出血的标准治疗方法。新的研究发现口服给药同样可以防止消化性溃疡的出血复发。来自亚洲的三个研究,比较了质子泵抑制剂静脉给药和口服给药的效果,发现两者在30天内是否再出血、是否需要输血及再次内镜治疗、住院天数方面并无差异[13-15]。但是工作组认为,该结论仍然需要更强力的RCT研究支持。因此工作组强调,口服给药只能作为内镜治疗的辅助方法,只有当确切的内镜止血完善后,才能予以高剂量口服给药以预防再出血。高剂量口服PPI的标准是埃索美拉唑每天至少80mg(或相等剂量的其他PPI),连用3天,因为3天内是再出血的高峰期。如果患者病情稳定,3天后改为标准剂量口服。
陈述2:当质子泵抑制剂与氯吡格雷合用时,无需选择特定的品种(接受-同意率:94%,证据等级:中等)。
既往的研究认为,某些PPI如奥美拉唑可能会与氯吡格雷竞争细胞色素酶 CYP450的 CYP2C19代谢位点,从而可能会抑制氯吡格雷引起的抗血小板聚集作用,导致高危心血管病患者的严重心血管不良事件(major adverse cardiovascular events MACE)的增加,而兰索拉唑、泮托拉唑和雷贝拉唑对氯吡格雷的影响则较小。但是来自日本、荷兰的几项大样本的回顾性队列研究发现,PPI合用氯吡格雷,不仅对心血管不良事件增加无影响,对中风等脑血管不良事件的发生也并无影响[16-18]。最强力的支持证据来自于2010年发表在《新英格兰医学杂志》海外版上的一篇纳入了三千多例患者的RCT研究:氯吡格雷与胃肠道事件的优化临床试验——the Clopidogrel and the Optimisation of Gastrointestinal。3759例高风险的、服用了阿司匹林和氯吡格雷双抗的心血管病患者,随机分配入奥美拉唑服用组和安慰剂对照组,奥美拉唑可以显著降低胃肠道不良事件(实验组vs.对照组为1.2%vs.2.7%),而心血管不良事件并无差别[19]。该研究的数据2016年经过重新统计,再次证实奥美拉唑合用氯吡格雷不会导致心血管不良事件的增加[20]。
陈述3:ESD术后的患者不推荐常规行二次内镜检查(接受 — 同意率:88.9%,证据等级:中等)。
胃的ESD术后所造成的医源性溃疡,其小动脉常常暴露在固有肌层之上,其病理学方面与消化性溃疡不同的是,其周边更少纤维化,因此使用金属夹及热凝止血,相对消化性溃疡要容易。基于此方面的考虑,工作组认为ESD术后再次内镜检查并无必要。多个随机对照研究也证实了ESD术后无论有无再次内镜检查,两者在防止再出血和输血方面并无差异。
陈述4:有心血管栓塞风险的高危病人,停用的抗血小板聚集药物应在止血后尽快恢复使用(接受 — 同意率:100%,证据等级:高)。
服用抗凝药物的非静脉曲张上消化道出血患者,常常需要面临的一个困境是停用这些药物以止血,还是继续使用这些药物以避免血栓形成。来自香港的研究发现,高风险的心血管病人止血后立即再次服用阿司匹林,可以明显增加30天生存率,而致命的大出血风险其几率并未显著增加[21]。另一回顾性研究发现,因出血停用阿司匹林2年后,患者的心血管不良事件和心源性死亡风险增加了7倍[22]。
继续服用阿司匹林带来的另一个问题,是它是否会影响NSAID药物所致溃疡的愈合。中国台湾的研究发现,在服用阿司匹林的同时服用或不服用埃索美拉唑,两者在溃疡愈合率方面并无差异[23]。当使用PPI治疗消化性溃疡时,目前也没有证据表明服用阿司匹林会延迟溃疡的愈合。需要注意的是这两项来自亚洲的研究中,患者使用的是较小剂量阿司匹林(80~100 mg/天)。
目前还没有关于应该何时重新使用抗血小板药物方面的研究,工作组建议止血后应尽快恢复使用。如果内镜检查发现溃疡基底部清洁,建议1天后恢复;如果进行了内镜止血治疗,建议3天后恢复,因为72小时为再出血的最高风险期。
陈述5:接受两种抗血小板药物治疗的上消化道出血患者,止血后至少要先恢复使用其中一种(接受 — 同意率:94.4%,证据等级:低)。
最常使用的抗血小板药物为环氧合酶类抑制剂(如阿司匹林)和噻氯吡啶类药物(如氯吡格雷);停用阿司匹林后,血小板功能的完全恢复需要7~9天,而噻氯吡啶类药物则至少需要5~7天。使用两种抗凝药物引起的出血风险较单抗药物高3倍。研究发现,仅停用氯吡格雷,冠脉支架内血栓导致的堵塞可延迟至122天,而两种药物都停用,则在短至7天的时间内支架就会堵塞[24]。因此,对接受了冠脉介入手术的患者,美国胃肠内镜学会(ASGE)建议应当避免停用所有抗凝药物,如果患者只使用了阿司匹林,建议继续使用,因其导致再出血的风险较低;对于高栓塞风险的患者(如安装有药物涂层冠脉支架的患者),氯吡格雷的停用时间不宜超过5天。
工作组建议必要时咨询心血管专家如何使用抗凝药物。基于抗血小板聚集药物的特性,工作组不建议低风险的上消化道出血的患者停用该类药物。
陈述6:有心血管栓塞风险的高危患者发生上消化道出血,其使用的直接口服抗凝药(direct oral anticoagulant DOAC)或华法林应当在止血后尽快恢复使用(接受—同意率83.3%,证据等级:低)。
这类患者主要患有房颤和/或瓣膜性心脏病,对这类患者发生出血后如何使用抗凝药物的临床研究目前还是比较缺乏。该类患者使用抗凝药物时应比较其获益和风险。当发生急性上消化道出血时,应暂时停用口服抗凝药如达比加群和华法林,尽快完成内镜下止血治疗。如果是服用了华法林,可给予Ⅳ因子促凝血复合物、维生素K和新鲜冰冻血浆来抢救。Ⅳ因子促凝血复合物联合维生素K,可以逆转华法林的抗凝作用,无须考虑国际标准化比值INR,目前的研究并未发现INR与上消化道出血的临床表现和结果有相关性。Ⅳ因子促凝血复合物优于新鲜冰冻血浆,其优点在于起效快并且输液量可以相对较少。美国FDA于2015年批准的药物idarucizumab为达比加群的单克隆抗体,5 g的idarucizumab可以在4小时内逆转达比加群的抗凝作用,但用于非静脉曲张上消化道出血治疗效果不明确,目前相关的临床研究较少。
一旦控制住出血,再次使用口服抗凝药物需要由包括心血管医生、消化科医生和介入科医生的多学科专家团队(multidisciplinary team MDT)商议;如果可行,也可以邀请患者参加。CHA2DS2-VASC和 HAS-BLED两个评分系统可以用于评估患者是否继续使用抗凝药物。高危心血管病人应尽早恢复抗凝药物的使用。大出血后应用达比加群导致的再出血较华法林要少。华法林的再次使用时间点应个体化,因为维生素K会导致华法林的作用受限。一般而言,停用口服抗凝药后1~2天后其抗凝效果会消失,再次使用后几小时内就会发生抗凝效果。因此,有效止血后1~2天内应恢复使用抗凝药物,同时应警惕再出血的风险。高风险的心血管病患者在停用口服抗凝药物期间,可考虑使用肝素或低分子肝素过渡。
2 不被接受的陈述
陈述1:胶囊内镜可以用作需要早期干预的出血患者的分类工具(拒绝-同意率:22.2%)。
修改为:胶囊内镜可以用作患者是否住院的分类工具(拒绝-同意率:39%)。
既往的研究认为,胶囊内镜可以在急诊室进行,有助于急诊医生判断出血量和出血部位,从而可以对患者是否需要住院治疗进行分类。但新的研究发现胶囊内镜在十二指肠出血的患者可视性会降低,对胃贲门以及某些胃内部位会有盲区;急诊胶囊内镜检查也可能耽误患者的常规内镜检查时机[25]。此外,急诊放置胶囊内镜还牵涉到急诊医生的培训及费用-效果比等问题。因此工作组不建议此种情况下把胶囊内镜用作分类工具。
陈述2:等待内镜检查的稳定病人应在内镜检查前静脉内给予质子泵抑制剂(拒绝-同意率:72.2%)。
修改为:等待内镜检查的可疑消化道出血病人检查前应静脉内给予质子泵抑制剂(拒绝-同意率:66%)。
一项荟萃了6个RCT研究、包含了2333例患者的系统综述发现,尽管内镜检查前给予PPI,可能一定程度上会降低出血和需要内镜干预的几率,但总体而言,患者再出血、手术和总的病死率并未相应降低[26]。因此,工作组建议,如果患者在24小时内无法及时获得内镜检查或有经验的内镜医生的诊疗,可以静脉使用PPI以减低近期出血及减少内镜干预的几率。
陈述3:高风险溃疡患者应当使用血管介入栓塞术以阻止复发的溃疡出血(拒绝-同意率:38.9%)。
当溃疡出血初次内镜治疗失败后,再次内镜治疗和外科手术通常是可行的常规治疗选择。血管介入栓塞术通常被认为是内镜止血治疗失败后替代外科手术的一项治疗方法,关于这方面的研究文献相对较少。既往的两项回顾性研究和近期来自香港的一项前瞻性研究,比较了介入治疗和常规治疗方法在输血率、再出血几率、外科手术几率、病死率方面的异同,发现两种治疗方法并无显著的统计学差异,但是总的来讲,血管介入栓塞术有降低再出血、病死率的趋势[27]。溃疡长径≥1.5cm是患者能从血管介入术获益的最佳评估参数。
陈述4:风险分级评分系统应当用于鉴定高风险的内镜治疗,以了解治疗后的溃疡出血是否需要二次内镜检查(拒绝—同意率:55.6%)
修改为:风险分级评分系统对鉴定高风险的内镜治疗后的溃疡出血是否需要二次内镜检查可能有用(拒绝-同意率:23%)
8%~15%的消化性溃疡出血患者会再次出血,其病死率也会有2~5倍的增加。二次内镜的目的是对有可能近期出血的溃疡患者提前进行干预,以预防再次出血,通常是指对有指征的病人24小时内完成内镜诊疗。既往的研究结论自相矛盾,近期的研究发现,如果比较内镜止血和二次内镜检查联合静脉输注PPI,两者在再出血、外科手术、病死率方面并无差异。
二次内镜检查也许对高风险的病人有益,因此风险分级评分系统似乎对这部分患者有帮助。但纵观目前的研究,其结果仍不能提供强有力的证据支持高危患者能从二次内镜检查中获益,因此工作组认为风险分级评分系统的实施将来需要更多的文献支持。
陈述5:多普勒内镜探头应当用于指导内镜止血治疗,以保证充分止血(拒绝-同意率:66%)。
多普勒内镜探头是一种可插入内镜活检钳道的一次性小探头,最近由美国FDA批准上市,通过彩色多普勒超声可发现溃疡基底部的血管。与表面有渗血的溃疡和表面覆盖扁平凝血焦痂的溃疡比较,多普勒内镜探头可以有效发现出血性溃疡的特征一一喷射性出血、血凝块和肉眼可见血管,因其可以显著提高溃疡底部动脉血流发现率,因此多普勒内镜探头也许可以用来改善出血性溃疡的危险度分级。研究发现,在多普勒探头指导下采用热凝、金属夹和/或注射治疗溃疡出血,较无探头辅助的内镜止血可明显降低再出血的几率(由26.3% 降至11.1%)[28],其原理是多普勒探头可以发现溃疡底部的残存血流,因而止血可以更充分。但由于目前的研究样本量较少,也并未说明是否能降低外科手术或血管介入几率以及病死率等,工作组暂不推荐该方法。

