尿液脱落细胞UCA1在前列腺癌的表达及临床意义
沈菁,林有东,陈雯,林志坤,黄毅
(福建医科大学省立临床学院检验科,福建 福州 350001)
前列腺癌是欧美国家男性发病率排名第一的恶性肿瘤,在我国,其发病率也呈明显上升趋势,严重威胁我国老年男性的健康[1,2]。目前,临床上常用直肠指诊、血清中前列腺特异性抗原(PSA)、MRI作为前列腺疾病筛查的常规方法。直肠指诊是一种简单的检查方法,但单用直肠指诊的敏感度仅2%,且检查结果与检查者的经验有关。PSA检测作为最常用的筛查手段,虽敏感度高,但因膀胱镜检、直肠超声、前列腺按摩、前列腺梗死、前列腺炎以及前列腺增生等都会引起血清的PSA升高而导致诊断的特异性较低,造成过度诊断与治疗[3]。MRI虽有良好的软组织分辨力,能为前列腺癌的诊断和临床分期提供重要依据,但当病灶体积较小、出血或受到良性疾病如良性增生结节、慢性炎症及肉芽肿也会表现出低信号,降低了MRI诊断的特异性[4]。前列腺病理穿刺活检虽是前列腺癌诊断的金标准,但穿刺活检属于有创检查,患者的依从性差,且以PSA检测为依据的前列腺穿刺活检阳性率也较低,只有30%左右[5]。因此为提高诊断的准确性寻找并研究前列腺癌新的肿瘤标记物是必不可少的。
近年来的研究发现,长链非编码RNA(LncRNA)可以直接对染色体组蛋白进行修饰,抑制或激活基因的转录,并在多种肿瘤中经常出现失调,在多种生物过程中也具有多种功能[6,7]。UCA1尿路上皮癌相关抗原1(非蛋白质编码),最早在发现膀胱癌表达增高[8],在细胞增殖中发挥作用。UCA1位于人类19号染色体p13位置上。在健康成人中,除心脏、脾脏外,UCA1在正常器官组织均没有表达,而在人胚胎组织中却较高表达[9]。目前国内外也已经对UCA1与肿瘤的关系进行研究,在膀胱癌、乳腺癌、肝癌、结肠癌、胃癌、口腔鳞状细胞癌等均发现UCA1表达的增高与肿瘤的发生发展有关系[10]。但UCA1在前列腺癌的临床研究较少,本研究探讨尿液脱落细胞中的UCA1定量检测对前列腺癌的诊断价值,若可以提高前列腺癌诊断的准确性而且减少了前列腺穿刺活检的侵入性检查,是具有重要的临床意义。
1 材料与方法
1.1 研究对象 选取2017年9月-2018年2月初治泌尿外科住院60例男性患者尿液标本,其中前列腺癌患者30例,年龄(73±8)岁,前列腺增生患者30例,年龄(70±6)岁,均由病理穿刺活检确诊病例,另收集男性健康体检者30例为对照组,年龄(68±6)岁。
1.2 标本 尿液标本采集晨尿10ml 3500r/min离心10min,倒干上清液后加入800μl TransZol UP试剂(北京全式金生物技术有限公司),水平静置使裂解液充分裂解细胞后,使用移液枪反复吹吸至无明显沉淀后,将细胞裂液转移至EP管内,室温静置5min后放入-70℃超低温冰箱中保存。
1.3 检测方法
1.3.1 尿液脱落细胞RNA提取及逆转录 按照福州都拜特生物技术有限公司生产的RNA提取试剂盒提取尿总RNA并用德国eppendenf公司核酸蛋白分析仪进行RNA浓度的检测;根据EasyScriptROne-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒 (北京全式金生物技术有限公司)说明书进行逆转录成cDNA。
1.3.2 RT-qPCR检测UCA1采用Primer primer5.0与Primer-Blast软件进行引物设计,引物由上海生物工程股份有限公司合成,UCA1正向引物:aag cct gat tgg gtg tct tct a,反向引物:gcc ttt gtg ccg cta ctt tta t;内参基因GAPDH正向引物:gga gcg aga tcc ctc caa aat, 反向引物:ggc tgt tgt cat act tct cat gg。按照TransStart Tip Green qPCR SuperMix试剂盒说明书,使用美国ABI公司实时荧光PCR仪,反应条件:首先94℃预变性30s,然后94℃变性5s,60℃退火、延伸31s,共完成45个循环,每个样本复孔检测。
1.3.3 数据处理 尿液脱落细胞UCA1相对表达量采用ΔΔCt法分析,以GAPDH基因作为内参基因,ΔCt=Ct(UCA1)-Ct(GAPDH),ΔΔCt=Δ Ct(患者组)-ΔCt(对照组),UCA1 相对表达量即 2-ΔCt,通过 2-ΔΔCt计算UCA1在前列腺癌组与增生组患者中的相对表达差异。
1.4 统计分析 应用SPSS软件进行统计分析,研究对象年龄组差异比较用T-test检验,两组患者UCA1的相对表达量应用中位数及上下四分位数的形式表示,两组比较采用非参数Mann-Whitney U检验。采用受试者工作特征(ROC)曲线,计算曲线下面积(AUG)。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象年龄比较 对前列腺癌组、前列腺增生组以及健康对照组的年龄差异进行统计学分析,结果显示三组间的年龄分别为72.87±7.69岁、70.29±5.93 岁、以及 68.37±5.80 岁,三组间年龄差异无统计学差异(P>0.05);三组的年龄分组组成也无统计学差异(P>0.05),见表 1。
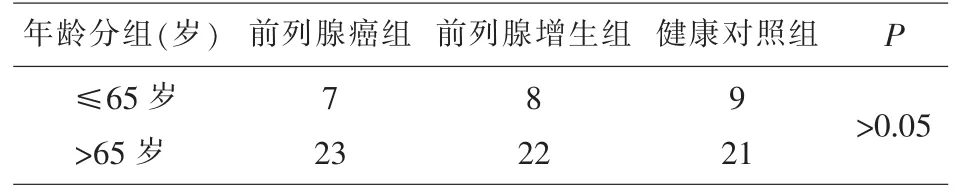
表1 三组研究对象年龄比较
2.2 UCA1在前列腺癌和前列腺增生患者尿脱落细胞中的表达情况 以健康对照者尿脱落细胞UCA1的相对表达量为对照,计算前列腺癌与增生患者尿脱落细胞UCA1的相对表达差异,结果显示前列腺癌患的表达量明显高于前列腺增生患者,差异具有统计学意义(P<0.05)。见表2。

表2 两组患者尿UCA1相对表达水平[中位数,(四分位数)]
2.3 尿脱落细胞UCA1在前列腺癌中的诊断价值以前列腺增生组为参照,尿脱落细胞UCA1诊断前列腺癌的ROC曲线下面积 (AUC)为0.675(95%CI:0.514~0.836),约登指数最大值为 0.338时其诊断的敏感性为38.1%,特异性高达95.7%。见图1。
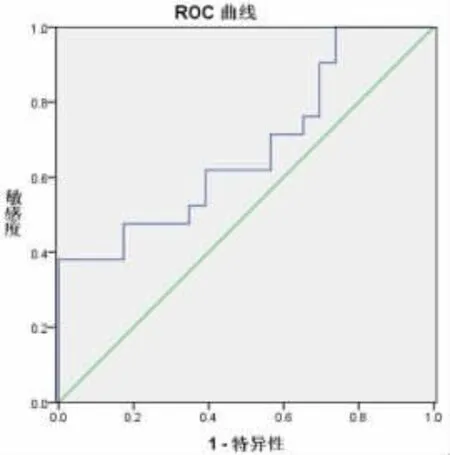
图1 尿脱落细胞UCA1诊断前列腺癌的ROC曲线
3 讨论
前列腺癌是导致老年男性癌症相关死亡的主要原因。由于早期检测和诊断方法的改进以及更有效的治疗策略,过去十年中与PC相关的死亡人数有所下降[11],然而,由于不清楚潜在的分子机制,这种疾病的治疗选择有限,预后不良,更准确的预测生物标志物是国内外众多学者致力钻研的热点与重点。真核基因组编码许多长的非编码RNA(lncrnas),这些长的非编码RNA被定义为长度超过200个核苷酸的内源性细胞RNA,但缺少有效长度的开放阅读框[12]。估计表明人类lncRNA的数量在10000到20000之间[13]。尽管有这么多的基因,但只有少数的lncRNA具有特征。大多数特征的lncRNA在癌细胞中表现出不受管制的表达,在癌细胞中发挥致癌或肿瘤抑制功能[12]。UCA1是最近发现的一种在各种类型的癌症中异常表达的lncRNA。UCA1表达调控癌细胞增殖、迁移和侵袭[14]。Huang J等[15]报道,UCA1竞争性地抑制了hn-RNP对p27的抑制作用,从而显著促进乳腺癌的增殖。Fan Y等[16]报道,UCA1通过以Wnt6依赖的方式激活Wnt信号,在膀胱癌的化疗抵抗中起着重要作用,UCA1参与了PI3K途径来调节细胞周期。然而,UCA1在前列腺癌发生和治疗反应中的生物学作用和临床意义尚不清楚。
在本研究中,我们用定量检测前列腺癌和前列腺增生患者尿液脱落细胞UCA1的表达水平,结果表明,前列腺癌患者的尿UCA1表达显著上调,明显高于前列腺增生者 (P<0.05)。这与Shilong Zhang等[17]研究的结果一致。Shilong Zhang等发现UCA1在PCA细胞系和组织样本中显著上调,UCA1高表达与高Gleason评分、晚期TNM分期和PCA患者总生存率较低呈正相关。Shilong Zhang还发现ATF2是UCA1的直接靶基因,UCA1作为一种竞争性的内源性RNA调控ATF2表达。UCA1还直接与miR-204相互作用,降低miR-204与ATF2 3'UTR的结合,进而抑制miR-204对ATF2 mRNA的降解,这些结果表明UCA1可能参与大多数人PC的发展、进展和预后。
为进一步判断尿UCA1对前列腺癌的诊断效率,本研究以前列腺增生组为对照组,绘制ROC曲线,尿UCA1诊断前列腺癌的ROC曲线面积为0.675,诊断的敏感性仅38.1%,这可能由于尿液中脱落肿瘤细胞数量不够造成。但其特异性高达95.7%,这有助于前列腺癌和增生患者的鉴别诊断。
中国前列腺癌诊疗指南(2014版)明确指出血清PSA作为前列腺癌的诊断指标,其受年龄影响。因此我们对研究对象病例的选择也关注到了这个问题,对所选的年龄分组进行统计学分析,在检验水准P<0.05条件下,研究对象的三个组别均没有统计学差异,因此本研究排除了年龄这一变量的干扰。
综上所述,UCA1基因在前列腺中的作用其潜在机制仍有待确定,但其在前列腺癌患者尿液脱落细胞中呈高表达水平,诊断特异性高,有助于前列腺癌和增生疾病的鉴别,UCA1可能是前列腺癌诊断的潜在生物标志物。

