VEGF 、Ang-2在血管瘤中的表达及临床意义
薛娟,高磊,王艳秋
(1.河南科技大学临床医学院,河南 洛阳 4710002;河南科技大学第一附属医院检验科,河南 洛阳 471000;3.河南科技大学第一附属医院消化内科,河南 洛阳 471000)
血管瘤是由胚胎期间成血管细胞增生而形成的的良性肿瘤,新生儿发病率为1%~2%,女性多见,男女比例约为1:3[1,2]。据统计[3]发生于口腔颌面部的血管瘤占全身的60%,发生于躯干的血管瘤占全身的25%,发生于四肢的血管瘤占全身的15%,其中大多数发生于口腔黏膜、面部皮肤、皮下组织、舌唇等表浅位置,易造成容颜缺损,也有少数发生于颌骨内或深部组织,可影响机体功能甚至危及生命。有文献报道[4]血管瘤具有血管内皮细胞(VEC)增殖和新生血管生成的特点,而血管生成需血管内皮生长因子(VEGF)和血管生成素(Ang)参与。大量研究证明,VEGF、Ang-2在非小细胞肺癌(NSCLC)[5]、多发性骨髓瘤(MM)[6]、子宫肌瘤[7]等肿瘤组织中异常表达,提示VEGF、Ang-2与肿瘤发生发展相关。但目前国内关于VEGF、Ang-2在血管瘤中表达的研究较少。因此,本研究通过免疫组织化学染色法及RT-PCR检测VEGF、Ang-2在毛细血管型血管瘤标本、毛细血管畸形标本及正常皮肤组织标本中的表达情况,旨在探讨VEGF、Ang-2应用于血管瘤诊疗的意义,现报告如下。
1 材料与方法
1.1 标本采集 收集2017年1月-2017年9月我院病理科存档的毛细血管型血管瘤组织标本83例为毛细血管型血管瘤组,请其中男39例,女44例;年龄 1个月~11岁,平均年龄(5.49±1.23)岁。 同期毛细血管畸形组织标本56例为毛细血管畸形组,其中男26例,女30例;年龄1个月~12岁,平均年龄(5.96±1.06)岁。另取同期含有正常血管的皮肤组织标本56例为对照组,其中男27例,女29例;年龄 1个月~13岁,平均年龄(6.11±1.45)岁。 入选标准:⑴行手术切除的皮肤毛细血管型血管瘤患者均经病理检查证实,且无其他肿瘤病史;⑵毛细血管型血管瘤部位为颌面部、四肢、躯干;⑶毛细血管型血管瘤处于增殖期;⑷入组者资料完整;⑸本研究经本院伦理委员会批准,患者知情同意。排除标准:⑴毛细血管型血管瘤处于退化期;⑵术前口服糖皮质激素;⑶合并内分泌系统疾病。三组标本来源者性别、年龄比较无统计学差异 (P>0.05)。
1.2 主要试剂 兔抗人VEGF单克隆抗体(Signalway antibody)、山羊血清(Epit Mics)、DAB 显色试剂盒 (北京中杉金桥生物有限公司)、羊抗鼠IgG(Cell signaling)、兔抗人 Ang-2 单克隆抗体(上海仁捷生物科技有限公司)、PBS磷酸缓冲液(上海恒远生物科技有限公司)、二甲苯(上海慧颖生物科技有限公司)、苏木精染色液(上海谱振生物科技有限公司)、梯度酒精(广州维恩基因科技有限公司)、中性树脂(梅州市守合科技有限公司)、柠檬酸钠缓冲液(上海基星生物科技有限公司)、VEGF引物 (上海玉博生物科技有限公司)、Ang-2引物(德国Qiagen)、异丙醇(深圳聚正科技有限公司)、总RNA提取试剂盒(北京博凌科为生物科技有限公司)、1.5%琼脂糖 (美国AMRESCO公司)、RTPCR扩增试剂盒(北京厚生博泰科技有限公司)。
1.3 RT-PCR 取各组标本按总RNA提取试剂盒操作步骤提取总RNA,检测RNA浓度及纯度,取5μg RNA逆转录为 cDNA后行 RT-PCR反应,PCR 反应条件:94℃预变性 4min,94℃变性 60S,58℃退火 60s,72℃延伸 60 S,32 次循环。 将 PCR产物经1.5%琼脂糖凝胶电泳60min,凝胶成像系统扫描分析,以目的基因与GAPDH吸光度比值计算相对表达量。VEGF、Ang-2mRNA相对表达量计算方法:基因相对表达量=2-△△Ct。
1.4 免疫组织化学SP染色法 将各组标本用组织切片机切成4μm连续切片,脱蜡,高压抗原修复,PBS漂洗,内源性过氧化物酶灭活,加山羊血清封闭,滴加兔抗人VEGF单克隆抗体(浓度1:200)和兔抗人 Ang-2单克隆抗体 (浓度1:200),4℃孵育过夜,PBS漂洗,滴加生物素标记的羊抗鼠IgG(浓度 1:100),37℃孵育 60 min,PBS 漂洗,DAB 显色5min,PBS终止反应,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封固,显微镜下观察VEGF、Ang-2蛋白表达。判定标准:由两位经验丰富具有独立执业资格的病理科医生对染色结果进行评定和复核。每张切片随机选取5个视野,每个视野计数100个细胞,计算阳性细胞的百分比,按着色细胞百分率记分:阳性细胞率<5%记作0分,阳性细胞率5%~25%记作1分,阳性细胞率26%~50%记作2分,阳性细胞率>50%记作3分。按着色强度记分:0分为不着色,浅黄色记作1分,棕黄色记作2分,棕褐色记作3分。着色细胞百分率记分与着色强度记分相乘为最终得分:乘积<4分为阴性表达,乘积≥4为阳性表达。
1.5 统计学方法 采用spss22.0软件进行统计分析。计量资料比较采用Kruskal-Wallis H秩和检验或单因素方差分析,计数资料比较采用卡方检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 各组VEGF mRNA表达水平 VEGF mRNA在毛细血管型血管瘤组、毛细血管畸形组中表达量显著高于对照组,有统计学差异 (P<0.05);VEGF mRNA在毛细血管型血管瘤组中表达量显著高于毛细血管畸形组,有统计学差异(P<0.05),见表 1、图1。
表1 各组VEGF mRNA表达水平()

表1 各组VEGF mRNA表达水平()
注:与对照组比较,*P<0.05;与毛细血管畸形组比较,#P<0.05
组别 n毛细血管型血管瘤组毛细血管畸形组对照组83 56 56 FP/ /VEGF mRNA 1.28±0.09*#1.23±0.07*1.00±0.06 235.746<0.001

图1 各组VEGF mRNA表达水平比较
2.2 各组VEGF蛋白表达水平 VEGF蛋白定位于血管内皮细胞的细胞膜或细胞质中,呈棕黄色或棕褐色颗粒。VEGF蛋白在毛细血管型血管瘤组、毛细血管畸形组中阳性表达率显著高于对照组,有统计学差异(P<0.05);VEGF蛋白在毛细血管型血管瘤组中阳性表达率显著高于毛细血管畸形组,有统计学差异(P<0.05),见表 2、图 2。
2.3 各组Ang-2 mRNA表达水平 Ang-2 mRNA在毛细血管型血管瘤组、毛细血管畸形组中表达量显著高于对照组,有统计学差异(P<0.05);Ang-2 mRNA在毛细血管型血管瘤组中表达量显著高于毛细血管畸形组,有统计学差异(P<0.05),见表3、图 3。

图2 毛细血管型血管瘤组及毛细血管畸形组VEGF蛋白表达水平(×400)
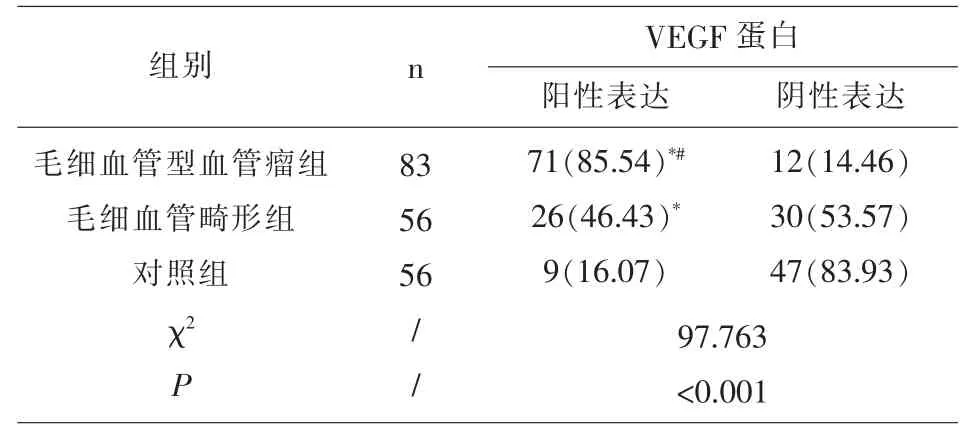
表2 各组VEGF蛋白表达水平[n(%)]
表3 各组Ang-2 mRNA表达水平()

表3 各组Ang-2 mRNA表达水平()
与对照组比较,*P<0.05;与毛细血管畸形组比较,#P<0.05
组别 n毛细血管型血管瘤组毛细血管畸形组对照组83 56 56 HP/ /Ang-2 mRNA 0.56±0.13 0.34±0.08 0.11±0.05 26.438<0.001

图3 各组Ang-2 mRNA表达水平比较
2.4 各组Ang-2蛋白表达水平 Ang-2蛋白定位于血管内皮细胞的细胞质中,呈棕黄色或棕褐色颗粒。Ang-2蛋白在毛细血管型血管瘤组、毛细血管畸形组中阳性表达率显著高于对照组,有统计学差异(P<0.05);Ang-2蛋白在毛细血管型血管瘤组中阳性表达率显著高于毛细血管畸形组,有统计学差异(P<0.05),见表 4、图 4。

图4 毛细血管型血管瘤组及毛细血管畸形组Ang-2蛋白表达水平(×200)

表4 各组Ang-2蛋白表达水平[n(%)]
2.5 VEGF、Ang-2在毛细血管型血管瘤中表达的相关性 VEGF、Ang-2在毛细血管型血管瘤中表达呈正相关(P<0.05),见表 5。

表5 VEGF、Ang-2在毛细血管型血管瘤中表达的相关性
3 讨论
血管瘤是婴幼儿常见的良性肿瘤之一,其生长迅速时易破坏周围组织,引发溃疡、感染、出血等并发症[8]。临床上治疗血管瘤方法很多,手术切除、放射疗法、局部封闭疗法、冷冻疗法等均有一定疗效,但由于血管瘤多发生于指趾、眼睑、舌头、口唇、鼻尖等特殊部位,如进行手术切除、冷冻疗法会导致组织缺损、皮肤萎缩、瘢痕形成,从而影响容貌或机体功能[9]。因此,从分子标志物角度研究血管瘤发病机制可为临床辨别血管瘤、指导血管瘤治疗寻找有效帮助。
目前,对于血管瘤的发病机制尚不清楚,有研究认为[10]其发生与转化生长因子β(TGF-β)、基质金属蛋白酶(MMP)等血管生成因子及血管抑制因子 (AIF)、细胞外基质(ECM)有关。有文献提到[11]血管瘤是由残余的胚胎成血管细胞向邻近组织侵入,形成内皮样条索,经管化后与遗留下的血管相连而形成,血管内皮细胞增殖及血管生成在其病理演变过程中扮演着重要角色。而Taktak-Benamar A等[12]发现VEC增殖可由VEGF或Ang水平异常引起。VEGF是一种由两条相同肽链通过二硫键构成的外分泌二聚体糖蛋白,也是一种可扩散的内皮细胞特异性有丝分裂原,能提高血管内皮渗透性,引起血浆蛋白外渗。李莉等[13]研究中提到VEGF为目前已知最强的可直接促进血管生成的血管生成因子(AF),其在多发性骨髓瘤、子宫肌瘤等肿瘤患者血液或癌组织中能够检测到,且与患者临床病理分期密切相关。相关研究显示[14]VEGF在血管生成、维持血管内皮功能方面可发挥重要作用,其与VEC上的血管内皮生长因子受体1(Flt-1)、血管内皮生长因子受体2(Flk-1)高亲和力结合后,可形成受体二聚体,发生自体酪氨酸磷酸化,诱导VEC增殖、移行和分化形成管腔样结构。Fagiani E等[15]采用免疫组化法检测VEGF蛋白在增生期、消退期血管瘤中表达情况,发现消退期血管瘤VEGF蛋白表达明显低于增生期血管瘤,提示VEGF与血管瘤的血管增生有密切关系,这在本研究中也得到了证实。本研究结果显示,VEGF在毛细血管型血管瘤中呈阳性表达,着色较强,且其表达水平明显高于毛细血管畸形组及对照组。分析其原因可能是因为,在VEGF刺激下血管内皮生长因子受体Flk-1迅速磷酸化,从而激活丝裂原活化蛋白激酶(MAPK)通路,加速VEC有丝分裂,造成VEC大量增殖,导致肿瘤形成[16]。
Ang是一族分泌型的生长因子,包括 Ang-1、Ang-2、Ang-3、Ang-4四种分子,其可维持血管完整性,能刺激血管生长。Ang-2为Ang家族中的一种,主要分布于卵巢、子宫、胎盘等与血管重建有关的部位,有研究显示[17]Ang-2是肿瘤血管新生起始及加强的重要因素,与肿瘤血管形成数目、临床分期关系密切。结合相关资料[18]我们分析Ang-2对肿瘤血管生成的影响可能与局部微环境有关,当VEGF存在时,Ang-1的天然拮抗剂Ang-2可拮抗Ang-1,破坏血管的稳定性,促进新生血管形成;当VEGF缺乏时,Ang-2可抑制Ang-1,导致血管断裂,促使血管消退。Solecki G等[19]研究中提到,过度表达Ang-2,鼠血管结构发生改变,由正常树状变为虫蛀状,VEC从血管表面分离堆积到一起,提示Ang-2与血管变化密切相关。本研究中,Ang-2蛋白定位于血管内皮细胞的细胞质中,呈棕黄色或棕褐色颗粒,且Ang-2蛋白及mRNA毛细血管型血管瘤组中表达水平均显著高于毛细血管畸形组、对照组,提示Ang-2对病变血管的形成可能具有促进作用。
综上,VEGF、Ang-2在血管瘤中均呈高表达,二者相互作用可促进血管瘤增殖,其表达情况为临床诊疗血管瘤提供了新的方向。

