叶面喷施寡糖对生菜生长和品质的调节作用*
何久兴,赵解春**,白文波,郑 莉,张元成,于萌萌,木元久,斋藤信,吕国华**
叶面喷施寡糖对生菜生长和品质的调节作用*
何久兴1,赵解春1**,白文波1,郑 莉1,张元成2,于萌萌2,木元久3,斋藤信4,吕国华1**
(1. 中国农业科学院农业环境与可持续发展研究所/农业部农业环境重点实验室,北京 100081;2. 山东宝力生物质能源股份有限公司,东营 257067;3. 福井县立大学生物资源学部,日本福井 910-1195;4. 昭和电工株式会社,日本东京 105-8518)
为探究不同单一寡糖和复配寡糖对作物生长发育、产量及品质的影响,选择生长周期较短的生菜品种“意大利耐抽薹”作为研究对象,以80mg·L−1的纤维寡糖(ZH-A)、低聚木糖(ZH-B)、甲壳低聚糖(ZH-C)和以上3种寡糖等质量比的复配寡糖(ZH-M)以及多糖海藻酸钠(GY-D)对定植后的生菜进行4次叶面喷施处理,以喷清水为对照(CK)。从定植后的第3天(三叶一心)开始,每隔2d连续喷施4次,至采收期(定植23d)测定生菜的生长特征(生物量、叶面积、荧光光合)、根系表型特征(根长、根表面积、根体积)以及品质特征(可溶性糖、叶绿素、Vc、硝酸盐)。结果表明:单一寡糖、复配寡糖及海藻酸钠多糖处理均能显著增加生菜生物量;纤维寡糖(ZH-A)对促进根系生长及降低硝酸盐含量具有显著效果;甲壳低聚糖(ZH-C)对叶绿素含量、最大光化学效率Fv/Fm及可溶性糖含量有显著的提高作用;复配寡糖对生菜地上部、地下部及品质的增长和提升效果明显优于单一寡糖和多糖,采收期地上部鲜重及叶面积分别增加52.58%和57.60%,根干重、总根长、总体积及总表面积分别增加35.07%、89.10%、49.23%和40.68%,可溶性糖增加25.20%,叶绿素含量增加21.50%,Vc含量提高12.08%,硝酸盐含量降低27.65%。综上可知,不同寡糖对生菜生长特征和生理性状的作用效果和调控机制具有明显差异;复配寡糖对生菜促生长和提品质的调节效果显著优于单一寡糖。
生菜;低聚糖;复配寡糖;多糖;硝酸盐
据统计,中国化肥农药的用量近年一直居于世界第一。每年农药用量在50万~60万吨,其中80%~90%流入土壤及大气环境,最终通过食物链又进入餐桌[1]。不仅造成严重的环境问题,同时也给人类身体健康造成危害。因此,寻找一种新型材料,既能促进作物生长发育,保证产量,提高品质;又能提高作物抗性,应对胁迫环境,减少化肥农药用量,缓解农业增产与环境安全的矛盾,显得尤为重要。
多糖和寡糖来源于自然界中的壳类、藻类、秸秆等天然存在的物质,高效安全、无毒易溶且成本较低,通常在极低浓度下就能对作物的生长发育起到显著的增益作用[2]。这为解决当前农业生产所面临的困境提供了一个新的方向。作为生理活性物质,可用于作物的生长调控、抗逆调节、品质改善、土壤改良等方面的研究。早期相关研究以多糖为主,Ziani等研究表明,施用4%的壳聚糖(MW=149kDa)能有效增进种子活性,提高萌发势,促进植株生长[3]。而通过对壳聚糖进行乙酰化等结构化学改性,不仅能促进作物的生长发育,也能提高对不同逆境的耐受能力[4]。Walker等发现壳聚糖也可作为激发子信使诱导豌豆作物生成抗毒素[5],从而提高作物自身的抗病性。而适量壳聚糖处理对作物品质也有一定程度的提升,Salachna等对番茄进行一定周期的叶面壳聚糖喷施后发现,壳聚糖处理的番茄单果更重,果实色泽更好[6]。壳聚糖对根系土壤环境也有一定的改良作用。将壳聚糖搭配其它元素制成胶体溶液、颗粒或粉剂,施加到土壤中,不但能够有效改善土壤团粒结构[7],而且在土壤修复中还可作为螯合剂使用以增强植物对重金属离子的吸收[8]。
与多糖相比,功能性寡糖(又称低聚糖)分子量更小,只含有2~10个糖苷键,通常作为益生元、食品添加剂和饲料添加剂等,广泛应用于食品和饲料行业。在作物种植中,寡糖应用较少,而相应的寡糖种类也少。陈火君等将低聚木糖作为土壤调理剂,发现其能显著提高土壤微生物数量和酶活性,改善土壤生态系统,促进作物生长[9]。低聚木糖处理大豆种子后,大豆抗花叶病毒能力明显增强[10]。但是,其它类型寡糖,如纤维寡糖、甲壳低聚糖等在作物生产方面的应用研究报道鲜见。本研究选用新工艺生产的纤维寡糖、低聚木糖、甲壳低聚糖,以及三者等质量比(1:1:1)均匀混合而成的复配寡糖和海藻酸钠多糖,在生菜定植后进行叶面喷施,研究不同单一寡糖和复配寡糖对生菜生长及品质的作用效果,以期为寡糖产品在农业上的开发和推广应用提供新的理论依据。
1 材料与方法
1.1 试验材料
试验于2018年12月−2019年5月在中国农业科学院农业环境与可持续发展研究所人工气候室完成。供试作物为生菜(var.Hort.),品种为“意大利耐抽薹”(北京某研究所),寡糖材料为纤维寡糖(ZH-A)、低聚木糖(ZH-B)、甲壳低聚糖(ZH-C),以及由以上3种材料混合配制而成的复配寡糖(ZH-M),三者质量比为1:1:1。多糖选用在农业上应用效果较理想[11]的海藻酸钠(GY-D,化学纯)作为参照,分析寡糖与多糖的生长调节效果。寡糖(ZH-A、ZH-B、ZH-C)由日本某公司提供,纯度90%~95%,平均分子量分别为827、561、1159。
1.2 试验设计
根据前期浓度(20、40、80、100、200、400mg·L−1)筛选试验,将最佳浓度80mg·L−1确定为试验浓度。人工气候室环境条件为:昼(7:00−19:00)/夜(19:00−次日7:00),相对湿度40%,光照强度240umol·m−2·s−1,试验采用水培法,水培营养液选择日本山崎配方。母液配置(g·L−1):35.4Ca(NO3)2·4H2O、40.4KNO3、7.7NH4H2PO4、24.6MgSO4·7H2O、2.78EDTA- 2Na、3.72FeSO4·7H2O、0.286H3BO3、0.213MnSO4·4H2O、0.022ZnSO4·7H2O、0.008CuSO4·5H2O、0.002H32Mo7-N6O2。使用时将母液作100倍稀释。以容积为1.2L的黑色遮光塑料桶作为培养器皿。营养液每3d更换一次,pH值控制在6.4。
生菜种子浸种后播于育苗盘中,置于人工气候箱催芽,温度控制在28℃,待80%种子出芽后,开始正常温光培养。长至两叶一心时,挑选上部及根区长势基本一致的生菜幼苗进行定植并移入人工气候室生长。从定植后的第3天(三叶一心)开始,分别以80mg·L−1的纤维寡糖(ZH-A)、低聚木糖(ZH-B)、甲壳低聚糖(ZH-C)和复配寡糖溶液(ZH-M)对整个植株的叶面进行喷施处理,以80mg·L−1的海藻酸钠(GY-D)溶液作实验效果参照,以喷清水作为实验对照处理(CK)。喷施时间选择9:00,喷施量以叶面下滴为参照。考虑生菜生长周期短,处理时间宜短,因此,试验采用等间隔(每次间隔2d)连续喷施4次。喷施结束后,所有处理培养至采收期(定植23d)进行测产和品质调查。
1.3 指标测定
1.3.1 生长指标
定植23d后,每个处理随机挑选4株测定生长指标。从根茎结合处将植株分为地上部和地下部,地上部主要测定单株产量(鲜重)、干重以及叶面积指数。每株称取鲜重后,将所有叶片剥离展开,利用叶面积扫描仪(LI-3000C)获取叶面积参数,再105℃杀青10min,70℃烘干24h测干重;将完整根系放入根系扫描盘,使用WinRHIZO根系扫描系统(加拿大产)进行根系成像及数据分析。擦干根系表面水分,称得鲜重,之后再放入烘箱105℃杀青,70℃烘干24h得到干重。
1.3.2 生理品质指标
定植23d后,每处理随机挑选4株长势均匀的生菜,除去叶柄,液氮速冻后放−80℃冰箱保存,之后测定可溶性糖、叶绿素、Vc以及硝态氮含量。可溶性总糖采用苯酚法测定[12];叶绿素含量采用丙酮乙醇浸提法测定[13];硝态氮含量采用水杨酸法测定[14];Vc含量采用2,6-二氯靛酚钠比色法测定[15]。
1.3.3 荧光指标
定植23d后,每处理随机挑选3株长势均匀的生菜,20℃暗处理1h后,每株取自下往上数第7、8成熟叶片,平铺于荧光成像系统x-y台上,每叶片选择4个样本点,使用Imaging PAM2000荧光成像系统(德国产)进行荧光成像,测定荧光数据。
1.4 数据处理和分析
试验数据分析和制图利用SPSS.24以及Origin9.0,差异性检验采用LSD(P<0.05)方法。
2 结果与分析
2.1 叶面喷施寡糖对生菜生长发育的影响
2.1.1 单株地上部鲜重
定植23d后各处理单株地上部鲜重如图1。由图可见,喷施清水处理(CK)生菜地上部鲜重最小,其它寡糖和多糖溶液喷施处理地上部鲜重均显著增加。其中,海藻酸钠(GY-D)处理采收期地上部鲜重比CK高12.37%(P<0.05)。喷施单一寡糖各处理(ZH-A、ZH-B和ZH-C)与喷施多糖溶液处理(GY-D)无显著差异,生菜鲜重分别比对照(CK)提高16.52%、10.61%和13.85%(P<0.05)。而喷施复配寡糖处理(ZH-M),生菜鲜重显著增加,比CK提高52.58%(P<0.05),比喷施海藻酸钠溶液处理(GY-D)显著增加35.79%(P<0.05)。可见,生育期喷施单一种类的寡糖(纤维寡糖、低聚木糖和甲壳低聚糖)与喷施海藻酸钠多糖均可达到调节生长的正向效果,且增加幅度差异不显著,若将3种寡糖按等质量比(1:1:1)混合,促进效果则显著增加4.25倍。
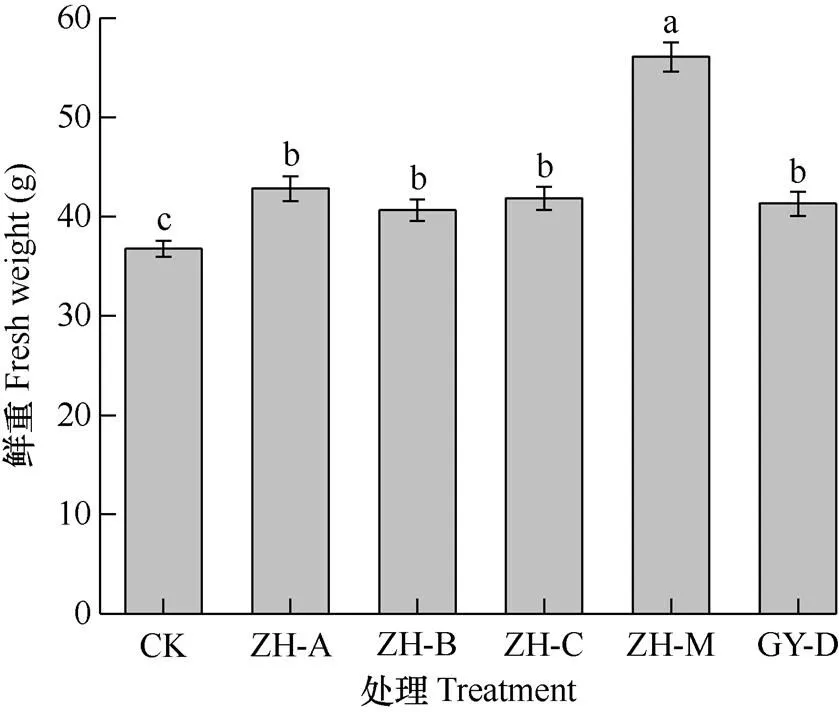
图1 浓度为80mg·L−1的不同寡糖溶液叶面喷施处理后采收期生菜单株鲜重的比较
注:生菜定植3d后进行4次(间隔2d)叶面喷施处理,其中,ZH-A为纤维寡糖溶液处理,ZH-B为低聚木糖溶液处理,ZH-C为甲壳低聚糖溶液处理,ZH-M为复配寡糖溶液处理,GY-D为海藻酸钠多糖处理,CK为喷清水对照。小写字母表示处理间在0.05水平上的差异显著性。短线表示均方差。下同。
Note:Three days after planting, freshly made solutions of oligosaccharides were applied to the lettuce plant by spraying four times every three days. ZH-A is cello-oligosaccharide solution; ZH-B is xylooligosaccharide solution; ZH-C is chitosan oligosaccharide solution; ZH-M is compound oligosaccharides solution; GY-D is sodium alginates (polysaccharide) solution; CK is water. Lowercase indicates the difference significance among treatments at 0.05 level. And the short line means mean square error. The same as below.
2.1.2 单株叶面积和干物质量
采收期,各处理单株叶面积和干物质量如图2所示。由图2a可知,喷施清水处理(CK)生菜叶面积最小,除ZH-B处理之外,其它寡糖溶液喷施处理生菜叶面积均显著增加。其中,海藻酸钠多糖(GY-D)叶面喷施4次后,采收期单株生菜叶面积比CK显著增加16.66%(P<0.05)。喷施单一纤维寡糖(ZH-A)、甲壳低聚糖(ZH-C)处理,与(GY-D)溶液处理的效果一致,三者差异不显著,ZH-A和ZH-C处理与CK相比,生菜叶面积分别显著增加21.04%、20.59%(P<0.05)。但喷施单一寡糖(ZH-B)处理与CK差异不显著。而复配寡糖(ZH-M)喷施后,生鲜叶面积明显增加,比CK提高了57.60%(P<0.05),比喷施海藻酸钠(GY-D)溶液处理增加了35.09%(P<0.05)。图2c中,采收期生菜冠层图像也印证了上述结果。经过4次寡糖叶面喷施,生菜冠层伸展度更大,功能叶片更多,复合寡糖(ZH-M)溶液处理尤为显著。
各处理下,生菜干物质量的变化如图2b所示,清水处理(CK)下,生菜地上部、地下部干物质量以及干物质总量最小。其它寡糖处理生菜干物质量也有不同程度的增加。海藻酸钠多糖(GY-D)处理下,单株生菜地上部、地下部干物质量与CK相比无显著差异。单一喷施低聚木糖处理(ZH-B)结果与海藻酸钠处理(GY-D)相似,亦不具显著差异。单一喷施纤维寡糖(ZH-A)溶液处理与CK相比,采收期地上部干重显著增加18.12%(P<0.05),但地下部无显著差异。单一喷施甲壳低聚糖处理(ZH-C)生菜地上部和地下部干重分别显著增加14.93%、32.76%(P<0.05)。同样,单一寡糖处理与多糖(GY-D)处理无显著差异。而复配寡糖(ZH-M)处理,生菜地上部、地下部比CK分别显著增加46.10%、46.58%(P<0.05),比多糖处理(GY-D)分别显著增加35.24%、29.08%(P<0.05)。
综上,叶面喷施复配寡糖(ZH-M)对采收期生菜地上部及地下部生物量的增加效果最佳,显著优于海藻酸钠多糖(GY-D)和单一寡糖处理。另外,单一喷施纤维寡糖(ZH-A)处理对生菜地上部的增加量优于地下部,而单一喷施甲壳低聚糖(ZH-C)正好相反。这与不同寡糖对作物生长的调控机制不同有直接关系,为充分发挥不同类型寡糖的优势,复配寡糖可能是未来的应用发展趋势。
2.1.3 单株根系表型特征
采收期各处理单株生菜根系表型分布特征如表1所示。由表可见,清水处理(CK)下,生菜总根长、总根表面积以及根总体积最小。经过寡糖处理的生菜根系总长度和总表面积均显著提高,多糖(GY-D)溶液叶面喷施4次后,采收期根总长度、总表面积以及总根体积比CK高51.34%(P<0.05)。单一喷施纤维寡糖(ZH-A)、低聚木糖(ZH-B)和甲壳低聚糖(ZH-C)溶液各处理,与喷施多糖溶液处理(GY-D)效果一致,生菜总根长分别比CK提高78.93%、48.30%、67.51%(P<0.05),根总表面积分别提升57.55%、29.77%、45.97%,根总体积分别提高38.39%、11.01%、26.32%(P<0.05)。而复配寡糖喷施处理(ZH-M)促根明显,根总长、根总表面积和根总体积分别比CK提高89.10%、68.49%和49.23%,比喷施多糖溶液处理(GY-D)显著增加24.95%、24.96%、25.19%(P<0.05)。可见,单一寡糖促根效果与多糖(GY-D)无显著差别,而复配寡糖促进根系生长的效果更为显著。

表1 各处理生菜根系表型特征的比较(平均值±均方差)
2.1.4 叶片叶绿素荧光参数
定植23d后,取各处理单株生菜第6、7功能叶片观测叶绿素荧光,结果见图3。由图3b可见,喷施清水处理(CK)生菜叶绿素荧光最大量子产额Fv/Fm值最低,海藻酸钠多糖溶液处理(GY-D)下,采收期叶绿素荧光量子产额Fv/Fm值与CK无显著差异。另外,单一喷施纤维寡糖(ZH-A)和低聚木糖(ZH-B)处理与喷施多糖溶液处理(GY-D)无显著差异。但喷施单一甲壳低聚糖(ZH-C)能明显提高生菜叶片叶绿素荧光量子产额Fv/Fm值,比CK提高0.76%(P<0.05,差异显著),其与喷施多糖处理(GY-D)相比也具显著性差异。而喷施复配寡糖(ZH-M),生菜叶片Fv/Fm值显著增加,比CK提高了0.75%,但与单一喷施甲壳低聚糖(ZH-C)结果无差别。可见,与CK相比,单一寡糖处理除甲壳低聚糖(ZH-C)外,其余处理对生菜Fv/Fm值无显著作用。与单一寡糖相比,复配寡糖(ZH-M)对生菜叶片PSⅡ的最大光化学效率具有与甲壳低聚糖(ZH-C)相同效果。
图3a叶绿素荧光成像图像也印证了上述结果。采收期,CK处理和多糖(GY-D)处理下生菜叶片中部有较大范围的异质性斑块,边缘也有较多大小不一的橘红色斑点,整体叶片颜色呈橘红色(低值)。而生育期叶面喷施寡糖处理的生菜叶片,叶脉中部暗黑色异质性斑块较小,叶片整体荧光图像颜色偏高光(高值),尤其甲壳低聚糖(ZH-C)和复配寡糖(ZH-M)处理。说明寡糖(纤维寡糖、低聚木糖、甲壳低聚糖以及复配寡糖)生育期叶面喷施处理,生菜叶片能够保持高水平的光化学效率,光合能力更强。
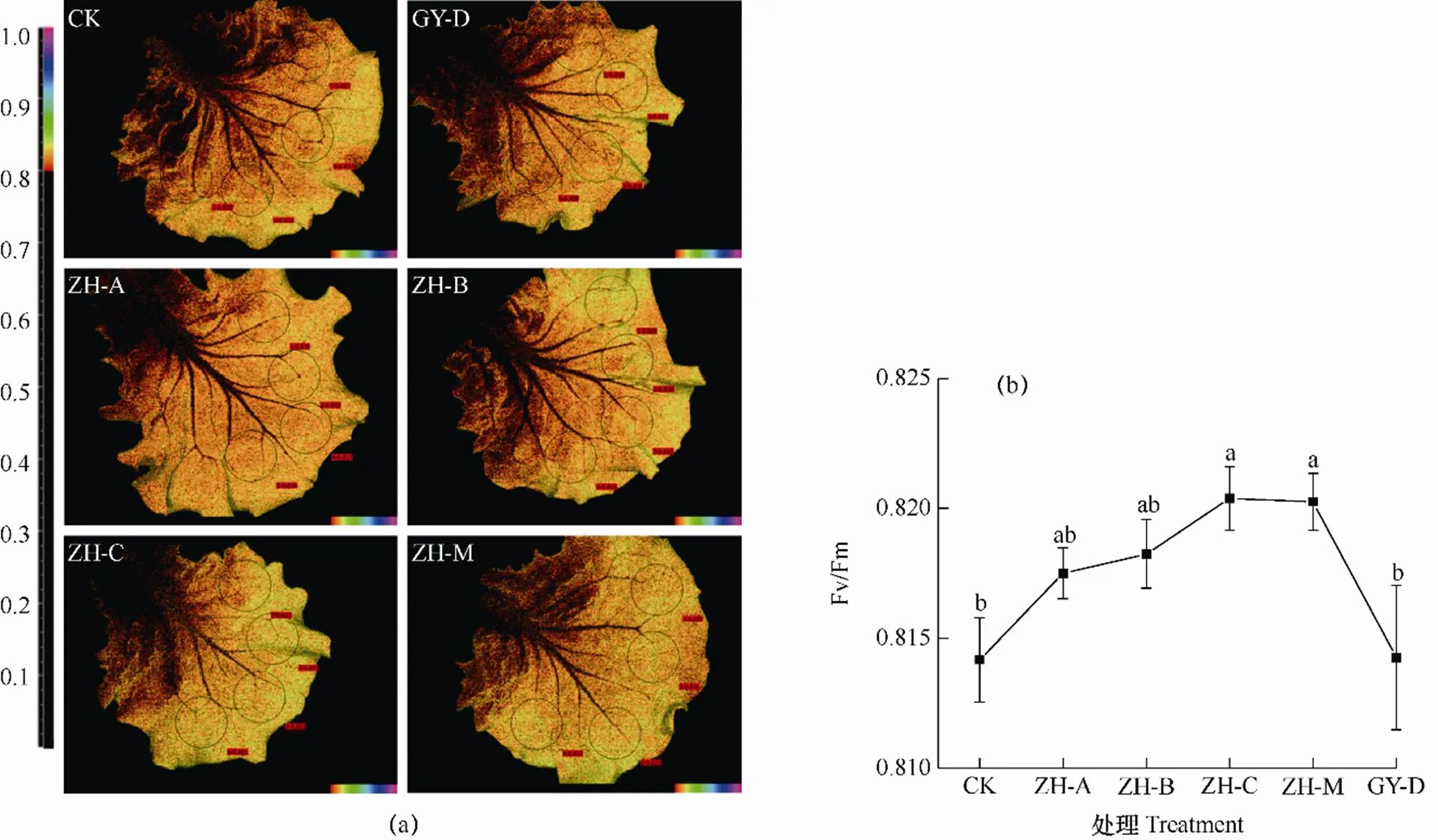
图3 采收期各处理生菜叶片叶绿素荧光最大光化学效率Fv/Fm荧光成像图(a)和观测值(b)的比较
注:图3a为不同处理下生菜叶片(Fv/Fm>0.8)的荧光成像图像,图像颜色越接近深绿色表示Fv/Fm值越大,相反,越接近橘红色,则数值越小。
Note: Figure 3a is the fluorescence image of(Fv/Fm>0.8)lettuce leaves under different treatment. In the image, the color is closer to green, the larger the Fv/Fm value is. On the contrary, the color is closer to jacinth, the smaller the Fv/Fm value is.
2.2 叶面喷施寡糖对生菜品质的影响
2.2.1 叶绿素含量
采收期,各处理单株生菜叶绿素含量如表2所示。由表可见,叶面喷施清水处理(CK)生菜叶片叶绿素含量较低。除多糖处理(GY-D)外,其余寡糖处理下的生菜叶片,其叶绿素含量均有不同程度的提升,尤其甲壳低聚糖(ZH-C)处理,叶绿素a、叶绿素b以及总色素含量均呈显著提升,尤以总色素提升幅度最大,达到21.96%(P<0.05)。单一喷施纤维寡糖(ZH-A)、低聚木糖(ZH-B)溶液处理,与喷施海藻酸钠溶液处理(GY-D)效果一致,与CK无显著差异。而喷施复配寡糖溶液处理(ZH-M),生菜叶片总色素明显提高,比CK提高21.50%(P<0.05),比喷施海藻酸钠溶液处理(GY-D)增加23.73%(P<0.05)。但ZH-M处理对生菜叶片叶绿素含量增加效果不及单一寡糖处理(ZH-C)。
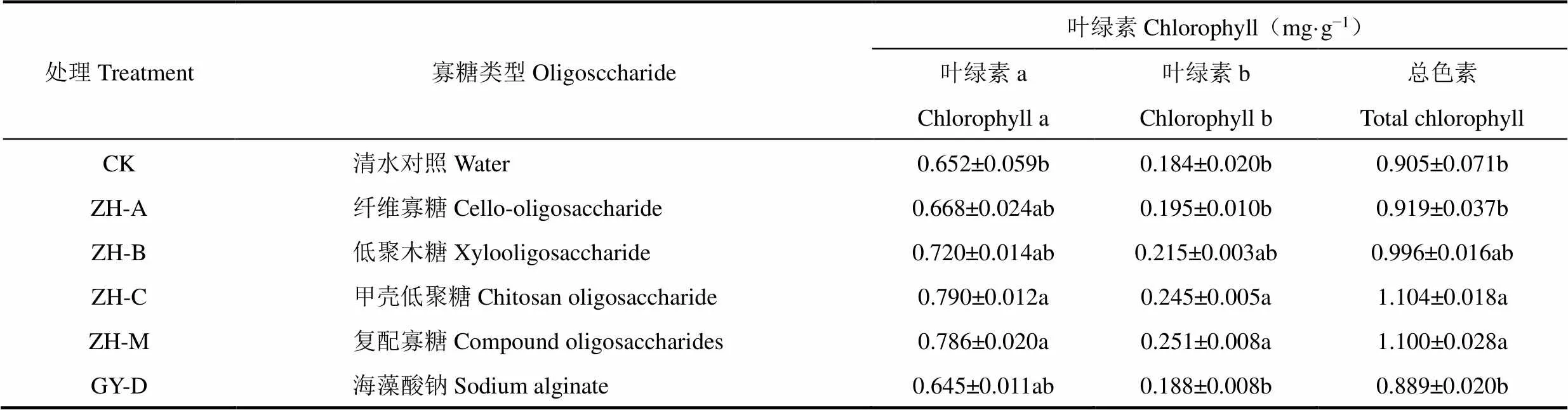
表2 各处理生菜叶绿素含量的比较(平均值±均方差)
2.2.2 可溶性糖含量
可溶性糖含量是评价生菜品质的重要指标,采收期不同处理生菜叶片可溶性总糖含量如表3所示。由表可见,喷施清水处理(CK)生菜叶片可溶性总糖含量最低,其它寡糖处理可溶性总糖含量均有一定程度的提高。海藻酸钠处理(GY-D)生菜叶片可溶性糖含量比CK高21.94%(P<0.05)。单一喷施低聚木糖(ZH-B)和甲壳低聚糖(ZH-C)与海藻酸钠处理(GY-D)效果无显著差异,叶片可溶性糖含量分别比CK提高22.56%、29.70%(P<0.05)。但喷施单一寡糖(ZH-A)与CK无显著差异。而喷施复配寡糖溶液处理(ZH-M),生菜叶片可溶性糖含量增加,比CK提高25.20%(P<0.05),但其与单一寡糖(ZH-C)处理差异不显著。由此可知,喷施单一寡糖均能一定程度提高生菜叶片可溶性总糖含量,而复配寡糖在提升可溶性总糖含量上具有单一寡糖(ZH-C)相同的功效。
2.2.3 硝酸盐含量
采收期不同处理生菜叶片硝酸盐含量如表3所示。由表可见,清水处理(CK)生菜叶片硝酸盐含量最高,其它处理下生菜叶片硝酸盐含量呈现大幅下降趋势。其中,海藻酸钠(GY-D)溶液4次喷施后,生菜叶片硝酸盐含量比CK下降19.45%(P<0.05)。单一喷施纤维寡糖(ZH-A)、低聚木糖(ZH-B)和甲壳低聚糖(ZH-C)溶液与海藻酸钠(GY-D)处理效果一致,与CK相比,生菜叶片硝酸盐含量分别下降23.46%、14.60%和15.74%(P<0.05)。而喷施复配寡糖处理(ZH-M),生菜体内硝酸盐含量明显降低,比CK下降27.65%(P<0.05),比GY-D处理下降10.19%(P<0.05)。可见,生育期喷施单一种类寡糖,与喷施海藻酸钠多糖均可降低生菜体内硝酸盐含量,而喷施复配寡糖处理硝酸盐含量则大幅降低,降幅达42.16%。
2.2.4 Vc含量
采收期,不同处理生菜叶片Vc含量如表3所示。由表可见,不同单一寡糖处理与清水处理(CK)效果一致。而复配寡糖处理(ZH-M)能明显增加叶片Vc含量,比CK提高12.08%(P<0.05),比喷施多糖(GY-D)增加9.82%。可见,单一喷施ZH寡糖(纤维寡糖、低聚木糖、甲壳低聚糖)处理与海藻酸钠多糖均对生菜叶片Vc含量无明显作用,但将3种寡糖按质量比1:1:1混合,则能够显著提高生菜叶片内Vc水平。

表3 各处理生菜品质的比较(平均值±均方差)
3 结论与讨论
3.1 讨论
本研究使用80mg·L−1浓度的单一寡糖(纤维寡糖、低聚木糖、甲壳低聚糖)和按等质量比均匀混合而成的复配寡糖(ZH-M)以及海藻酸钠多糖(GY-D)对生菜进行叶面喷施处理(喷施4次,间隔2d)。结果发现,与清水对照(CK)相比,喷施单一寡糖对生菜生长与多糖(GY-D)处理无显著差异,都能有效提高水培生菜地上部生长速率,增加生物量;对地下部根系生物量和根系表型特征均有不同程度的促进作用。这与Mondal等使用壳聚糖对菠菜、秋葵和番茄等作物的研究结果具有一致性[16−17]。El-Miniawy也在其研究中指出,一定浓度的寡糖喷施,能够增加地上部生物量、叶片数,同时能够提高叶面积指数、根鲜重以及干物质量[18]。本研究也再次印证了这一点。单一寡糖溶液喷施后,采收期(定植后23d)生菜地上部鲜重、叶面积增加10%~20%,地下部干重增加20%~30%,地下部根体积增加10%~40%,总根长增加50%~80%。另外,生菜叶片叶绿素荧光Fv/Fm也有一定程度的提升。而叶绿素荧光最大光化学效率的提高可能与寡糖处理下生菜叶片叶绿素含量的增加有关[19−20]。叶绿素最大光化学效率与植株体内叶绿素含量可能某种程度上具有一定的关联性[21],叶绿素含量的增加可促使叶片光合速率和体内代谢水平提高,促进植物对养分的吸收,加速淀粉以及糖的合成和转运[22−23]。本研究表明,多糖(GY-D)处理相对于其它寡糖处理,最大光化学效率Fv/Fm值最低,生菜体内叶绿素含量也最少。当然,也可能与生菜叶片伸展度有关,本试验中,ZH寡糖处理后,生菜叶面积更大,伸展度更高。相同条件下,较高伸展度的叶片能够吸收利用更多的光量子并通过光系统反应中心将光能转化为化学能,为作物生长提供更多能量,从而加速生菜生育期的生长。
可溶性糖、蛋白含量、Vc及氨基酸等是蔬菜的主要品质指标,其含量越高,蔬菜的营养价值也越高[24]。本研究发现,叶片单一寡糖喷施与多糖(GY-D)的功效相似,均可不同程度提升生菜品质。与喷清水对照(CK)比较,除纤维寡糖外,其它单一寡糖处理下,生菜叶绿素含量提高10%~20%,可溶性糖含量提高10%~30%。而可溶性糖作为呼吸作用的基质,为植物的各种合成过程和生命活动提供能量。体内高可溶性糖水平除了维持代谢能力,促进生长发育,还与植株抗逆能力具有相关性,常作为评价植物抗逆能力的指标[25−26];各处理Vc含量也有一定程度的提升,Vc在抗氧化、清除自由基、光合作用和光保护、细胞生长和分裂、参与次生代谢合成乙烯方面具有着重要作用,这可能是生菜快速生长的原因之一[27]。另外,本试验也对叶片硝酸盐含量进行了测定,发现单一寡糖处理下,生菜叶片硝酸盐含量大幅下降,降幅在10%~20%。它的降低可能与氨基酸的合成有关,其影响机制以及在植物体内的代谢过程有待更深入研究。作为水培类蔬菜品质评价的重要指标,硝酸盐含量的降低对蔬菜品质有着重要意义。
通过单一寡糖(纤维寡糖、低聚木糖及甲壳低聚糖)对生菜生长及品质改善的应用实际效果对比,本实验也发现不同寡糖对作物生长发育会产生不同的作用效果,以往研究也有发现,甚至同种寡糖使用浓度的不同对作物生长会起相反作用[28−29]。以壳聚糖为例,不同分子量,不同脱乙酰度、不同浓度及不同使用方式,对作物生长有着巨大差异[30−32]。本研究中,ZH-A处理对生菜地上部鲜重、叶面积、地下部的根系表型特征以及降低硝酸盐含量水平表现出极显著的作用效果。而ZH-C处理对生菜体内叶绿素含量、叶绿素最大光化学效率Fv/Fm以及可溶性糖含量水平等效果更优。因此,针对不同作物或环境条件进行优化选择是未来对寡糖材料的研究和产品开发的一个重要方向。
另外,本研究首次将几种单一寡糖(纤维寡糖、低聚木糖以及甲壳低聚糖)等质量比均匀混合而成的复配寡糖(ZH-M)的应用效果作了对比研究,结果发现,ZH-M处理相较于3类单一寡糖处理,其对生菜促生长提品质的综合效果更优。其中,生菜地上部生物量及叶面积均达显著增加水平。地下部根重、根长、根体积等也明显增加;同时,复配寡糖在提高Vc以及降低硝酸盐水平上具有更显著效果,但可溶性糖以及叶绿素含量水平上却不及甲壳低聚糖(ZH-C)。由此可以看出,相比单一寡糖,复配寡糖对作物不同部位或某一生理性状所起到的作用效果具有明显的增强或降低。本试验所使用复配比例,对生菜收获量、收获时间及生菜品质的作用明显优于任何单一种类寡糖。但对诸如叶绿素、可溶性糖等生理活性物质含量水平不及ZH-C。综合来看,复配寡糖的效果更优。尤其对人工光源水培蔬菜生产,其倍增的促生长效果,能够缩短生菜的生长周期,提早上市,从而节约光电水肥的投入,降低生产成本,提高资源利用效率;同时能够通过提高蔬菜品质,提升农产品竞争力,具有实际生产价值。
目前,对寡糖的研究仍侧重于应用实效和寡糖类型的甄选,本研究也仅对部分寡糖的应用效果作了初步探索,对其它材料及其作用机理以及针对不同作物及作物不同生长阶段、不同环境所需,如何进行不同寡糖类型配比还需进一步研究。同时,对单一和复配之后的寡糖是如何影响一些重要的生理过程诸如种子萌发、幼苗发育、根叶分化、胁迫环境的机制机理是下一阶段的研究重点。
3.2 结论
80mg·L−1的单一寡糖(纤维寡糖、低聚木糖、甲壳低聚糖)与海藻酸钠多糖叶面喷施均能显著增加生菜生物量、根系长度和总表面积,提高叶片叶绿素含量、可溶性糖含量和Vc含量,降低生菜体内硝酸盐含量;但是,低聚木糖和甲壳低聚糖处理的最大光化学效率Fv/Fm显著高于海藻酸钠多糖处理。
不同寡糖对生菜生长及品质的调节作用存在一定差异。其中,纤维寡糖对促进根系生长及降低硝酸盐含量有显著效果;甲壳低聚糖对提高叶绿素含量、叶绿素最大光化学效率Fv/Fm和可溶性糖含量具有显著作用;复配寡糖能够发挥多种寡糖的综合功效,对生菜具有更好的促生长、提品质的效果,是未来寡糖产品开发的重要方向。
[1] 束放,熊延坤,韩梅.2015年我国农药生产与使用概况[J].农药科学与管理,2016,37(7):1-6.
Shu F,Xiong Y K,Han M.The survey of pesticide production and use in China in 2015[J].Pesticide Science and Management, 2016,37(7):1-6.(in Chinese)
[2] Kurita K.Chitin and chitosan:functional biopolymers from marine crustaceans[J].Marine Biotechnology, 2006,8(3):203- 226.
[3] Ziani K,Ursúa B,MatéJ I.Application of bioactive coatings based on chitosan for artichoke seed protection[J].Crop Protection,2010,29(8):853-859.
[4] Rabêlo V M,Magalhães P C,Bressanin L A,et al.The foliar application of a mixture of semisynthetic chitosan derivatives induces tolerance to water deficit in maize,improving the antioxidant system and increasing photosynthesis and grain yield[J]. Scientific Reports,2019,9(1):8164.
[5] Walker S M,Hadwiger L,Ryan C A.Chitosans and pectic polysaccharides both induce the accumulation of the antifungal phytoalexinpisatin in pea pods and antinutrient proteinase inhibitors in tomato leaves [J].Biochemical and Biophysical Research Communications,1983,110(1):194-199.
[6] Salachna P,Zawadzińska A.Effect of chitosan on plant growth,flowering and corms yield of potted freesia[J].Journal of Ecological Engineering,2014, 15(3):97-102.
[7] 黄丽萍,刘宗明.甲壳质、壳聚糖在农业上的应用[J].吉林农业科学,1998,(4):60-64.
Huang L P,Liu Z M.Application of chitin and chitosan in agriculture[J].Jilin Agricultural Science, 1998,(4):60-64.(in Chinese)
[8] Lin Y,Wang H,Gohar F,et al.Preparation and copper ions adsorption properties of thiosemicarbazide chitosan from squid pens[J].International Journal of Biological Macromolecules, 2017,95:476-483.
[9] 陈火君,李舒,蔡爱华,等.低聚木糖作为调理剂对土壤微生物和酶的影响[J].环境工程学报,2012, 6(8): 2870-2874.
Chen H J,Li S,Cai A H,et al.Effects of xylooligosaccharides used as a soil conditioner on soil microorganism and enzyme[J].Chinese Journal of Environmental Engineering, 2012,6(8):2870-2874. (in Chinese)
[10] 张秀秀,伍辉军,周宇骋,等.低聚木糖对大豆生长和花叶病毒病抗性的影响[J].大豆科学,2012,31(4):621-624.
Zhang X X,Wu H J,Zhou Y C,et al.Effect of xylo- oligosaccharide on growth and resistance to SMV in soybean[J].Soybean Science,2012,31(4):621-624.(in Chinese)
[11] 余劲聪.海藻寡糖在农业领域的应用研究进展[J].南方农业学报,2016,47(6):921-927.
Yu J C.Research progress in application of seaweed oligosaccharides in agriculture[J].Journal of Southern Agriculture,2016,47(6):921-927.(in Chinese)
[12] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].中国轻工业出版社,2007.
Cao J K,Jiang W B,Zhao Y M.Physiological and biochemical experiments of fruits and vegetables after harvest[M].Chinese Light Industry Press,2007.(in Chinese)
[13] 张宪政.植物叶绿素含量测定:丙酮乙醇混合液法[J].辽宁农业科学,1986,(3):28-30.
Zhang X Z.Determination of chlorophyll content in plants: acetone ethanol mixture method[J].Liaoning Agricultural Science,1986,(3):28-30.(in Chinese)
[14] 曹晓倩,孙涛,帕尔哈提,等.不同处理条件对叶菜类蔬菜亚硝酸盐含量的影响[J].中国食物与营养,2018,24(2):33-36.
Cao X Q,Sun T,Paerhati,et al.Effects of different treatment conditions on nitrite content of leafy vegetables[J].Food and Nutrition in China,2018,24(2):33-36.(in Chinese)
[15] 萧浪涛,王三根.植物生理学实验技术[M].中国农业出版社,2005.
Xiao L T,Wang S G.Experimental techniques of plant physiology[M].Chinese Agriculture Press,2005.(in Chinese)
[16] Mondal M M A,Malek M A,Puteh A B,et al.Effect of foliar application of chitosan on growth and yield in okra[J].Australian Journal of Crop Science,2012,6(5): 918-921.
[17] Yin H,Fretté X C,Christensen L P,et al.Chitosan oligosaccharides promote the content of polyphenols in greek oregano(ssp.)[J].Journal of Agricultural and Food Chemistry,2012,60(1):136-143.
[18] El-Miniawy S M,Ragab M E,Youssef S M,et al.Response of strawberry plants to foliar spraying of chitosan[J].Research Journal of Agriculture and Biological Sciences,2013, 9(6):366-372.
[19] Khan W M,Prithiviraj B,Smith D L.Effect of foliar application of chitin and chitosan oligosaccharides on photosynthesis of maize and soybean[J].Photosynthetica, 2002,40(4):621-624.
[20] Thirumaran G,Arumugam M,Arumugam R,et alEffect of seaweed liquid fertilizer on growth and pigment concentration of[J].American- Eurasian Journal of Agronomy,2009,2(2):57-66.
[21] Limpanavech P,Chaiyasuta S,Vongpromek R,et al.Chitosan effects on floral production,gene expression,and anatomical changes in the[J].Scientia Horticulturae, 2008,116(1):65-72.
[22] Richardson A D,Aikens M,Berlyn G P,et al.Drought stress and paper birch() seedlings:effects of an organic biostimulant on plant health and stress tolerance,and detection of stress effects with instrument-based,noninvasive methods[J].Journal of Arboriculture,2004,30(1):52-61.
[23] 岑海燕,姚洁妮,翁海勇,等.叶绿素荧光技术在植物表型分析的研究进展[J].光谱学与光谱分析,2018,38(12): 3773-3779.
Cheng H Y,Yao J N,Weng H Y,et al.Applications of chlorophyll fluorescence in plant phenotyping:a review[J]. Spectroscopy and Spectral Analysis,2018,38(12):3773-3779. (in Chinese)
[24] 于俊红,彭智平,黄继川,等.三种氨基酸对菜心产量和品质的影响[J].植物营养与肥料学报,2014,(4):1044-1050.
Yu J H,Peng Z P,Huang J C,et al.Effect of three amino acids on yield and quality of Chinese cabbage[J].Journal of Plant Nurtrition and Fertilizers,2014,(4):1044-1050.(in Chinese)
[25] Pongprayoon W,Roytrakul S,Pichayangkura R,et al.The role of hydrogen peroxide in chitosan-induced resistance to osmotic stress in rice (L.)[J].Plant Growth Regulation,2013,70(2):159-173.
[26] 薛国希,高辉远,李鹏民,等.低温下壳聚糖处理对黄瓜幼苗生理生化特性的影响[J].植物生理与分子生物学学报,2004,30(4):441-448.
Xue G X,Gao H Y,Li P M,et al.Effect of chitosan treatment on physiological and biochemical characteristic in cucumber seedings under low temperature[J].Journal of Plant Physiology and Molecular Biology,2004,30(4):441-448.(in Chinese)
[27] Albersheim P,Valent B S.Host-pathogen interactions in plants:plants when exposed to oligosaccharides of fungal origin defend themselves by accumulating antibiotics [J].Journal of Cell Biology,1978,78(3):627-643.
[28] Van S N,Minh H D,Anh D N.Study on chitosan nanoparticles on biophysical characteristics and growth of Robusta coffee in green house[J].Biocatalysis and Agricultural Biotechnology,2013,2(4):289-294.
[29] Mondal M M A,Malek M A,Puteh A B,et al.Effect of foliar application of chitosan on growth and yield in Okra[J]. Australian Journal of Crop Science,2012,6(5): 918-921.
[30] Kananont N,Pichyangkura R,Chanprame S,et al.Chitosan specificity for the in vitro seed germination of two(Asparagales:Orchidaceae)[J].Scientia Horticulturae,2010,124(2):239-247.
[31] Limpanavech P,Chaiyasuta S,Vongpromek R,et al.Chitosan effects on floral production,gene expression,and anatomical changes in the[J].Scientia Horticulturae, 2008,116(1):65-72.
[32] Pornpienpakdee P,Singhasurasak R,Chaiyasap P,et al.Improving the micropropagation efficiency of hybridwith chitosan[J].Scientia Horticulturae, 2010,124(4):490-499.
Effect of Different Oligosaccharides by Spraying on Plant Growth and Quality in Lettuce
HE Jiu-xing1, ZHAO Jie-chun1, BAI Wen-bo1, ZHENG Li1, ZHANG Yuan-cheng2, YU Meng-meng2, Kimoto Hisashi3, Saito Makoto4, LV Guo-hua1
(1. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/Key Laboratory of Agricultural Environment, Ministry of Agriculture, Beijing 100081, China; 2. Shandong Bori Bioenergy Joint Stock Company Limited, Dongying 257067, China; 3. Fukui Prefectural University, Fukui 910-1195, Japan; 4. Showa Denko K.K., Tokyo 105-8518, Japan)
Experiments in climate chamber were performed to explore the levels of various components of single and mixed oligosaccharides on growth, yield and performance of lettuce. A short-growing type of lettuce (var.Hort) and three oligosaccharides, such as cello-oligosaccharides (ZH-A), xylo-oligosaccharides (ZH-B), and chitosan oligosaccharides (ZH-C) were selected. The mixed oligosaccharides (ZH-M) (Mass Ratio, ZH-A:ZH-B:ZH-C=1:1:1) and the conventional polysaccharide sodium alginates (GY-D) were prepared for the experiment. 80mg·L−1of each was applied 4 times (every 3 days) to lettuce by foliar spraying after three days of planting and the water (CK) was used as a control. Growth characteristics (biomass, leaf area and fluorescence photosynthetic), root phenotypic characteristics (root length, root surface area and root volume) and the quality characteristics (soluble sugar, chlorophyll, Vc, and nitrate contents) of lettuce were measured at the harvest stage (23 days after planting).The results showed that foliage spraying can significantly increase the biomass of lettuce in all single oligosaccharide treatments and the (GY-D) treatment. The cello-oligosaccharide showed the significant increase in root growth and decrease in nitrate content. The chitosan oligosaccharide showed the substantial increase in chlorophyll content, the maximum photosynthetic efficiency (Fv/Fm) and the soluble sugar content. The mixed oligosaccharides (ZH-M) showed the best effects on lettuce growth, such as the above and underground biomass and the quality characters. In the ZH-M treatment, the fresh weight and leaf area index increased by 52.58% and 57.60% at the harvest stage. And, root dry weight, total root lengths, root total volume and root surface area increased by 35.07%, 89.10%, 49.23% and 40.68%, respectively. The content of soluble sugar, chlorophyll, and Vc rose by 25.20%, 21.50% and 12.08% respectively, while the nitrate content dropped by 27.65%. In conclusion, significant differences in interaction and regulation regime were found among the different oligosaccharides on plant physiology and growth. Compared with the single oligosaccharide, the mixed oligosaccharides showed the multiplying influences on plant growth and quality improving.
Lettuce; Oligosaccharide; Mixed-oligosaccharides; Polysaccharide; Nitrate
10.3969/j.issn.1000-6362.2019.12.005
何久兴,赵解春,白文波,等.叶面喷施寡糖对生菜生长和品质的调节作用[J].中国农业气象,2020,41(12):783-792
2019−08−22
。E-mail:zhaojiechun@caas.cn;lvguohua@caas.cn
粮食丰产增效科技创新专项(2017YFD0300410-02)
何久兴(1994−),硕士生,从事农业新材料应用研究。E-mail:hikerjx@163.com

