Ag掺杂HgS量子点: 一种pH调谐的近红外Ⅱ区荧光纳米探针
王君诚, 杨菲菲, 高冠斌, 孙涛垒,
Ag掺杂HgS量子点: 一种pH调谐的近红外Ⅱ区荧光纳米探针
王君诚1, 杨菲菲2, 高冠斌1, 孙涛垒1,2
(武汉理工大学 1. 材料复合新技术国家重点实验室; 2. 化学化工与生命科学学院, 武汉 430070)
近红外荧光特别是近红外Ⅱ区(1000~1700 nm)荧光在生物体内具有高组织渗透率、高时空分辨率、低背景荧光干扰和低光损伤的特点, 因此发展水溶性与生物相容性良好、量子产率高的长波段近红外荧光探针意义重大。本研究制备了不同荧光发射的Ag掺杂HgS量子点(HgAgS量子点)。在不同pH溶液中制备的HgAgS量子点荧光发射峰位于近红外Ⅱ区, 且呈现规律性变化; 随pH的增大, HgAgS量子点荧光发射峰先红移而后蓝移, 发射波长在pH 6时达到最大1110 nm; 原子吸收光谱表明在不同pH溶液中制备的HgAgS量子点, Ag的掺杂量(Ag/Hg比值)呈现出与荧光发射峰相同的规律性变化, 证明通过pH调控Ag的掺杂量从而调谐荧光发射峰的位置。HgAgS量子点的量子产率随pH先增加后降低, 在pH 7时达到最大13.23%(em=1100 nm)。细胞毒性实验表明Ag的掺杂量对HgAgS量子点的细胞毒性无明显影响, 在1~50 μg/L浓度范围内均无明显细胞毒性。本研究结果不仅为体内进行近红外荧光成像提供了基础研究数据, 而且为荧光纳米探针的设计与制备提出了新的见解。
近红外Ⅱ区荧光; HgAgS量子点; pH调谐; 热注射法
荧光成像技术在生物体内具有高时空分辨率、非侵入性好、可视化、低光损伤等优点, 是目前最具发展前景的生物成像技术之一[1-3]。近红外荧光(发射峰700 nm以上)不仅可以最大限度地避开有机体的自发荧光(通常在可见光区)干扰[4-6], 而且具有更加优异的组织穿透能力(波长越长, 光的穿透能力越强)。然而, 由于生物体本身缺乏可产生近红外荧光的物质, 必须借助外来荧光探针材料才能进行荧光成像。因此, 发展生物相容性良好, 荧光量子产率更高的近红外荧光探针材料成为荧光成像领域的研究热点和难点[7-8]。
当前, 近红外荧光探针材料主要有有机染料分子和无机纳米粒子两大类。与有机染料分子相比, 无机纳米粒子探针具有荧光发射峰可调、高量子产率、荧光寿命长、高抗光漂白稳定性等特点, 因而其在分子示踪和荧光成像领域备受重视[9-11]。如, 利用HgS/ZnS核壳结构量子点对小鼠体内肿瘤细胞进行成像, 荧光穿透深度达到2 cm, 且HgS/ZnS量子点荧光与自体荧光具有较高分辨度[12]; 采用PbS/CdS量子点在1600 nm的近红外Ⅱ区对肿瘤小鼠进行原位实时动态荧光成像[13]等。这些高水平的研究成果引领量子点材料成为近红外荧光成像很有前景的造影剂。然而, 目前仅有上述几种量子点材料被报道可用于近红外荧光成像, 且其制备均需高温油相, 过程复杂且能耗较高[14-15]。尚未见采用水相法在常温下快速制备高量子产率的长波段(近红外II区及以上)且生物相容性良好的近红外荧光纳米探针的报道。
本研究采用卡托普利作为配体, 在水溶液中通过热注射法快速制备出粒径约为5 nm的HgAgS量子点。通过调控制备过程中溶液的pH, 该量子点的荧光发射峰位置和荧光量子产率均呈现规律性变化, 即, 可通过pH调控Ag的掺杂量从而调谐荧光发射峰的位置。细胞实验结果表明, Ag的掺杂量对HgAgS量子点的细胞毒性无明显影响, 在1~50 μg/L范围内均无明显细胞毒性。上述结果表明这种水溶性良好、荧光光谱可调且细胞相容性良好的HgAgS量子点有望成为一种新型近红外Ⅱ区荧光探针。
1 实验方法
1.1 HgAgS量子点的制备方法
在室温下, 0.10 mmol HgCl2和0.20 mmol卡托普利分别溶解在10 mL超纯水中, 然后加入至圆底烧瓶中混合搅拌30 min, 磁力搅拌速率为1200 r/min。1 mol/L NaOH溶液缓慢滴入混合溶液, 将溶液的pH调至10.0, 反应30 min。最后缓慢加入1 mL Na2S水溶液(0.05 mmol Na2S·9H2O溶于1 mL超纯水), 反应60 min后结束, 得到HgS量子点。而后将溶液升温至50 ℃, 将5 mL醋酸银水溶液(0.05 mmol无水醋酸银溶于5 mL超纯水)缓慢滴入HgS量子点水溶液中。最后调节溶液pH至3.0~11.0, 反应15 min, 得到在不同pH溶液中制备的HgAgS量子点。使用30 K超滤管超滤(转速为8000 r/min, 时间为10 min), 超纯水洗涤4次, 得到纯净的HgAgS量子点浓缩液, 冷冻干燥得到HgAgS量子点粉末。
1.2 材料测试与表征
HgAgS量子点的晶体结构通过X射线衍射仪(XRD, 布鲁克D8 ADVANCE)测定, 铜靶Kα辐射(0.154178 nm)。HgAgS量子点的形貌通过高分辨扫描透射电子显微镜(STEM, JEM-2100F)表征, 并用其附带的EDS表征量子点的组分与结构, 测试时加速电压为200 kV。HgAgS量子点的水合粒径由动态光散射(DLS, 马尔文Nano-ZS ZEN3600 Zeta Sizer)测得。HgAgS量子点的化学组成通过傅里叶变换红外光谱仪(FT-IR,布鲁克VERTEX 80 v)和X射线光电子能谱仪(XPS, ESCALAB 250Xi)分析得到。HgAgS量子点的荧光通过紫外–可见–近红外荧光分光光度计(PL, Horiba Jobin Yvon Nanolog)测试。HgAgS量子点中Ag/Hg比值通过原子吸收光谱仪(AAS, Analytikjena AG CONTRAA-800)测定。材料及试剂, 荧光量子产率计算和细胞毒性测试详细步骤见支持信息的实验部分。
2 结果与讨论
2.1 HgAgS量子点的组成和形貌表征
HgAgS量子点的晶体结构通过XRD确定。如图1(a)所示, HgAgS量子点在30.6°、31.0°、46.3°和56.2°处有明显的衍射峰, 对应于(012)、(10¯2)、(13¯2)和(10¯4)晶面, 与标准图谱JCPDS, No.39-0328一致。高分辨TEM照片(图1(b)和图S1)显示HgAgS量子点为粒径分布均匀的球形且有明显的孪晶晶格[16]。从不同区域的TEM照片中任意选择的500个量子点统计其粒径分布, 结果为(4.6±1.0) nm (图1(d))。DLS结果显示HgAgS量子点的水合粒径约为5.0 nm (图S2), 与对TEM照片信息的统计结果相符。
图2(a)是扫描透射电子显微镜(STEM)中HgAgS量子点的高角环形暗场(HAADF)照片。图2(b)是对应于图2(a)的EDS能谱图, 证明HgAgS量子点是一种纳米复合材料。图2(d)显示出三种元素Hg、Ag、S均存在于HgAgS量子点中。由图2(c~f)所示, 三种元素均匀分布于HgAgS量子点中。XPS分析结果(图S3)中, 通过对比HgS和HgAgS两种量子点[17-18]的XPS全谱图, 可见HgAgS量子点中有明显的Ag 3d特征峰, 进一步证明了Ag成功掺杂于HgS量子点。

图1 HgAgS量子点的X射线衍射图谱(a), 透射电子显微镜照片(b), 高分辨透射电镜照片(c)和粒径统计分布图(d)
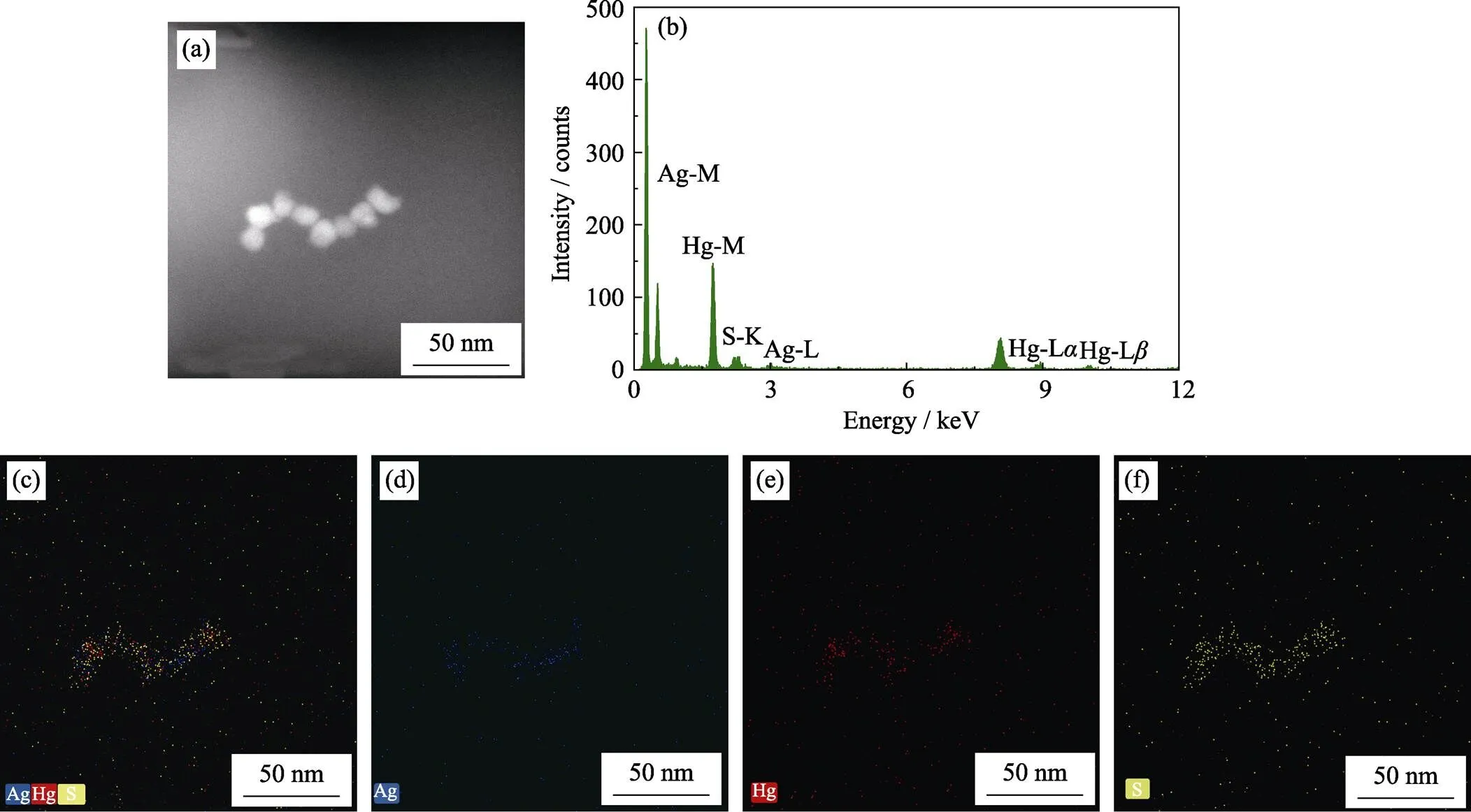
图2 HgAgS量子点的扫描透射电子显微镜高角环形暗场照片(HAADF) (a)和能谱图(b), 及其Ag(蓝色)、Hg(红色)和S(黄色)三种元素混合(c)和对应的单一元素Ag(d)、Hg(e)和S(f)分布图
HgAgS量子点的FT-IR光谱图(图3)显示, 卡托普利包覆的HgAgS量子点与纯卡托普利对比, 在2530 cm–1处的巯基(–SH)伸缩振动峰完全消失, 说明卡托普利成功修饰到HgAgS量子点的表面[19]。HgAgS量子点在1600 cm–1处羰基(C=O)伸缩振动峰消失, 并且指纹区的信号强度减弱甚至消失。这是由于形成的HgAgS量子点对修饰在其表面的卡托普利造成扰动, 进一步证明本研究成功制备出了卡托普利包覆量子点的特征谱。HgAgS量子点中的Hg 4f和S 2p的电子结合能均变大, 说明Ag掺杂进入了HgS量子点[20]。
2.2 荧光光谱及量子产率
PL测试结果显示在pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0八种不同溶液下制备的HgAgS量子点的荧光发射峰分别位于1078、1081、1110、1100、1000、998、994和993 nm(图4(a)), 量子荧光发射峰的位置先随着溶液酸性减弱而缓慢红移至1110 nm(pH=6), 而后随着溶液碱性的增加而蓝移, 表明pH可调谐HgAgS量子点的荧光发射峰位置。AAS测试结果显示, 在上述八种pH溶液下制备的HgAgS量子点的Ag/Hg比值分别为0.637、0.951、1.124、1.069、1.024、0.992、0.679和0.542(图4(b)), Ag/Hg比值随着酸性减弱先缓慢增加至1.124 (pH=6), 而后随着碱性增加而减少, 这一规律与pH调谐HgAgS量子点的荧光发射峰位置的规律一致。上述结果表明溶液pH可调控Ag在HgAgS量子点中的掺杂量, 从而进一步调谐其近红外荧光发射峰的位置。另一方面, pH 7条件下制备的HgAgS量子点的荧光发射达到近红外Ⅱ区, 表明其有潜力作为近红外荧光探针用于荧光成像[21]。
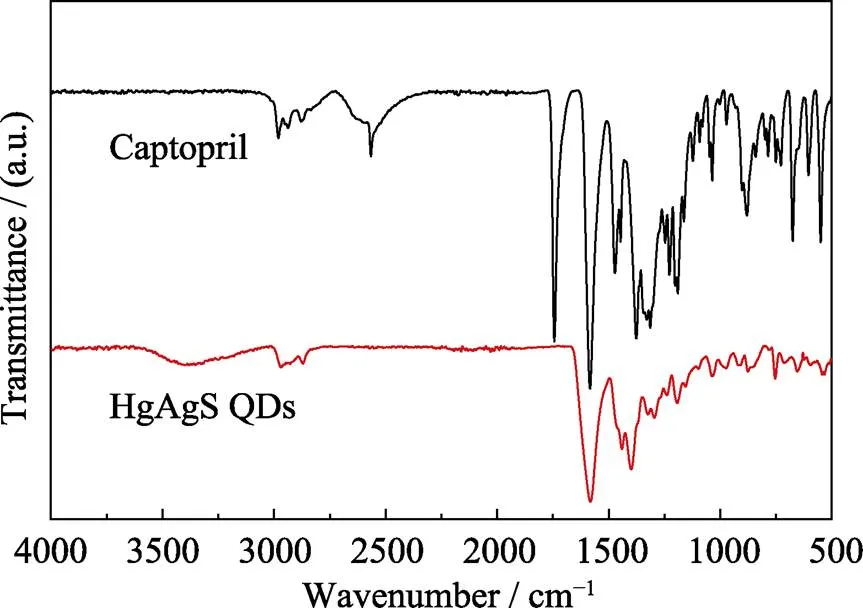
图3 卡托普利和HgAgS量子点的傅里叶红外变换光谱
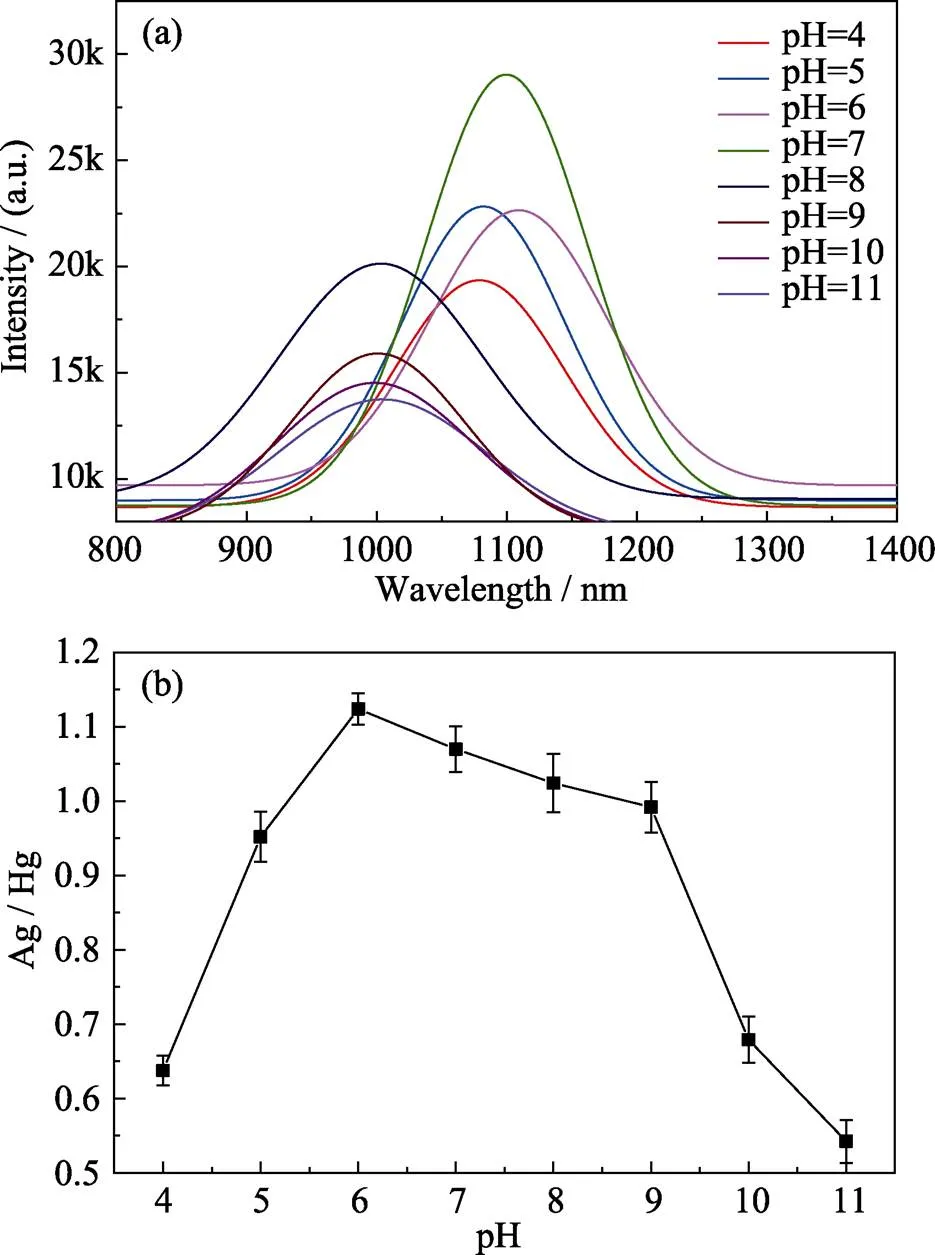
图4 激发波长为400 nm时在不同pH下制备的HgAgS量子点的荧光光谱(a)及其Ag/Hg值变化(彩图见网页)
HgAgS量子点的荧光量子产率如图S4所示, 随着pH的增大, 该量子点的荧光量子产率先增大后减小, 在pH=7时达到最大13.32%(em=1100 nm), 以上结果表明HgAgS量子点具有较高量子产率, 能够在近红外荧光成像时产生较强的信号。
2.3 HgAgS量子点的细胞毒性
本研究采用CCK-8比色法, 以传至第六代(对数期)的大鼠胰岛细胞瘤细胞(INS-1)检测HgAgS量子点的细胞活性[22]。如图5(a)所示, HgAgS量子点浓度在1~50 μg/L内, 细胞24 h的存活率在89%以上; 48 h后在76%以上。同时, 以鼠嗜铬细胞瘤细胞(PC12细胞)、检测不同Ag掺杂量的HgAgS量子点的细胞活性(图5(b)), 结果显示在0~50 μg/L范围内均无明显细胞毒性。上述结果表明Ag在此浓度范围内的掺杂量对HgAgS量子点无明显细胞毒性。
3 结论
本研究采用卡托普利作为稳定剂, 通过热注射法制备出具有近红外Ⅱ区荧光的HgAgS量子点。Ag成功掺杂入HgS量子点进而形成HgAgS量子点复合结构, 卡托普利修饰在HgAgS量子点表面。原子吸收光谱和荧光光谱表明溶液pH调控Ag的掺杂量从而调谐荧光发射峰的位置, 且HgAgS量子点荧光发射峰位置达到近红外Ⅱ区。在pH 7时荧光发射峰位于1100 nm, 荧光量子产率达到最大13.32%。Ag的掺杂在1~50 μg/L范围内对HgAgS量子点的细胞活性无明显影响, 均无明显细胞毒性。本研究为pH调谐近红外荧光探针的设计与制备提供了参考, 并为后续掺杂量子点用于的近红外荧光成像打下了一定的基础。
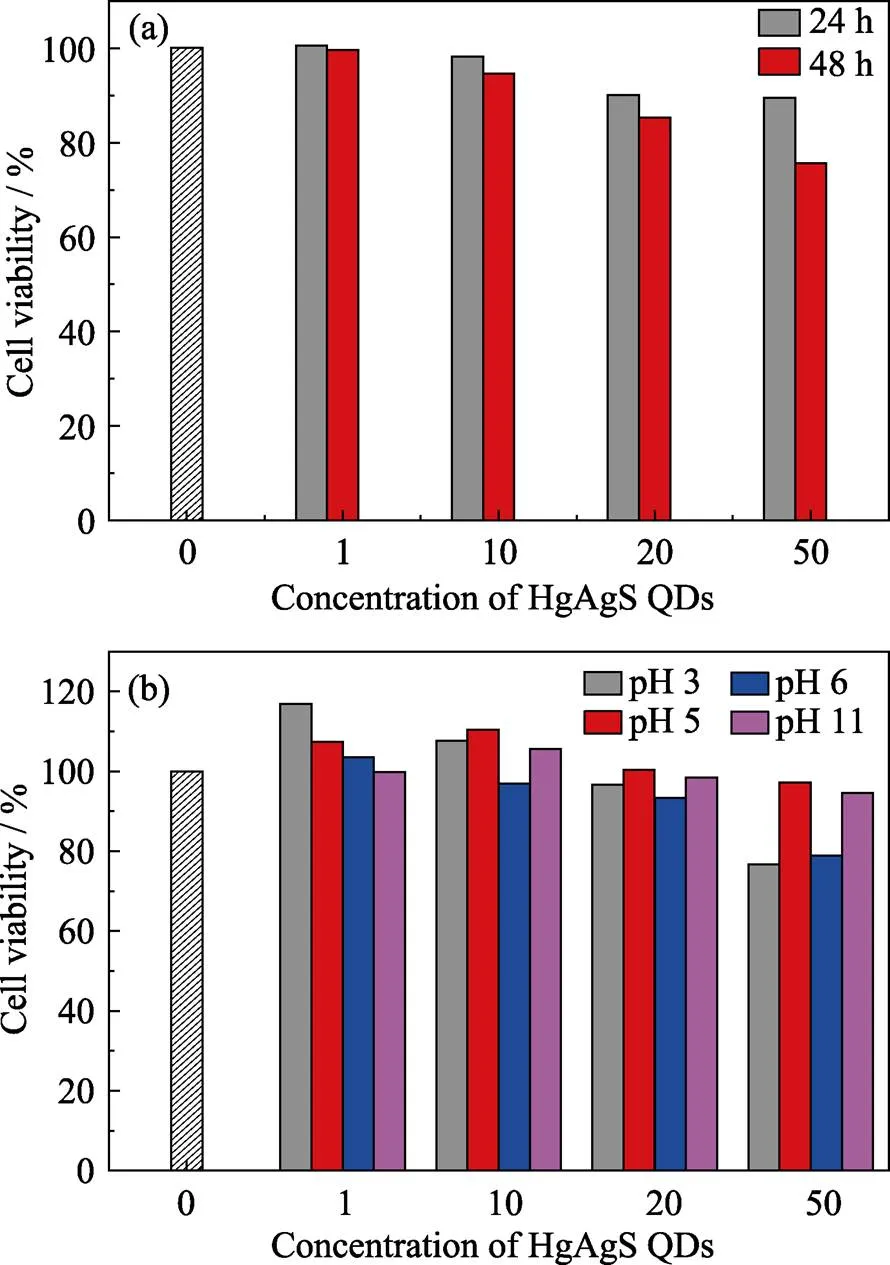
图5 HgAgS量子点(pH=6.0制备)在不同时间下对INS-1细胞的细胞活性影响(a)和不同pH条件下制备的HgAgS量子点对PC12细胞的活性影响(b)
补充材料:
本文补充材料见https://doi.org/10.15541/ jim20190031.
[1] LIU SHI-YU, XIONG HAO, LI RONG-RONG,. Activity- based near-infrared fluorogenic probe enablesandprofiling of neutrophil elastase., 2019, 91(6): 3877–3884.
[2] NING JING, LIU TAO, DONG PEI-PEI,. Molecular design strategy to construct the near-infrared fluorescent probe for selectively sensing human cytochrome P450 2J2., 2019, 141(2): 1126–1134.
[3] LIU TZU-MING, CONDE JOAO, LIPINSKI TOMASZ,. Revisiting the classification of NIR-absorbing/emitting nanomaterials forbioapplications., 2016, 8: 25.
[4] BHATTARAI DEVAL-PRASAD, TIWARI ARJUN-PRASAD, MAHARJAN BIKENDRA,. Sacrificial template-based synthetic approach of polypyrrole hollow fibers for photothermal therapy., 2019, 534: 447–458.
[5] TIAN YE, RAN RAN, JIAO YUN-FENG,. Redox stimuli- responsive hollow mesoporous silica nanocarriers for targeted drug delivery in cancer therapy., 2016, 1(6): 480–487.
[6] LIU YANG, SONG NAN, LI ZHEN-SHENG,. Near-infrared nanoparticles based on aza-BDP for photodynamic and photothermal therapy., 2019, 160: 71–78.
[7] WANG XUAN, LI ZHONG-LIANG, NAN NAN,. A simple system of swept source optical coherence tomography for a large imaging depth range., 2019, 431: 51–57.
[8] HANKIEWICZ J H, STOLL J A, STROUD J,. Nano-sized ferrite particles for magnetic resonance imaging thermometry., 2019, 469: 550–557.
[9] LAN XIANG, WANG QIANG-BIN. Optically active AuNR@Ag core-shell nanoparticles and hierarchical assemblyDNA-mediated surface chemistry., 2016, 8(50): 34598–34602.
[10] KONG YI-FEI, CHEN JUN, FANG HONG-WEI,. Highly fluorescent ribonuclease-A-encapsulated lead sulfide quantum dots for ultrasensitive fluorescenceimaging in the second near- infrared window., 2016, 28(9): 3041–3050.
[11] LIN SHU, FENG YU, WEN XIAO-MING,. Theoretical and experimental investigation of the electronic structure and quantum confinement of wet-chemistry synthesized Ag2S nanocrystals., 2014, 119(1): 867–872.
[12] YANG JING, HU YAO-PING, TAN JIANG-WEI,. Ultra- bright near-infrared-emitting HgS/ZnS core/shell nanocrystals forandimaging., 2015, 3(34): 6928–6938.
[13] ZHANG MING-XI, YUE JING-YING, CUI RAN,. Bright quantum dots emitting at similar to 1,600 nm in the NIR-IIb window for deep tissue fluorescence imaging., 2018, 115(26): 6590–6595.
[14] XIONG HU, ZHOU KE-JIN, YAN YUN-FENG,. Tumor- activated water-soluble photosensitizers for near-infrared photodynamic cancer therapy., 2018, 10(19): 16335–16343.
[15] YANG ZHEN, TIAN RUI, WU JIN-JUN,. Impact of semiconducting perylene diimide nanoparticle size on lymph node mapping and cancer imaging., 2017, 11(4): 4247–4255.
[16] BRAUN MARKUS, BURDA CLEMENS, EI-SAYED MOSTAFA-A. Variation of the thickness and number of wells in the CdS/ HgS/CdS quantum dot quantum well system., 2001, 105(22): 5548–5551.
[17] ZHANG WEN-HAO, YANG JING, YU JUN-SHENG. Synthesis of stable near-infrared emitting HgTe/CdS core/shell nanocrystals using dihydrolipoic acid as stabilizer., 2012, 22(13): 6383–6388.
[18] SUN TING-TING, DOU JIN-HU, LIU SHI,. Second near-infrared conjugated polymer nanoparticles for photoacoustic imaging and photothermal therapy., 2018, 10(9): 7919–7926.
[19] QIN HAI-YAN, NIU YUAN, MENG REN-YANG,. Single- dot spectroscopy of zinc-blende CdSe/CdS core/shell nano-crystals: nonblinking and correlation with ensemble measurements., 2014, 136(1): 179–187.
[20] GAO GUAN-BIN, ZHANG MING-XI, GONG DE-JUN,. The size-effect of gold nanoparticles and nanoclusters in the inhibition of amyloid-beta fibrillation., 2017, 9(12): 4107–4113.
[21] SHEN GUO-HUA, GUYOT-SIONNEST PHILIPPE. HgS and HgS/CdS colloidal quantum dots with infrared intraband transitions and emergence of a surface plasmon., 2016, 120(21): 11744–11753.
[22] YANG FEI-FEI, GAO GUAN-BIN, WANG JUN-CHENG,. Chiral-HgS quantum dots: aqueous synthesis, optical properties and cytocompatibility., 2019, 537: 422–430.
Ag doped HgS Quantum Dots: a pH-tunable Near-infrared-Ⅱ Fluorescent Nanoprobe
WANG Jun-Cheng1, YANG Fei-Fei2, GAO Guan-Bin1, SUN Tao-Lei1,2
(1. State Key Laboratory of Advanced Technology for Materials Synthesis and Processing, Wuhan University of Technology, Wuhan 430070, China; 2. School of Chemistry, Chemical Engineering and Life Science, Wuhan University of Technology, Wuhan 430070, China)
Design and preparation of near-infrared (NIR) especially NIR-Ⅱ (1000–1700 nm) fluorescence probe with favorable biocompatibility and high quantum yield have become the focus of noninvasive fluorescent imaging in recent years. In this study, Ag doped HgS QDs (HgAgS QDs) were prepared at different synthetic pH. With the increase of pH, the fluorescence emission peak of the HgAgS QDs red-shifted and then blue-shifted, reaching a maximum emission wavelength of 1110 nm (QY=8.12%) at pH 6.0. Atomic absorption spectroscopy showed that the doping amount of Ag (Ag/Hg ratio) changed regularly in HgAgS QDs prepared at different pH solutions, which was consistent with change of fluorescence emission position. It was proved that pH could tune the position of fluorescence emission peak by adjusting the doping amount of Ag. Moreover, the quantum yield (QY) of HgAgS QDs increased firstly and then decreased, presenting an optimum of 13.23% (em=1100 nm) at pH 7.0. Cell viability tests demonstrated that the doping amount of Ag showedno significant effect on cytotoxicity. And all HgAgS QDs had no cytotoxicity at the concentration range of 1–50 μg/L, thus can be used as a pH-tunable NIR-Ⅱ fluorescent probe. These findings provide a promising application in the NIR fluorescent imaging and an interesting insight into the design and preparation of the NIR-Ⅱ fluorescence nanoprobe.
NIR-Ⅱ fluorescence; HgAgS quantum dots; pH-tunable; hot injection
TQ174
A
1000-324X(2019)11-1156-05
10.15541/jim20190031
2019-01-16;
2019-04-18
国家自然科学基金(21805218, 51873168, 51533007, 21975191); 湖北省自然科学基金(2018CFA002, 2018CFB348)National Natural Science Foundation of China (21805218, 51873168, 51533007, 21975191); Natural Science Foundation of Hubei Province (2018CFA002, 2018CFB348)
王君诚(1993–), 男, 硕士研究生. E-mail: wangjuncheng@whut.edu.cn
高冠斌, 副研究员. E-mail: gbgao@whut.edu.cn; 孙涛垒, 教授. E-mail: suntl@whut.edu.cn

