常温偏酸条件下耐铜酵母的筛选及驯化
张杏艳 杨楷 黄明光 吴柱月 卢文学 何仁春 蓝海恩 陈中华
摘 要:为提高动物对铜元素的吸收效率,减少粪便铜含量,降低污染及增加生物发酵料的铜营养价值,寻找能够应用于常温偏酸条件下进行生物发酵的富铜酵母菌。本试验从啤酒酵母(Saccharomyces cerevisiae Hansen)、产朊假丝酵母(Candid autilis)、面包酵母(Saccharomyces cerevisiae)三类酵母菌中选取6株菌株进行耐铜酵母的筛选,并将筛选出的耐铜酵母,模拟南方生物发酵的温度及pH值,以逐步提高培养基初始铜浓度的方式进行驯化。结果表明,啤酒酵母的耐铜性能最佳,其最佳的铜起始驯化浓度为100 mg·L-1,经过反复驯化,其最终获得的耐铜浓度为600 mg·L-1,经筛选耐铜啤酒酵母最适生长的铜浓度为 200 mg·L-1,在温度为28~30 ℃,pH值 (6.2±0.2)条件下获得的耐铜酵母风干菌体铜含量为14.97 g·kg-1。啤酒酵母经过驯化,在常温及偏酸的条件下,能够获得高的耐铜特性。
关键词:常温;偏酸;铜;耐铜;酵母;筛选;驯化
中图分类号:S963.32+7 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.11.012
Abstract: In order to improve the copper efficiency, reduce the copper content of excrement, decrease the pollution, increase the copper nutritional value of biological fermented feed, and get the copper-tolerant yeast which can use in fermented under room temperature and subacid condition, we picked six yeasts and screened the high efficient copper one from Saccharomyces cerevisiae Hansen, Candid autilis, Saccharomyces cerevisiae. Simulating the south fermented temperature and pH of biological fermented feed, and the high efficient copper yeast by increasing gradually the copper content of medium was domesticated. Result showed that Saccharomyces cerevisiae Hansen was screened as the highest efficient copper-tolerant yeast and the initiative domesticating copper concentration was 100 mg·L-1. After domesticating repeatedly by increasing gradually the copper content, 600 mg·L-1 was selected as the maximum copper tolerant concentration and the best tolerant culturing copper concentration was 200 mg·L-1. The copper content of dried Saccharomyces cerevisiae Hansen was 14.97 g·kg-1 under 28~30 ℃, pH (6.2±0.2). Saccharomyces cerevisiae Hansen can get high copper tolerant capacity by domesticating under normal temperature, neutral leaning acid condition.
Key words: room temperature; subacid ; copper; copper-tolerant; yeasts; screening; domestication
銅元素是动物生长必需的微量元素。铜是酶的必要组分和激活剂,是维持动物生命活动和生长发育的重要营养物质,在保证动物体健康生长和高效生产方面铜元素起着非常重要的作用。铜元素通常以无机盐的形式添加到饲料中,其中硫酸铜是使用最广泛的铜源添加剂[1]。在实际生产过程中,动物肠胃对进入动物体内的无机矿质元素吸收力比较低,为满足动物需求,无机铜往往添加过量,导致大量无机铜随粪便排出体外,粪便铜含量高,影响粪便的资源化应用,大量铜元素随粪便进入环境,造成环境污染[2]。70年代末,美国首次研制出了稳定性和动物营养有效性显著优于无机盐的螯合型氨基酸矿物质盐,随后,我国也成功研制出了这类氨基酸螯合微量元素,并用于规模化生产。蛋白质铜、氨基酸螯合铜等有机态铜是其中的产品之一, 但由于蛋白质铜、氨基酸螯合铜等有机形态的矿物质元素生产成本比较高,在实际生产中难以广泛使用[3]。微生物可通过富集积累和生物作用,将无机态的矿质元素转化成便于动物吸收的形态,且成本比较低,是目前获得有机铜的优良形式。作为富集微量元素载体的微生物一般要求为对人及动物无害的有益微生物,菌体本身除对微量元素有较强富集作用之外,其本身最好还富含有蛋白质、维生素等对动物有益的活性物质,在提供微量元素来源的同时还能够促进动物的营养吸收,增强动物的生长。酵母菌富含蛋白质、糖类、维生素和有益的活性物质,是能够直接添加到饲料中用于生产的菌种,且对铜具有一定的耐受能力,研究表明,酵母铜的生物利用率显著高于硫酸铜和乙酸铜[4],是富集铜的优良菌种。酵母铜可在为动物提供有机铜的同时,促进动物的生长,此外,酵母铜能更好的与其他饲料添加剂协同配合,避免饲料营养成分的流失,且酵母铜天然具有的芳香气味对动物胃肠无刺激作用,更有利于动物的生长[3]。
随着畜牧业的不断发展,对饲料的要求也越来越高。新型饲料不仅要营养价值高还要成本低,环境污染小。生物发酵料是目前畜牧业能同时满足高营养价值和低成本要求的重要研究方向之一。研究表明,将棉籽、豆粕、全价料、玉米秸秆、象草、果皮等经过微生物发酵后可用于畜禽养殖,在提高营养利用率的同时,降低营养成本[5-10]。酵母菌是生物发酵的常用菌,以往添加的是普通酵母菌,若添加富铜酵母菌,在满足生物发酵要求的同时还能提供有机铜,将会大大提高生物发酵料的营养价值和饲用价值。在实际生产中,南方生物发酵料的发酵及使用的条件通常为常温、偏酸,这种条件下的生物发酵料成本最低,使用范围最广。这就要求酵母菌在常温、偏酸的条件下仍具有富铜特性,但是目前适用的富铜酵母菌种较少,因此,本文主要探究常温、偏酸条件下,酵母对铜的富集能力,寻找此条件下对铜具有高富集能力的酵母菌株,并通过驯化获得富铜能力较高的菌株,为富铜生物发酵料的研发提供更多的选择性。
1 材料和方法
1.1 材料与仪器
1.1.1 菌种 经文献筛选之后,选定啤酒酵母,产朊假丝酵母,面包酵母3类酵母菌种为本次耐铜酵母菌株筛选和驯化的菌种。并根据南方生物发酵料的发酵常温,偏酸的条件及菌种的耐铜特性在菌种保藏数据库中进行粗筛,最后选定6株菌株为本次筛选和驯化的菌株,分别是啤酒酵母(Saccharomyces cerevisiae Hansen,编号为:336058,336027),产朊假丝酵母(Candid autilis (Henneberg) Lodderet Kreger-vanRij,编号为:336674,188871),面包酵母(Saccharomy ces cerevisiae,编号为:336499,340638)。菌株由北京北纳创联生物技术研究院提供。
1.1.2 培养基 固体培养基为:酵母提取物3 g·L-1,麦芽糖提取物3 g·L-1,葡萄糖10 g·L-1,蛋白胨5 g·L-1,琼脂20 g·L-1,蒸馏水,pH值为(6.2±0.2)。
液体培养基为:酵母提取物3 g·L-1,麦芽糖提取物3 g·L-1,葡萄糖10 g·L-1,蛋白胨5 g·L-1,蒸馏水,pH值为(6.2±0.2)。
1.1.3 试剂 酵母提取物,麦芽糖提取物,葡萄糖,蛋白胨,琼脂,酒石酸,氢氧化钠,硫酸铜。所有试剂均为分析纯。
1.1.4 仪器 SMART生物显微镜(重庆奥特光学仪器有限公司),培英THZ-C恒温震荡器(苏州培英实验设备有限公司),LD-5电动离心机(金坛市科析仪器有限公司),立式灭菌锅D2S2-LC100(山东新华医疗器械股份有限公司),电热恒温鼓风干燥箱(上海跃进医疗器械有限公司),血球计数板(上海市求精生化试剂仪器有限公司),电感耦合等离子体发射光谱。
1.2 试验方法
1.2.1 酵母菌种的筛选 将啤酒酵母、产朊假丝酵母、面包酵母菌种各2种菌种在无菌条件下,用接种环接种于琼脂斜面培养基上,于28~30 ℃的温室中培养24 h,如此反复两代,复苏菌种。从斜面刮取己活化的酵母菌种,接种于50 mL,pH值为(6.2±0.2)的液体种子培养基,置于28 ℃恒温摇床,150 r·min-1震荡培养24 h。根据菌种在液体培养基的生长状况进行初筛,根据菌种的生长数量从中分别选3株生长良好的菌株进行铜适应性试验。将灭菌的硫酸铜溶液添加到50 mL液体培养基中,配置成铜含量分别为0,50,100,200 mg·L-1的液体培养基,将1 mL酵母菌种子接种到液体培养基中,培养48 h,以血球计数板统计各铜浓度液体培养基中酵母菌的数量。根据单位体积内的酵母菌个数和起始培养基中铜浓度作图,筛选出对铜适应能力较好的酵母菌和较好的铜起始驯化浓度。
1.2.2 酵母菌种的驯化 利用微生物能逐渐适应不利生长环境因素的能力,采用逐步提高培养基的中铜添加量的方式进行驯化。首先将初步筛选出来的耐铜酵母菌接种于筛选出的较好的铜起始驯化浓度的液体培养基中,本试验筛选出的较好的铜起始驯化浓度为100 mg·L-1,置于28~32 ℃恒溫摇床,150 r·min-1震荡培养24 h,然后从该培养物种取1 mL培养液接种到不含铜的培养基中培养24 h,如此反复培养几代,使酵母菌在此含铜量的培养基中生长稳定。当菌体数量不再增多时,以每次提高50 mg·L-1起始铜浓度进行反复几代的培养。用显微镜观察酵母菌的形态并以干重法测量酵母菌的生长量。本试验将起始铜浓度逐级提高到150,200,250,300,350,400,450,500,550,600 mg·L-1进行反复培养,最终使该酵母菌够适应含铜量为600 mg·L-1的培养基环境,获得耐铜特性。
1.2.3 耐铜酵母菌最适铜浓度的筛选 将培养24 h的耐铜酵母菌菌种1 mL接种到50 mL硫酸铜添加量分别为100,200,300,400 mg·L-1的培养基中,接种后立即取2 mL培养基保存于4 ℃下备用,再置于28~30 ℃恒温摇床,150 r·min-1震荡培养,培养72 h后取出,再将培养液在4 000 r·min-1离心5 min,收集2 mL上清液保存于4 ℃备用,离心得到的菌体用双蒸水冲洗,再离心,如此反复3次,在65 ℃将菌体干燥,备用。检测起始培养基铜浓度,上清液铜浓度,酵母菌粉含铜量。用电感耦合等离子体发射光谱测铜的含量。耐铜酵母对铜的吸附量 = 起始培养基铜浓度 - 上清液铜浓度。根据检测结果,确定耐铜酵母的最适生长铜浓度。
1.2.4 富铜酵母制备 将驯化后的耐铜酵母菌株在上述实验筛选出的最佳富集铜浓度下,在温度为28~30 ℃,pH值为(6.2±0.2)的液体培养基中培养。
2 结果与分析
2.1 3种酵母菌种对起始铜适应能力的比较
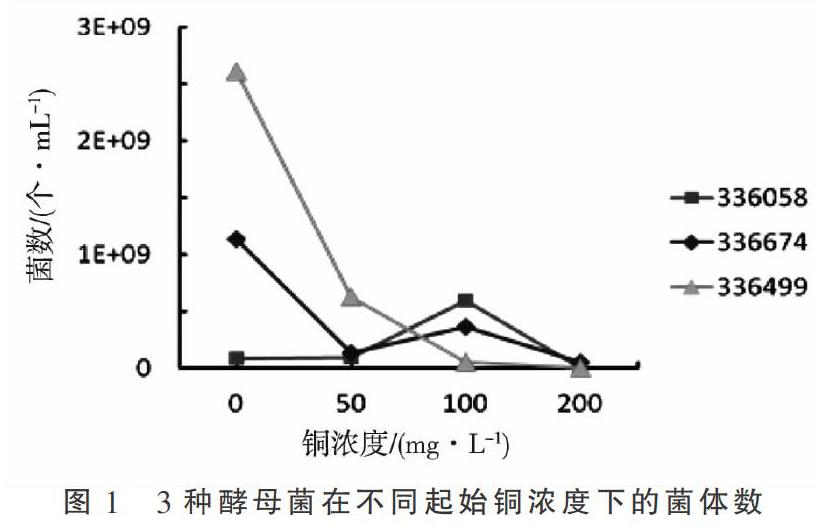
将血球计数板的计数结果及培养液铜浓度作图,由图1可知,啤酒酵母336058的菌体数量随培养液铜浓度的升高先升高后下降,在铜浓度为100 mg·L-1的培养液中菌体数量为5.9×108个,达到最高值,对较高浓度的铜的耐受性较高。产朊假丝酵母336674的菌体数量随培养液铜浓度的升高波动增长,在0~50 mg·L-1较低铜浓度下,产朊假丝酵母菌的菌体数量隨培养液铜浓度的升高而下降,在50~100 mg·L-1较高铜浓度下,产朊假丝酵母菌的菌体数量随培养液铜浓度的升高而上升,在铜浓度为100 mg·L-1的培养液中菌体数量达到较高值3.7×108个,在100~200 mg·L-1高铜浓度下,产朊假丝酵母菌的菌体数量随培养液铜浓度的升高而下降。面包酵母菌336499的菌数随培养液铜浓度的升高而剧烈下降。3种菌种在200 mg·L-1铜浓度下几乎不生长,啤酒酵母336058在铜浓度为100 mg·L-1的培养中菌体数量高于产朊假丝酵母336674。因此,选定啤酒酵母336058为对铜适应能力较好的菌株,100 mg·L-1为最佳的铜起始驯化浓度。
2.2 耐铜酵母菌的耐铜特性
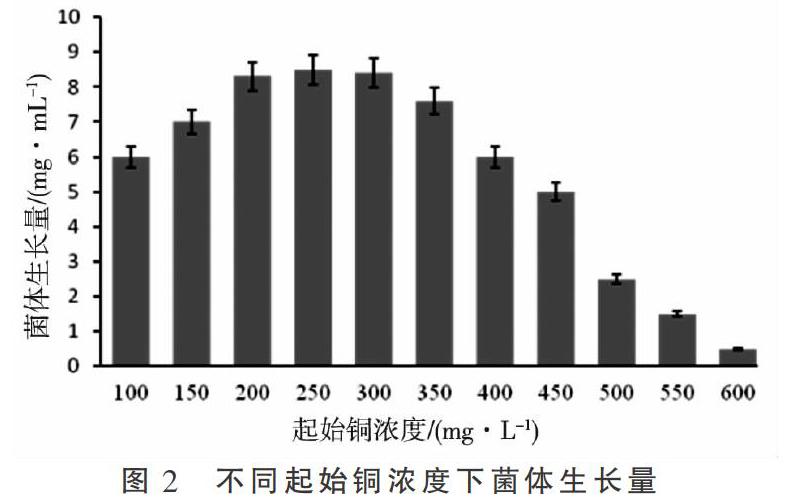
通过不断提高铜浓度的反复驯化的方法,将耐铜性较好的啤酒酵母菌,以100 mg·L-1为起始铜浓度,以每次提高50 mg·L-1起始铜浓度进行驯化。由图2可知,啤酒酵母菌在铜浓度提高到150~300 mg·L-1之间时,菌体数量稳步增长,菌体生长量较多,当铜浓度大于350 mg·L-1时菌体生长数量逐渐下降,当铜浓度提高到600 mg·L-1时,菌体数量明显减少,因此不再提高铜浓度进行驯化。最终本试验啤酒酵母336058获得的耐铜浓度为600 mg·L-1。啤酒酵母菌未经驯化前,不能适应200 mg·L-1的铜浓度,经过驯化之后能够适应600 mg·L-1的铜浓度,获得耐铜特性。
2.3 耐铜酵母的最适生长铜浓度
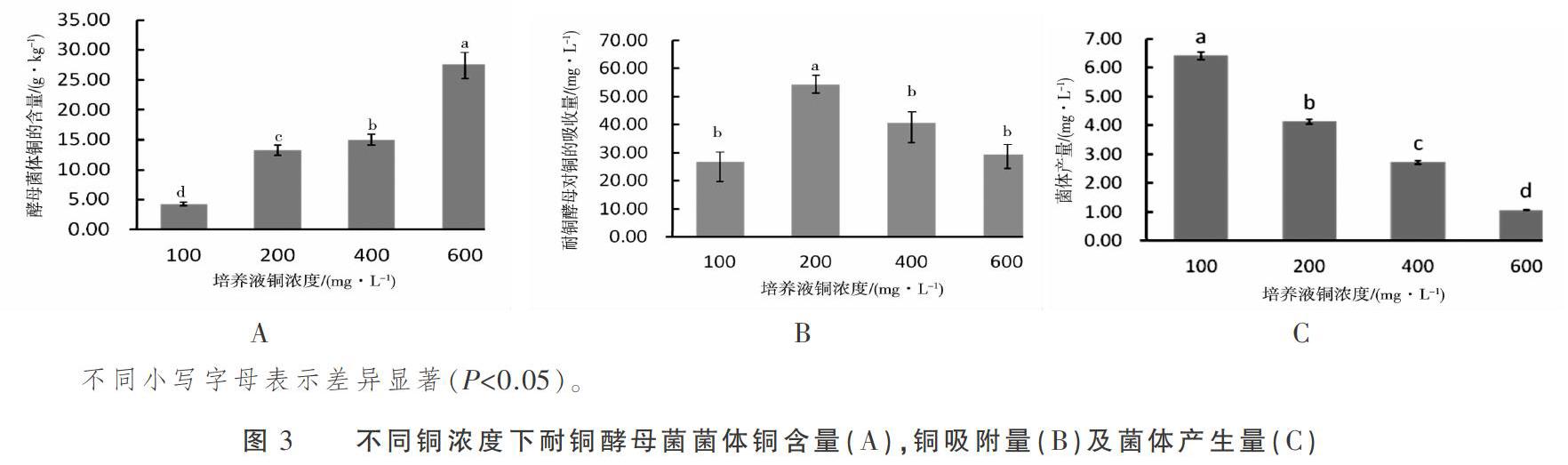
由图3A可知,耐铜酵母菌啤酒酵母336058风干菌体铜含量随培养液铜浓度的升高而升高,对不同铜浓度下风干菌体铜含量进行方差分析表明,100 mg·L-1铜处理组与200,400,600 mg·L-1铜处理组相比,风干菌体铜含量差异极显著(P<0.01),200 mg·L-1铜处理组与400 mg·L-1铜处理组相比,风干菌体铜含量差异显著(P<0.05)。由图3B可知,耐铜酵母菌啤酒酵母对铜的吸附量随培养液铜浓度的增加先升高后下降,耐铜酵母菌啤酒酵母在铜浓度为200 mg·L-1的培养基中对铜的富集能力最强,且与其他铜浓度处理组相比达到显著差异(P<0.05)。由图3C可知,耐铜酵母菌啤酒酵母菌体产生量随培养液铜浓度的升高而下降,各铜处理组之间菌体产量差异显著(P< 0.05)。综合分析耐铜酵母啤酒酵母对铜的富集能力,对铜吸附能力及菌体产生量,其最适生长的铜浓度为 200 mg·L-1。
2.4 富铜酵母产品的铜含量
将耐铜酵母菌啤酒酵母336058接种于铜浓度为200 mg·L-1,pH值(6.2±0.2)的培养液中,置于温度为28~30 ℃的培养箱中,150 r·min-1震荡培养72 h,将培养液在4 000 r·min-1离心5 min,离心得到的菌体用双蒸水冲洗,再离心,如此反复3次,在65 ℃将菌体干燥,根据电感耦合等离子体发射光谱的检测结果,获得富铜酵母菌体铜含量为14.97 g·kg-1。
3 讨 论
3.1 酵母菌对铜耐受性驯化机制
目前,利用微生物的生物作用来富集微量元素是国内外研究的重点。自然界中,许多微生物对铜具有耐受性,能够从外环境中富集铜[11]。但是由于铜离子对真菌等微生物有很强的杀伤力,限制了真菌等微生物对高浓度铜离子的富集能力。仅以表1呈现的部分研究结果可见,不同细菌在不同条件下对铜的耐受能力差别很大。化学物质对微生物的抑制作用与化学物质的浓度关系密切,且随微生物的驯化而发生变化,经过驯化后,微生物对高浓度化学物质的适应能力逐步增强[12],利用微生物这一巨大变异潜力,可以采用人为改变微生物生活环境的方法进行诱导变异,使微生物获得对化学物质较高的耐受性。铜是胞内多种酶代谢的激活剂,Cu2+浓度低时,可促进酿酒酵母代谢反应,但浓度进一步升高,会抑制酵母的生长活性,对酵母造成胁迫作用,严重影响酵母在发酵过程中的作用。因此,抗铜酵母的筛选和驯化是非常必要的。未经驯化的酵母对铜耐受能力比较弱,如工业废弃酿酒酵母对废水中Cu2+的耐受浓度为2.8~13.97 mg·L-1 [13],经改良培养基可将酿酒酵母的抗铜水平提高到64 mg·L-1 [14]。而驯化则可将酵母的耐铜性大大提高。本研究选取的酵母菌未经驯化前,其对铜的耐受浓度低于200 mg·L-1,经过逐步提高铜浓度多次驯化后,其对铜的耐受浓度提高到600 mg·L-1,其对铜的耐受能力提高了3倍,这与王旭等[15]的研究结果相近,其驯化得到的酿酒酵母菌株的铜耐受铜浓度为597.19 g·g-1。因此,驯化是获得高耐铜酵母的重要手段。
3.2 酵母菌对铜吸附能力的机制
微生物对金属离子的富集能力主要决定于细胞壁的多孔结构和官能团,主要有胞外富集沉淀、细胞表面吸附和络合胞内富集3种方式,其中胞外富集和胞内富集要求微生物具有活性。胞外富集是细菌在生长过程中通过释放蛋白质和胞外多糖与溶液中的Cu2+等金属离子形成沉淀或络合物而将金属离子富集[20-22],不同的微生物释放的蛋白质和胞外多糖组成不同,与金属结合的性质不一样,富集能力也不一样,胞外富集受微生物生长条件的影响很大,且只有在溶液金属浓度低时才可进行。细胞表面吸附是细胞表面活性基团络合离子与金属离子进行交换或以络合基团为晶核进行吸附沉淀,这一过程通常迅速,受溶液pH值影响大。胞内吸附是细胞表面的酶与细胞表面吸附的金属离子相结合而转移到细胞内,即酶促反应,这一过程缓慢而复杂。微生物对Cu2+的吸附经历两个阶段,一是细胞表面的络合,在0~3 min内快速吸附Cu2+至细胞表面,二是当细胞表面Cu2+的吸附量达到总吸附量的75%时,Cu2+向细菌内部缓慢扩散[19]。研究表明,酵母菌对Cu2+表面吸附的主要部位是细胞壁,其对Cu2+的吸附量约占细胞吸附量的50%,且蛋白质的羟基基团是酵母吸附Cu2+的主要功能基团[23]。酵母菌对Cd2+的胞内吸附通过磷酸酶实现,能谱分析表明,酵母菌细胞壁上没有Cd2+的磷酸盐沉淀物,而细胞液泡内却发现了大量的镉沉淀物,磷酸酶将Cd2+运输进酵母细胞内,并以沉淀物的形式存在液泡中[24],酵母菌很有可能采用类似于Cd2+的运输方式将Cu2+转移到细胞内。本研究获得的富铜酵母风干菌体铜含量为14.97 g·kg-1。
3.3 酵母菌对铜吸附条件的影响
微生物对金属离子的吸附过程复杂,受pH值、吸附时间、金属离子浓度、温度等多种因素的影响。pH值影响生物体表面金属吸附位点并决定金属离子的化学状态,pH值过高或过低都会导致生物吸附无法进行,不同的微生物对金属离子的吸附都有一个最佳的pH值。酵母菌对铜的富集一般经过两个过程,一是酵母菌将铜离子快速结合到细胞表面,此过程是不依赖温度的代谢过程;二是酵母对铜离子的细胞代谢过程,此过程非常缓慢,但大量的铜离子富集依赖此过程,且受pH值的影响[25]。在pH值为2~6的范围内,酵母对培养基中铜离子的吸收能力随pH值的升高而升高[26]。吸附时间与微生物的种类、尺寸、形式、物理状态、吸附的重金属种类有关。啤酒酵母对Cu2+的吸附在1 h内就达到最大值,且在30 min内就可以完成最大吸附量的98.3%[27]。重金属离子浓度过高会对微生物产生毒性作用而抑制吸附。温度对微生物吸附重金属的影响与微生物的种类有关,对某些微生物来说温度对其重金属的吸附影响明显。本研究根据南方发酵条件筛选生长条件相近的菌株,在不改变原始菌株最适生长pH值、温度、生长时间的条件下,进行耐铜酵母的驯化,获得了良好的效果。
3.4 耐铜酵母的经济意义和社会效益
酵母菌是南方玉米秸秆、象草、果皮等生物发酵料的常用菌。国内外对饲料添加的细菌微生物有明确的要求,只有对人对动物无害的微生物才可以作为饲料添加剂,酵母菌是其中的常用菌之一,但并不是所有的酵母菌都可以添加到饲料中。目前已经发现的酵母超过1 500种,已经被鉴定的有700多种,只有少部分能应用于饲料。根据欧盟饲料原料目录(EU)No68/2013 中规定,只有11种酵母可在饲料中使用,其中包括酿酒酵母、产朊假丝酵母。我国饲料原料目录2013 和饲料添加剂目录2013 中对饲料使用的酵母菌和微量元素进行了限定,我国饲料原料和添加剂开发应用中合法使用的酵母菌和微量元素主要有酿酒酵母、产朊假丝酵母、啤酒酵母、酵母铜、酵母铁、酵母硒等。本研究筛选用的酵母为啤酒酵母、产朊假丝酵母、面包酵母,并最终选定啤酒酵母为耐铜酵母的驯化菌种,符合国内外饲料添加微生物的要求。酵母菌同时具备良好的的发酵特性和营养特性,出于成本、实际发酵条件及动物适用的考虑,南方生物发酵料的发酵条件为常温、偏酸,这样成本较低,更适用于实际。为配合南方生物发酵料的发酵条件,添加的富铜酵母的适宜生长条件也应为常温、偏酸才可能发挥出最好的发酵功能。以往,对耐铜的酵母的筛选多是以耐铜性能最高,生长温度、pH值最适宜为标准,其目的是富集更多浓度更高的铜,并以失活的酵母铜菌剂添加到饲料中,寻求的是有机铜这一营养元素。在本研究中,我们根据南方成本较低的生物发酵条件限定温度及pH值,模拟象草发酵的条件来筛选和驯化耐铜酵母,目的是获得具备有发酵特性的活性富铜酵母。本研究在温度为28~30 ℃,pH 值(6.2±0.2)的条件下,获得了菌体含铜量为14.97 g·kg-1的活性富铜酵母菌株,该富铜酵母可作为铜元素的添加剂为动物生产提供有机铜,同时为下一步富铜生物发酵料的研发提供菌株基础。本富铜酵母菌培养条件简单,成本低,可降低生物发酵料的生产和研发的用菌成本,有利于畜牧业发酵饲料的发展。
参考文献:
[1]王若, 臧长江, 宋广伟, 等. 微量元素铜的生物学特性及其在奶牛生产中的应用[J]. 中国奶牛, 2015(16): 10-13.
[2]肖宁. 高效铜离子吸附酵母菌的筛选及其吸附特性研究[D]. 雅安:四川农业大学, 2008.
[3]李淑敏, 史秀云. 微生物富集微量元素作为动物营养添加剂的研究及展望[J]. 饲料工业, 1998(2): 29-31.
[4]刘英丽. 不同铜源对肉仔鸡生产性能和生物利用率的影响[J]. 饲料广角, 2015(3): 34-36.
[5]肖轲. 饲料原料固态发酵工艺及其饲养效果的研究[D]. 武汉:华中农业大学, 2012.
[6]程秀芳, 朱丽梅, 李丹, 等. 固体联合发酵对棉粕发酵产物富肽蛋白产量及脱毒效果的影响[J]. 家畜生态学报, 2013, 34(9): 56-60.
[7]张文举, 许梓荣, 孙建义, 等. 假丝酵母ZD-3与黑曲霉ZD-8复合固体发酵对棉籽饼脱毒及营养价值的影响研究[J]. 中国粮油学报, 2006(6): 129-135.
[8]仲伟光, 王大广, 于维, 等. 膨化玉米秸秆发酵饲料对肉羊育肥效果的影响[J]. 中国草食动物科学, 2019(1): 29-32.
[9]邱玉朗, 李林, 纪传来, 等. 秸秆玉米浆混合发酵对肉羊生长及血液指标的影响[J]. 饲料研究, 2019(1): 1-3.
[10]武婷婷. 非常规饲料资源在肉牛育肥中的应用与典型日粮配方的研究[D]. 南宁:广西大学, 2018.
[11]TOBIN J M, COOPER D G, NEUFEILD R J. Uptake of metal ions by Rhizopus arrhiztu biomass[J]. Appl.environ microbio, 1984, 41: 21.
[12]羅文丽. 酵母菌富集微量元素铜及其在大鼠上的应用效果研究[D]. 雅安:四川农业大学, 2008.
[13]陈灿, 周芸, 胡翔, 等. 啤酒酵母对废水中Cu2+的生物吸附特性[J]. 清华大学学报 (自然科学版), 2008, 48 (12): 2093-2095.
[14]赵育, 杜君, 李海兰, 等. 抗铜酵母的诱导和筛选[J]. 酿酒科技, 2011(5): 17-22.
[15]王旭, 郑晶, 李龙, 等. 富微量元素酵母及培养条件的研究[J]. 中国卫生检验杂志, 2014, 24(4): 512-514,518.
[16]李志东, 李娜, 邱峰. 啤酒酵母菌对铜离子的吸附研究[J]. 食品工业科技, 2007(2): 99-101.
[17]张敬华. 啤酒酵母和谷壳对水体中铜铅离子的吸附研究[D]. 郑州:郑州大学, 2005.
[18]李靓洁, 董发勤, 谌书, 等. 面包酵母菌吸附黄铜矿微生物浸出矿液中Cu2+的试验研究[J]. 矿物学报, 2013, 33 (2): 163-169.
[19]王亚雄, 郭瑾珑, 刘瑞霞. 微生物吸附剂对重金属的吸附特性[J]. 环境科学, 2001(6): 72-75.
[20]CHENG M S, PATTERSON W. Heavy metals uptake by activated sludge[J]. Water pollut controp fred, 1975, 47: 362-376.
[21]FRANCIS K. Immobilization of Cadmium by microbial intracellular[J]. Arch environ contam toricol, 1991, 20: 106-111.
[22]BROWN M J, LASTER J N. Meyal removal in activated sludge: the role of bacterial extracellular polymers[J]. Water research, 1979, 13: 817-837.
[23]李峰, 張西平, 黄昆. 产阮假丝酵母细胞壁对铜离子吸收位点的研究[J]. 应用与环境生物学报, 2000, 6(1): 93-95.
[24]VOLESKY B, MAY H, HOLAN Z R. Biosorption of cadium by biomass of Saccharomyces cerevisiae[J]. Biotech and bioeng, 1993, 41: 819-825.
[25]BRADY D, GLAUM D, DUNCAN J R. Copper tolerance in Saccharomyces cerevisiae[J]. Applied microbiology, 1994(18): 245-250.
[26]HAN R P, LI H K, YAN H L, et al. Biosorption of copper and lead ions by waste beer yeast[J]. Journal of hazardous materials B, 2006(137): 1569-1576.
[27]李明春, 姜恒, 侯文强, 等. 酵母菌对重金属离子吸附的研究[J]. 菌物系统, 1998, 17(4): 367-373.

