腹膜透析患者衰弱状况及其影响因素分析的横断面研究
朱丽娜,林建雄,林小燕,于晓丽,张小丹
(中山大学附属第一医院腹膜透析中心,广东广州,510080)
衰弱是一种临床综合征,其特征是生理储备功能减弱,多系统功能失调,使机体保持内环境稳定的能力下降,对应激事件更加敏感[1],可导致患者发生意外伤害,降低患者的自理能力,影响患者的生活质量[2]。国外文献报道[3-4],腹膜透析(peritoneal dialysis,PD)患者衰弱发生率为37.4%~69.4%,而且衰弱可导致PD患者骨折、残疾、住院及死亡[5]。国内外专家[6-8]对维持性血液透析患者衰弱的高发性、相关影响因素及临床结局进行研究,然而针对PD患者衰弱的状况尚缺乏研究。仅有香港学者[4]研究当地PD患者衰弱现状及其对患者住院率及延长住院日的影响。另外,目前国际上对于衰弱尚没有统一的诊断标准和评估方法。本研究采用横断面研究方法,应用ROCKWOOD等[9]制定的临床衰弱量表(该量表采用了简单的临床参数,纳入共病、认知功能损害和功能情况,从临床表现上主观判断,对患者的衰弱情况进行分级,与本研究目标一致),评估本中心142例PD患者衰弱现状及其影响因素,旨在为临床护理该类患者提供循证依据,现报道如下。
1 对象与方法
1.1 研究对象
采用便利抽样法,选取2016年5月至12月在本院门诊随访的PD患者为研究对象。纳入标准:①年龄18周岁以上;②腹膜透析3个月以上;③神志清楚,能正确应答。排除标准:①既往诊断有精神智力障碍、听力障碍、躯体残疾者;②合并恶性肿瘤、急性感染、严重心血管疾病、严重急性脑血管病等急、危重者。研究对象均签署知情同意书且自愿参加本研究。样本量的估算采用每个变量的事件数作为标准(events per variable,EPV)的方法,即每个自变量的事件数,其中事件表示因变量中个数较少的那一类[10]。本研究依据EPV 至少为10以确定所需的最小样本量和可以纳入的自变量的最大数量,如自变量有7个,衰弱的发生率为50.70%,则样本量不能少于138例(即7×10÷50.70%)。本研究共调查144例患者,符合样本量要求。
1.2 研究方法
1.2.1 一般资料调查问卷 由研究者根据研究目的及内容,通过文献回顾[3-4]、咨询专家、前期研究组成员讨论自行设计,包括年龄(根据国际年龄标准分为18~40岁、41~59岁与60岁以上3组)、性别、合并糖尿病(根据WHO 1998年糖尿病诊断标准[11])、透析龄等,详见表1。
1.2.2 血标本收集及实验室检查 患者抽血检查前禁食8h,于腹透中心门诊留取血标本,测定血清白蛋白、血钙、血磷、血钾、血肌酐及血红蛋白。
1.2.3 临床衰弱量表 临床衰弱量表(clinical frailty scale,CFS)是由ROCKWOOD等[9]于2005年编制,为等级评定量表。该量表简单易行,研究表明[12],该评估量表可以和复杂的多项目工具一样起到良好的评估与诊断预测作用。国外专家建议[13]将CFS量表作为临床肾脏病患者筛查衰弱的常规工具。CHAN等[14]用CFS量表对台北市第三医学中心门诊67例老年人进行衰弱状况调查,验证其信度为0.684,效度为0.689。该量表从4个维度:移动能力、精力、体力活动和功能上对患者进行全面评估,分为7个等级:1=非常健康;2=健康;3=健康但伴有需要治疗的疾病;4=亚健康;5=轻度衰弱;6=中度衰弱;7=重度衰弱。级别越高代表衰弱程度越重。本研究根据CFS评估结果将患者分为衰弱(5~7级)和非衰弱(1~4级)两组。
1.2.4 动脉血管功能评估 采用日本欧姆龙动脉硬化检测仪(BP-203RPE III)测量患者动脉血管状况。由仪器自动测定踝臂指数(ankle brachial index,ABI),对每位受检者均重复测量2 次,取第2 次数据为最后结果。取左右两侧ABI的低值作为该患者ABI值进行统计学分析。近年来,国内外大规模循证医学研究显示[15],ABI是一种无创检测血管阻塞或钙化的筛查工具,其判断标准为:0.9~1.3为正常;ABI<0.9,有动脉阻塞的可能性;ABI≥1.3,血管有疑似钙化[16]。
1.2.5 查尔森合并症评分(Charlson comorbidity index,CCI) 其是最常用的评价基础疾病状态的评分方法之一。其包括19 种基础疾病,按疾病权重计分,累加之和即为患者的基础疾病评分[17]。
1.3 调查方法
采用问卷调查的形式,由2名非研究组人员向患者发放问卷,调查前统一培训,并明确调查的方法及标准,确保调查过程统一一致。向患者讲解本研究的内容、目的以及问卷填写的方法、注意事项,填写完毕后由研究者当场收回。文化程度低者或其他情况不能完成问卷填写的,调查员逐条阅读,患者独立做出选择,调查员记录。
1.4 统计学方法
数据采用SPSS20.0 统计软件进行统计学分析。正态分布计量资料采用(±s)描述,组间比较采用t 检验;非正态分布计量资料采用M(P25~P75)表示,组间比较采用秩和检验;计数资料采用例数和百分率描述,组间比较采用χ2检验;采用全进法logistic 回归法分析影响腹膜透析患者衰弱的因素。检验水准α=0.05。
2 结果
2.1 腹膜透析患者的一般资料
本次共发放调查问卷144份,回收有效问卷142 份,其中2份问卷因临床实验室结果缺失无效,有效回收率为98.61%。142例PD患者中男80例(56.34%),女62例(43.66%);年龄18~89岁,平均(53.73±15.87)岁;中位透析月35.50(16.00~68.00)个月。基础肾脏病方面:肾小球肾炎77例(54.23%),糖尿病肾病28例(19.72%),高血压肾病12例(8.45%),其他25例(17.60%)。
2.2 PD患者的衰弱状况
70例PD患者未发生衰弱,占49.30%;72例PD患者存在衰弱,占50.70%,其中轻度衰弱47例(33.10%),中度衰弱20例(14.08%),重度衰弱5例(3.52%)。
2.3 PD患者衰弱影响因素的单因素分析
PD患者衰弱影响因素的单因素分析见表1。由表1可见,在年龄、合并糖尿病、CCI、白蛋白、Kt/V、残余肾功能、血管阻塞指标非衰弱组和衰弱组间比较,差异具有统计学意义(均P<0.05);在性别、透析龄、钙、磷、钾、肌酐、血红蛋白指标非衰弱组和衰弱组间比较,差异无统计学意义(均P>0.05)。
2.4 PD患者衰弱影响因素的logistic回归分析
以是否衰弱作为因变量(0=非衰弱,1=衰弱),以单因素中有统计学意义的变量(年龄、合并糖尿病、CCI、白蛋白、Kt/V、残余肾功能、血管阻塞)为自变量(计量资料采用原始数值,其他分类变量赋值方式见表2)进行二元Logistic回归分析,见表3。由表3可见,年龄及Kt/V是PD患者发生衰弱的独立危险因素(均P<0.05),即随着患者年龄的增长发生衰弱的风险也随之增高;透析充分性不良的患者发生衰弱的风险也更高。
表1 非衰弱组与衰弱组患者的临床及实验室指标比较[±S;M(P25~P75);n/%]
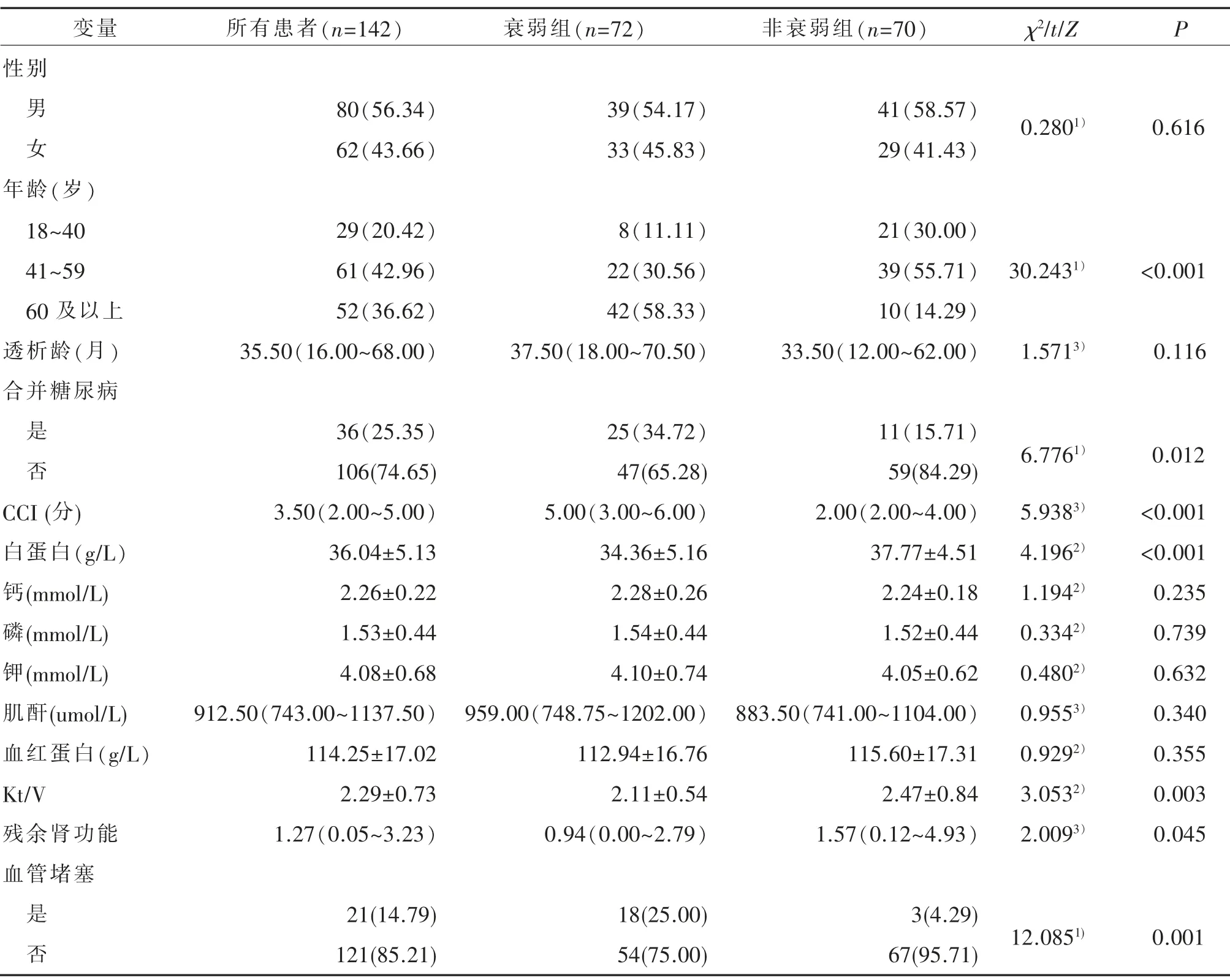
表1 非衰弱组与衰弱组患者的临床及实验室指标比较[±S;M(P25~P75);n/%]
注:1)为χ2值;2)为t值;3)为Z值。1.查尔森合并症(Charlson comorbidity index,CCI)。2.尿素清除率(Kt/Vof urea,Kt/V)。
变量性别所有患者(n=142)衰弱组(n=72)非衰弱组(n=70)χ2/t/Z P男 女80(56.34)62(43.66)39(54.17)33(45.83)41(58.57)29(41.43)0.2801) 0.616年龄(岁)18~40 41~59 60 及以上透析龄(月)合并糖尿病29(20.42)61(42.96)52(36.62)35.50(16.00~68.00)8(11.11)22(30.56)42(58.33)37.50(18.00~70.50)21(30.00)39(55.71)10(14.29)33.50(12.00~62.00)30.2431)1.5713)<0.001 0.116是否CCI(分)白蛋白(g/L)钙(mmol/L)磷(mmol/L)钾(mmol/L)肌酐(umol/L)血红蛋白(g/L)Kt/V残余肾功能血管堵塞是否36(25.35)106(74.65)3.50(2.00~5.00)36.04±5.13 2.26±0.22 1.53±0.44 4.08±0.68 912.50(743.00~1137.50)114.25±17.02 2.29±0.73 1.27(0.05~3.23)21(14.79)121(85.21)25(34.72)47(65.28)5.00(3.00~6.00)34.36±5.16 2.28±0.26 1.54±0.44 4.10±0.74 959.00(748.75~1202.00)112.94±16.76 2.11±0.54 0.94(0.00~2.79)18(25.00)54(75.00)11(15.71)59(84.29)2.00(2.00~4.00)37.77±4.51 2.24±0.18 1.52±0.44 4.05±0.62 883.50(741.00~1104.00)115.60±17.31 2.47±0.84 1.57(0.12~4.93)3(4.29)67(95.71)6.7761) 0.012 5.9383)4.1962)1.1942)0.3342)0.4802)0.9553)0.9292)3.0532)2.0093)<0.001<0.001 0.235 0.739 0.632 0.340 0.355 0.003 0.045 12.0851) 0.001

表2 自变量赋值方式
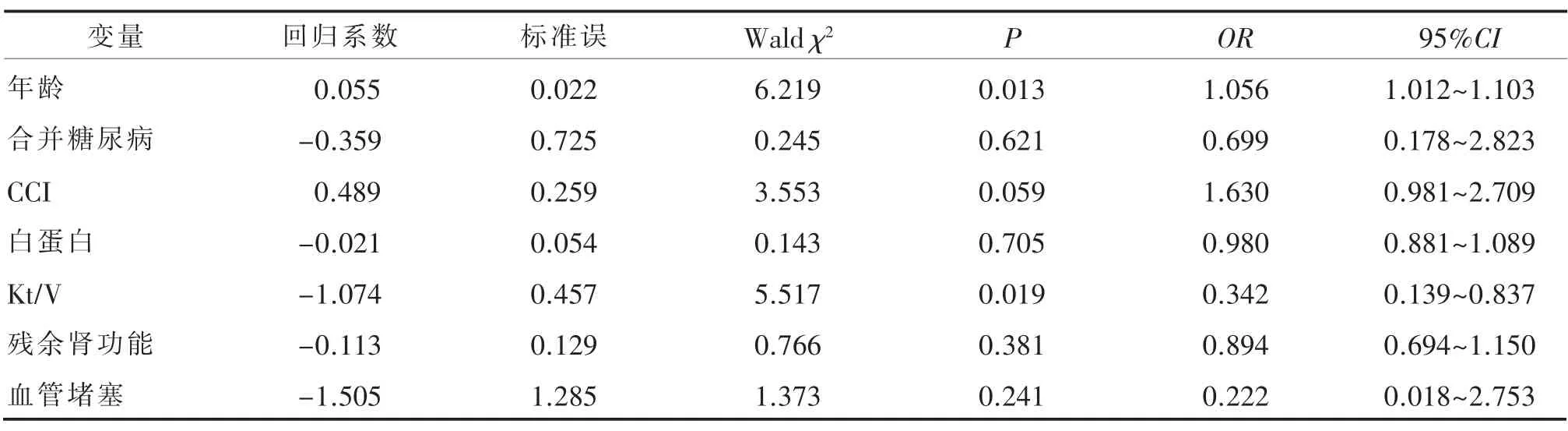
表3 腹膜透析患者发生衰弱相关因素的Logistic回归分析(n=144)
3 讨论
3.1 PD患者衰弱发生率较高
本研究调查发现,PD患者衰弱发生率高达50.70%。中国香港学者[4]对193例香港PD患者的衰弱状况调查发现,衰弱发生率高达69.4%,本研究结果与之相比较低,这可能与选用的衰弱测量工具、患者的地域、文化背景等不同有关。由于PD疾病本身引起下丘脑对食欲调节的缺陷,引起患者食欲下降,能量摄入减少,蛋白质分解代谢进一步引起肌少症[18];长期慢性肌肉减少又可使个体独立性及身体功能降低,最终发展为衰弱[19]。本研究还发现,72例PD患者主要以轻度衰弱(33.10%)为主,这可能由于本中心完善的透析教育、规律门诊随访和定期电话随访,早期发现患者存在的问题,通过早期调节钙磷-矿物质代谢紊乱,及时调整用药和透析方案减缓高血压和水肿的发展,从而避免患者病情的进一步加重。研究指出[20],PD患者换液操作不依从、服用药物依从性差、饮食液体摄入控制差,从而引起患者腹膜炎、贫血、水肿及心力衰竭[21],从而促进衰弱的发生。因此,腹透医务人员应重视PD患者衰弱的筛查,提早预防及干预,进而延缓患者衰弱的进程。
3.2 PD患者衰弱的影响因素分析
3.2.1 年龄 本研究结果显示,年龄是PD患者衰弱的危险因素(P<0.05)。随着年龄的增长,衰弱的发生率不断提高,与相关研究报道一致[22]。国外文献报道[4],60岁以上PD患者衰弱患病率达75%,本研究发现,年龄超过60岁的患者衰弱发生率58.33%。老年PD患者常同时合并有高血压、糖尿病(本研究25.35%的患者合并糖尿病)等疾病,合并多病会加快机体各器官功能衰退,促使多个系统生理储备迅速下降,处于慢性损耗状态,体内平衡出现紊乱,从而导致衰弱的发生[23]。而且年龄的增加导致肌肉的合成能力减弱[24],肌肉质量降低、骨密度减少以及慢性炎症也是老年人衰弱发生的重要病理生理学机制[25]。由此提示,临床医务人员应对特别是年龄超过60岁的PD患者常规进行衰弱筛查,积极治疗控制老年PD患者的合并疾病,延缓衰弱的进程。而因为肌力的下降,还影响老年PD患者的平衡力而易发生跌倒[26],临床医护人员应加强对这一人群的防跌倒干预。
3.2.2 Kt/V 本研究发现,透析不充分的PD患者其发生衰弱风险越大(P<0.05)。相关文献指出[4],衰弱与KT/V 成负相关,与本文研究结果相一致。这主要是由于患者透析不充分时,易出现尿毒症临床症状如失眠、恶心、呕吐、乏力、纳差、血压控制不良、水肿,营养不良和贫血等。PD患者透析不充分还可导致食欲下降,致使营养摄入减少,严格的饮食控制又进一步限制了患者的营养摄入,极易出现营养不良的情况[27]。而营养不良、代谢分解异常、尿毒症毒素、炎症等因素又会导致蛋白质能量消耗,致使患者体重下降、脂肪含量减少、肌肉萎缩,进而使患者处于衰弱的状态[28]。因此,在临床上,医务人员应每3个月监测患者kt/V,及时调整透析处方,增加小分子溶质清除,预防发生透析不充分,预防和延缓衰弱的发生。
4 结论
本研究发现,衰弱在PD患者中发生率较高,而且年龄超过60岁的老年PD患者是衰弱的高发人群。年龄和透析不充分性是PD患者发生衰弱的独立危险因素。欧洲肾脏病工作小组提出的指南[29]中建议对老年肾脏病患者进行衰弱评估。作为临床医务人员,应提高对高风险人群进行筛查的意识,特别是老年PD患者应采用老年综合评估(comprehensive geriatric assessment,CGA)多学科、多层面来评估患者疾病、心理社会及躯体功能状态[30],更有效地干预该人群的衰弱状况。本研究采用便利取样法,样本来源单一,可能导致结果产生偏倚,影响了研究结果向外推论;同时因时间和人力的限制,本研究只探索衰弱的影响因素,未进一步研究衰弱的预后及对患者临床结局的影响。随着研究的深入,未来将展开大样本、多中心的纵向跟踪研究,为制定全面有效的干预措施提供依据,有效预防和延缓PD患者衰弱的发生、发展。

