两种碎石术治疗不同肾盂漏斗部夹角的肾下盏结石
但超 王黎 姚启盛 龚小新 王俊霖 杨勇
1 十堰市太和医院 湖北医药学院附属医院泌尿外科及男科442000 湖北十堰
肾下盏结石占肾结石的36%[1],但目前对于≤2 cm 肾下盏结石最佳的外科手术方式仍存在争议[2],微通道经皮肾镜碎石术(micro-percutaneous nephrolithotomy,MPCNL)和输尿管软镜碎石术(flexibile ureteroscopy,FURS)均为治疗肾下盏结石的治疗方法[1,3]。在肾下盏空间结构的评估中,肾盂漏斗部夹角(infundibulopelvic angle,IPA)是一项重要参数,IPA 的大小与术后的结石清除率密切相关,临床上公认为IPA 夹角为30°作为肾下盏结石手术方式选择的一个分界点[4-5],但目前国内外针对不同IPA 夹角治疗肾下盏结石手术方式的报道并不多,我院2016 年8月-2018 年1 月采用微通道经皮肾镜碎石和输尿管软镜行钬激光碎石术治疗不同IPA 夹角的肾下盏结石,疗效满意,现报告如下。
1 临床资料
1.1 一般资料
选取十堰市太和医院泌尿外科2016 年8月-2018 年1 月收治的肾下盏结石患者90 例纳入研究。纳入标准:所有的患者术前均通过泌尿系彩超、泌尿系CT 确诊为单侧单发的肾下盏结石,研究经伦理委员会批准,患者及家属对手术方案知情同意。排除标准:肾脏多发结石、肾脏的解剖学异常、既往有过泌尿系结石的手术史、凝血功能异常以及妊娠期患者。术前常规行尿液分析及尿培养检查,尿培养阳性患者选用敏感抗生素治疗,待尿培养阴性后再行手术治疗。
所有患者术前通过泌尿系CTU 三维重建技术测量IPA,以IPA 夹角为30°作为一个分界点,将患者分为IPA>30°组和IPA≤30°组,IPA>30°组根据手术方式分为微通道经皮肾镜碎石亚组(A 组)32 例和输尿管软镜钬激光碎石亚组(B 组)28 例,IPA≤30°组根据手术方式分为输尿管软镜钬激光碎石亚组(C 组)10 例以及输尿管软镜联合微通道经皮肾镜碎石亚组(D 组)20 例。手术均由泌尿系结石亚专业组同一术者完成,各组患者的一般资料比较差异无统计学意义(P>0.05)(表1)。
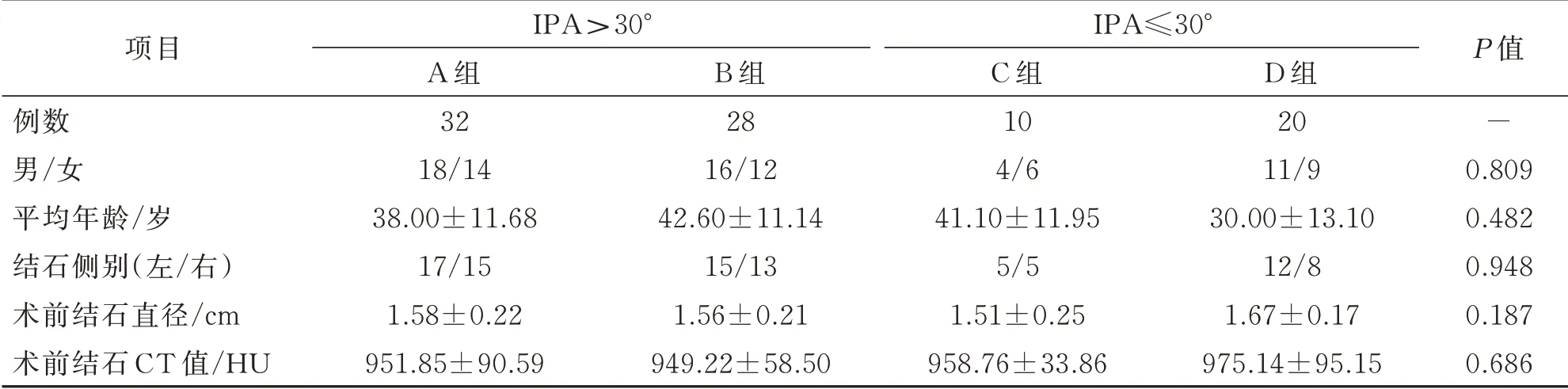
表1 各组患者一般资料
1.2 手术方法
A 组:采用全身麻醉,患者取截石位,于结石侧先采用F8/9.8输尿管镜常规行输尿管镜检,当输尿管镜顺利进入肾盂后,留置F4.8双J 管一根,将患者改为俯卧位,在超声引导下选择肩胛下线至腋后线与11 肋到12 肋交点之间区域为穿刺部位,使用F4.8可视化穿刺针(Poly Diagnost,Pfaffenhofen,德国)在超声引导下行肾下盏穿刺,从灌注通道注入生理盐水,通过连接的显示器全程观察穿刺途径的组织,穿刺成功后观察通道质量情况,若穿刺通道不利于碎石,则重新建立穿刺通道。确认穿刺通道质量后,经激光光纤通道置入200 μm 钬激光行粉末化碎石,碎石完毕后拔除可视化穿刺针,穿刺点消毒后贴无菌敷料,所有患者术后2 周行采用物理振动排石床辅助排石治疗。
B 组:采用全身麻醉,患者取截石位,于结石侧先采用F8/9.8输尿管常规行输尿管镜检,当输尿管镜顺利进入肾盂后,通过输尿管镜置入斑马导丝,退出输尿管镜,沿斑马导丝置入输尿管软镜输送鞘,沿输尿管软镜输送鞘置入STORZ 电子输尿管软镜,到达肾盂后寻及肾下盏结石,使用200 μm 钬激光行粉末化碎石,碎石后若结石碎片偏大,术中配合取石网篮取出结石碎片,留置F4.8双J 管一根,所有患者术后2 周行采用物理振动排石床辅助排石治疗。
C 组/D 组:采用全身麻醉,患者取截石位,于结石侧先采用F8/9.8输尿管镜常规行输尿管镜检,待输尿管镜顺利进入肾盂后,通过输尿管镜置入斑马导丝,退出输尿管镜,沿斑马导丝置入输尿管软镜输送鞘,再沿输尿管软镜输送鞘置入STORZ 电子输尿管软镜,到达肾盂后寻及肾下盏结石,对于输尿管软镜可寻及的结石,置入200 μm 激光,在输尿管软镜最大偏转角度下行激光碎石术,对于碎石后的部分残余结石,术中配合取石网篮、适当加大冲水压力以及采取患侧肾区托高等辅助方法使残石移位后继续行激光碎石术,完成碎石术后留置F4.8双J 管一根,所有患者术后2 周行采用物理振动排石床辅助排石治疗。对输尿管软镜下无法寻及或无法粉碎的结石,则采用FURS 联合MPCNL 碎石(D 组),退出输尿管软镜,保留并固定输尿管软镜输送鞘,将患者改为俯卧位,手术方式同A 组,碎石完毕后拔除可视化穿刺针,穿刺点消毒后贴无菌敷料,再次将患者改为截石位,结石侧置入输尿管镜,留置F4.8双J 管一根,所有患者术后2 周行采用物理振动排石床辅助排石治疗。
1.3 观察指标
记录患者的手术时间、手术前后血红蛋白下降情况、术后血清降钙素原水平(双向侧流免疫法)、术后发热情况(术后体温≥38.5℃)[6]、术后VAS 评分、术后住院时间及术后清石率;使用Clavien-Dindo 分级系统对术后的并发症进行分级[6],以Clavien Ⅰ~Ⅱ为次要并发症,以ClavienⅢ~Ⅴ为主要并发症;术后4 周行泌尿系CT 检查评估结石残留情况,将残留结石碎片直径≤4 mm定义为无结石残留。所有患者只统计Ⅰ期手术情况。
1.4 统计学分析
采用SPSS 20.0 统计软件进行数据分析,计量资料用表示,采用独立样本t 检验;计数资料用相对数表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
A 组和B 组在血红蛋白下降程度、血清降钙素原水平、术后VAS 评分、输血情况、术后感染发生率(Clavien Ⅰ级)、平均住院时间及结石清除率方面均差异无统计学意义(P>0.05),但A 组手术时间短于B 组,差异有统计学意义(P<0.05)。
C 组和D 组患者在血红蛋白下降程度、血清降钙素原水平、术后VAS 评分、术后感染发生率(Clavien Ⅰ级)及平均住院时间方面均差异无统计学意义(P>0.05);D 组的手术时间长于A 组,差异有统计学意义(P<0.05)。
D 组的降钙素原高于A 组,术后两组患者发热情况均差异无统计学意义(P>0.05);D 组和A组的术后血红蛋白下降程度均高于B 组,差异无统计学意义(P>0.05)。各组术后出现感染的患者均为Clavien Ⅰ级并发症,无Clavien Ⅱ~Ⅴ级并发症出现(表2)。
3 讨论
目前治疗肾下盏结石的微创手术方式主要包括ESWL、FURS 及PCNL,过去ESWL 被认为是治疗肾下盏结石最理想的治疗方案[2],但最大的局限性是其不可预测结果,易受到一些不利的肾下盏空间解剖因素影响,如IPA 夹角、肾下盏漏斗部长度(infundibular length,IL)、肾下盏漏斗部宽度(infundibular width,IW)等均会影响ESWL 碎石成功率,导致出现较低的结石清除率和较高的再治疗率[7-8],文献报道对于IPA 夹角小、IL>10 mm、IW<5 mm 的肾下盏结石患者,ESWL 术后结石清除率仅为16%[9],远远达不到临床治疗效果,因此在具有挑战性解剖学因素的情况下,FURS 和PCNL 是可选择的治疗方案[10]。
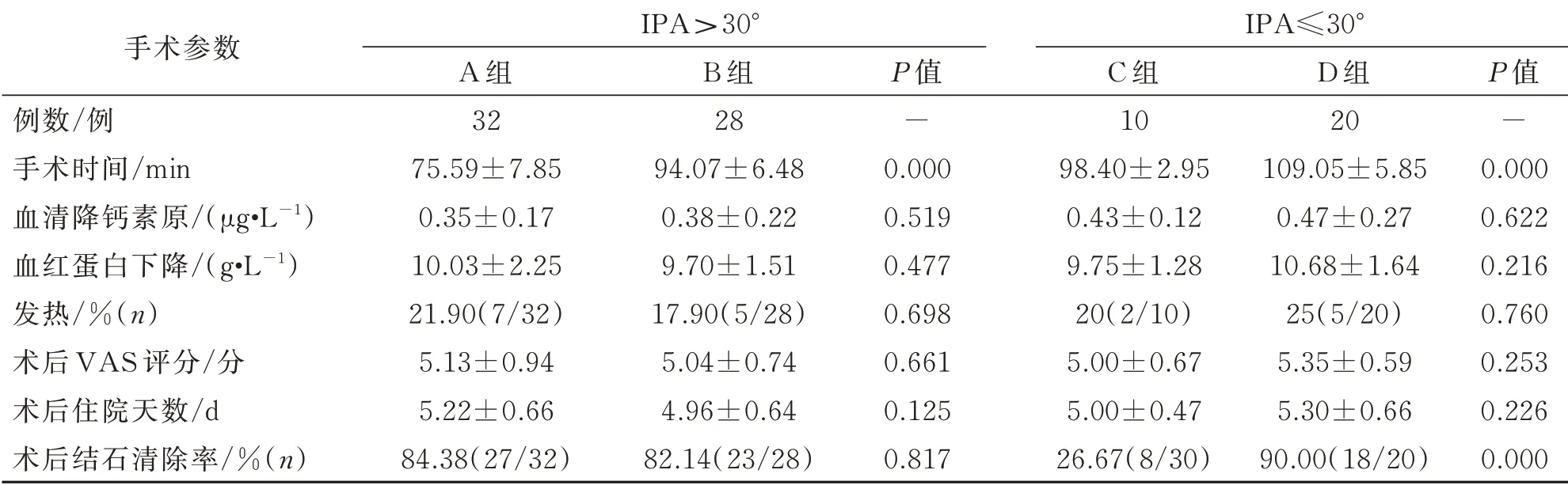
表2 各组患者相关手术参数
2016 年EAU 推荐输尿管软镜为治疗肾下盏结石的一线治疗方法,对于肾下盏1~2 cm 结石,与ESWL 相比,逆行输尿管镜碎石术具有更高的结石清除率和较低的再治疗率,术后相关并发症与PCNL 相比明显降低[11-12],但其结石清除率同样受到肾下盏空间解剖因素的影响[4,9],对于IPA≤30°肾下盏结石患者,由于镜体末端偏转角度的限制,输尿管软镜无法寻及结石或无法粉碎结石,显著影响了手术成功率,这一观点在多篇文献中得到证实[4-5,13-16]。
MPCNL 是一种基于光学和穿刺系统改进的创新技术,最初在2011 年由Bader 等[17]报道了可视化穿刺针在肾结石患者行标准PCNL 手术中穿刺通道建立的应用,认为可视化穿刺针在确定扩张穿刺通道之前是有帮助的,提高了PCNL 手术的安全性,随后Desai 等[18]首次报道了通过F4.85可视化穿刺针行一步法经皮肾镜碎石术的可行性和安全性,与PCNL(标准PCN、MPCNL 及SMP)相比,其优势在于可视化的穿刺系统在从皮肤到肾集合系统穿刺的过程中能清楚的显示每个穿刺平面,明确穿刺针在肾盂肾盏内的位置,从而建立最佳穿刺通道,并且无需行扩张穿刺通道,正是由于这种优势,因此能确保穿刺的过程中安全的进入目标肾盏,并且不会损伤周围脏器和导致严重的出血,多项研究结果指出MPCNL 在治疗中小型肾下盏结石是安全、有效的,具有更高的结石清除率[1,10,13,22],同时Caione等[23]用Micoperc 治疗小儿肾下盏结石,术后结石清除率达到100%。
在本研究中,我们将IPA 夹角30°作为一个分界点,对于IPA>30°的肾下盏结石患者均成功行实施手术,A 组和B 组的结石清除率无明显差异(84.38%、82.14%),术后相关并发症情况类似,无重大并发症出现,MPCNL 和FURS 均为治疗IPA>30°的10~20 mm 肾下盏结石的可选择方案。而对于IPA≤30°的肾下盏结石,有10 例患者单独完成了FURS 碎石术,但术后1 个月CT 检查提示仅有8 例患者达到结石清除标准,术后1个月结石清除率为26.67%(8/30),说明FURS 单独治疗对于IPA≤30°肾下盏结石的局限性和低的结石清除率,本资料20 例FURS 联合MPCNL碎石的患者术后1 个月结石清除率为90%(18/20),我们分析主要原因为:①MPCNL 的最大优势在于穿刺过程中的可视化,确定对目标肾盏的穿刺建立最佳通道,达到精准穿刺,并且穿刺的角度不受IPA 的影响,使碎石过程更加平稳的进行;②手术开始时,首先置入输尿管软镜,对于输尿管软镜能够到达肾下盏,并能使用激光碎石的患者,在输尿管软镜最大限度偏转角度下行激光碎石术,减少了MPCNL 碎石时的结石负荷;③对于输尿管软镜无法寻及肾下盏结石或置入激光光纤后无法行碎石的患者,以及激光完成部分碎石的患者,我们均保留输尿管输送鞘,与单独的MPCNL 术中留置输尿管支架管相比,输尿管输送鞘管径相对较粗,在碎石过程中灌注液的冲洗下,能够及时排石结石粉末或碎片,提高结石的清除率。
MPCNL 在碎石过程中与PCNL 不同,由于缺乏术中工作通道鞘管所起到灌注液引流的作用,术中会导致肾盂内高压情况,Tepeler 等[24]在研究中指出MPCNL 在整个手术过程中肾盂内压力(intrarenal pelvic pressure,IPP)都显著高于PCNL 组,在术中IPP 最高可达(4.03±0.52)kPa[(30.3±3.9)mmHg],而PCNL 组 为(2.67±0.41)kPa[(20.1±3.1)mmHg],同时当IPP 内压力达到3.99~4.66 kPa(30~35 mmHg),会导致肾盂静脉、肾盂淋巴、肾盂肾小管反流和肾盏的破裂,肾脏集合系统吸收碎石过程结石本身或灌注液中的细菌和毒素是导致术后发热因素,手术时间的长短也是术后发热的影响因素。在本研究中,D 组的手术时间最长,主要由于在手术过程中需更换三次体位,同时在输尿管软镜操作过程中,反复寻找下盏结石、置入激光尝试碎石以及在各组辅助方式尝试下使碎石后的残余结石移位等时间耗损均是影响因素,但术后发热患者与IPA>30°中A 组情况相似,术后降钙素原结果无明显差异,主要在于碎石过程中置入了输尿管软镜的输送鞘,及时引流灌注液,减低肾盂肾盏压力,减少术后出现感染情况,同时对于输尿管软镜能够到达肾下盏并行激光击碎部分结石的患者,击碎部分结石后,从而相对来说缩短了MPCNL 的术中碎石时间,也是降低术后感染的因素。
关于术中出血问题,本研究中D 组和A 组的术后血红蛋白下降均高于B 组,差异无统计学意义,所有患者术后均无需输血,证明MPCNL 并不增加术中、术后出血量,不影响患者术后恢复时间,与PCNL 不同,PCNL 的最大并发症为出血,在一项纳入5 803 例患者行PCNL 的全球临床研究试验中指出,术后主要并发症:显著出血(7.8%),输血(5.7%),并且出血量主要与扩张穿刺通道的大小有关[25],而MPCNL 用细的16G 穿刺针行穿刺通道的建立,无需行穿刺通道的扩张,同时关于穿刺针出血的研究表明,穿刺所致的肾脏出血,真正有显著差异的是在比较14G 和16G 穿刺针,只有穿刺针在14G 以下时肾脏的病理学切片提示有显著出血,而MPCNL 术中穿刺所用正是16G 穿刺针,因此MPCNL 在处理肾下盏结石是安全的[26]。
综上所述,对于IPA>30°的肾下盏结石,微通道经皮肾镜碎石术和输尿管软镜的结石清除率相似,并发症低,均是可选择的治疗方案,而对于IPA≤30°的肾下盏结石,输尿管软镜具有局限性,单独行输尿管软镜碎石术结石清除率低,建议行微通道经皮肾镜碎石术或输尿管软镜联合微通道经皮肾镜碎石术来达到更好的临床治疗效果。
——可重复性或一次性输尿管软镜孰优孰劣?

