DHA玻璃体注射对ARMD大鼠模型光感受器细胞凋亡和PI3K/Akt通路的影响
王 辉,沈 玲,姬 翔
0引言
年龄相关性黄斑变性(age-related macular degeneration,ARMD)多发生于50岁以上老年人,又被称为老年黄斑变性。随着社会老龄化的加剧,ARMD发病率逐年上升,已成为第三大致盲原因,严重威胁中老年人身体健康[1]。ARMD分为干性和湿性两种类型,临床中以干性患者为主。目前,干性ARMD主要应用抗氧化剂进行治疗,缺少有效的药物缓解ARMD进展[2]。磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(phosphatidylinositol-3-kinase/serine threonine protein kinase,PI3K/Akt)信号通路是细胞内重要的信号转导通路之一,可调控下游多种活化因子,参与细胞的增殖、分化和凋亡等生命过程[3]。研究表明,PI3K/Akt信号通路在增殖性玻璃体视网膜病、后发性白内障、青光眼等多种眼科疾病的发生和发展过程中发挥关键作用[4]。二十二碳六烯酸(docosahexaenoic acid,DHA)是人体必须的不饱和脂肪酸,可促进视网膜光感受器细胞和中枢神经系统的发育。研究表明,DHA可能通过ROS/Nrf2途径诱导视网膜色素上皮细胞表达HO-1,从而发挥对视网膜色素上皮细胞的保护作用[5]。饮食补充DHA可能通过提高胰岛素敏感性,降低血清成纤维细胞生长因子21显著改善非酒精性脂肪性肝病患者血脂水平[6]。DHA可降低人视网膜色素上皮细胞ARPE-19凋亡率,诱导ARPE-19细胞HO-1 mRNA和蛋白表达,对ARPE-19细胞发挥保护作用[7]。目前,DHA对ARMD患者光感受器影响的研究相对较少。本研究通过光损伤法建立ARMD大鼠模型,研究DHA对ARMD大鼠视网膜光感受器细胞凋亡的影响,并探讨了其可能的作用机制,以期为该疾病的治疗提供新方法。
1材料和方法
1.1材料
1.1.1实验动物健康雄性SD大鼠60只,清洁级,8周龄,体质量160~230g,由上海斯莱克实验动物有限责任公司提供,动物合格证号:SCXK(沪)2017-0005。大鼠自由饮水和饮食,饲养温度20℃~25℃,湿度50%~56%,光照12h。本研究经本院动物伦理委员会批准同意。
1.1.2实验试剂和仪器DHA(批号:20171115),美国Sigma公司;TUNEL试剂盒(批号:20171216),瑞士罗氏(Roche)公司;TNF-α(批号:20171216)和IL-6(批号:20171329)试剂盒,南京建成生物工程研究所;BCA试剂盒(批号:20180125),上海碧云天公司;NF-κBp65(批号:Bs-0467R)和p-NF-κBp65(批号:Bs-0458R)抗体,北京博奥森生物技术有限公司;PI3K(批号:Sc1236)和p-PI3K抗体(批号:Sc1152),Santa Cruz公司;Akt(批号:9275)和p-Akt(批号:9246)抗体,美国Cell Signaling公司;Bax(批号:Sc1215)和Bcl-2(批号:Sc1237)抗体,美国Santa Cruz公司;cleved-caspase-3抗体(批号:20180214),武汉博士德生物工程有限公司。珊顿石蜡切片机,英国;XSP-9CA光学显微镜,上海光学仪器一厂;H-600型透射电镜,日本日立公司。
1.2方法
1.2.1实验分组和模型建立大鼠适应性饲养7d后,按照随机数字表法分为空白对照组、模型组、低剂量DHA组(L-DHA组)、中剂量DHA组(M-DHA组)和高剂量DHA组(H-DHA组),每组12只。参照文献方法采用视网膜光损伤法建立干性ARMD大鼠模型[8]。L-DHA组、M-DHA组和H-DHA组分别按剂量2.5、5.0、10μg/kg玻璃体注射DHA[9]。空白对照组和模型组注射等量生理盐水。造模起开始治疗,每10d注射一次,注射5次。
1.2.2标本采集最后一次给药结束后,大鼠腹腔注射2%戊巴比妥钠麻醉,断颈处死,冰浴下摘取眼球,沿赤道部剖开,剥离视网膜组织。其中每组中6只大鼠右眼视网膜组织4%多聚甲醛固定,制作石蜡切片,HE染色后行病理学观察和TUNEL检测。6只大鼠的左眼视网膜组织2.5%戊二醛固定,行透射电镜观察。剩余6只大鼠视网膜组织-80℃保存备用。
1.2.3 TUNEL原位凋亡检测石蜡切片经常规脱蜡处理、PBS冲洗后,将切片置于湿盒中,滴加50μL蛋白酶工作液,37℃水浴20min,PBS冲洗3次,滴加20μL TUNEL反应液,37℃水浴1h。PBS冲洗3次后,滴加20μL Converter-POD溶液,37℃水浴30min。PBS冲洗3次后,滴加50μL DAB工作液进行显色反应,PBS冲洗。苏木素复染10s,自来水漂洗,盐酸、酒精分化数秒,自来水漂洗,1%氨水泛蓝,自来水漂洗。酒精梯度脱水,二甲苯透明,中性树脂封片。400倍镜下观察TUNEL染色切片,分别计算外核层和神经节细胞层细胞凋亡指数(AI)。AI =凋亡细胞数/总细胞数×100%。
1.2.4酶联免疫吸附法测定视网膜组织TNF-α和IL-6水平取视网膜组织1g,添加9mL生理盐水于匀浆器中制备组织匀浆液,3000r/min离心10min后,保留上清,参照酶联免疫测定视网膜组织TNF-α和IL-6水平,在酶标包被板添加50μL标准品,设空白孔(不添加样品和酶标试剂)、待测样品孔,将40μL样品、10μL亲和素加入待测样品孔,封板后37℃反应30min,清洗、拍干后,添加50μL酶标试剂(空白孔除外),封板后37℃温育30min,洗涤、拍干后,添加100μL显色剂,37℃避光放置5min,添加50μL终止液结束反应,于450nm波长检测各孔OD值,绘制标准品曲线计算样品浓度。
1.2.5 Western Blot检测蛋白表达取视网膜组织,充分裂解后,BCA法定量蛋白含量。取30μg蛋白质,加入上样缓冲液,95℃煮沸5min,进行SDS-PAGE电泳。电泳结束后,将蛋白条带转移至PVDF膜,5%脱脂牛奶37℃封闭1h。TBST洗膜后,分别加入Bax、p-NF-κBp65和cleved-caspase-3、p-PI3K、p-Akt和Bcl-2一抗(1∶300),4℃孵育12h。TBST洗膜,加入HRP标记IgG二抗(1∶5000),37℃孵育2h。TBST洗膜,加入ECL发光液,避光显影,凝胶成像系统自动显影,扫描Bax、p-NF-κBp65和cleved-caspase-3、p-PI3K、p-Akt和Bcl-2蛋白条带灰度值,以β-actin为内参,各蛋白相对表达水平=目的蛋白灰度值/β-actin灰度值。
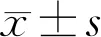
2结果
2.1各组大鼠HE染色结果各组大鼠视网膜总厚度、外核层和内核层厚度比较,差异有统计学意义(F=175.879、12.668、19.387)。与空白对照组比较,模型组大鼠视网膜总厚度、外核层和内核层厚度均降低,差异有统计学意义(t=23.004、5.934、7.182,P<0.05)。与模型组比较,M-DHA组和H-DHA组大鼠视网膜总厚度、外核层和内核层厚度均升高,差异有统计学意义(tM-DHA组=13.427、3.099、4.349,tH-DHA组=19.733、5.050、5.985,P<0.05);L-DHA组大鼠视网膜总厚度升高,差异有统计学意义(t=7.381,P<0.05),外核层和内核层厚度升高,但差异无统计学意义(P>0.05,图1,表1)。
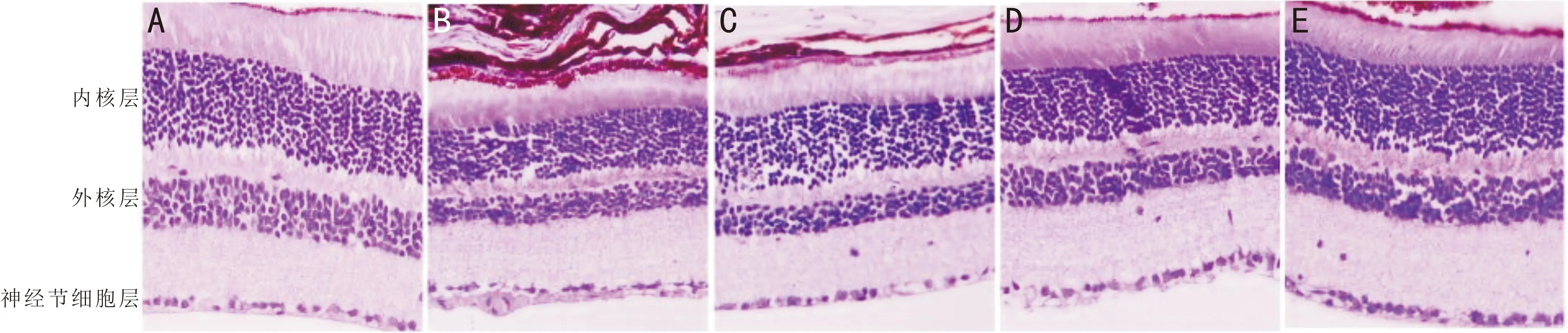
图1各组大鼠HE染色结果(×400)A:空白对照组;B:模型组;C:L-DHA组;D:M-DHA组;E:H-DHA组。

图2各组大鼠TUNEL染色结果(×400)A:空白对照组;B:模型组(黑色箭头所示为TUNEL阳性细胞);C:L-DHA组;D:M-DHA组;E:H-DHA组。

图3各组大鼠视网膜神经节细胞超微结构(×5000)A:空白对照组;B:模型组;C:L-DHA组;D:M-DHA组;E:H-DHA组。N:神经节细胞的细胞核;M:神经节细胞的线粒体;V:空泡。
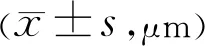

组别视网膜总厚度外核层内核层空白对照组167.25±5.2122.37±2.6143.16±3.15模型组110.23±3.14a15.37±1.24a31.24±2.57aL-DHA组124.35±3.57c16.43±1.2833.11±2.59M-DHA组139.43±4.35c18.62±2.25c37.82±2.67cH-DHA组158.34±5.11c21.05±2.46c40.61±2.87c
注:aP<0.05vs空白对照组;cP<0.05vs模型组。
2.2各组大鼠视网膜细胞凋亡情况如图2所示,TUNEL阳性细胞(黑色箭头)主要分布在神经节细胞层和视网膜外核层中。各组大鼠神经节细胞层和外核层细胞凋亡指数比较,差异有统计学意义(F=125.379、150.245,P<0.001)。与空白对照组比较,模型组大鼠神经节细胞层和外核层细胞凋亡指数升高,差异有统计学意义(t=20.579、19.833,P<0.05)。与模型组比较,M-DHA组和H-DHA组大鼠神经节细胞层和外核层细胞凋亡指数降低,差异有统计学意义(tM-DHA组=7.934、7.518,tH-DHA组=14.656、14.585,P<0.05);L-DHA组降低,但差异无统计学意义(P>0.05,图2,表2)。


组别神经节细胞层外核层空白对照组8.37±1.216.13±0.82模型组77.51±8.14a62.15±6.87aL-DHA组68.35±8.2356.43±6.12M-DHA组42.18±7.26c36.62±4.69cH-DHA组22.54±4.26c17.15±3.15c
注:aP<0.05vs空白对照组;cP<0.05vs模型组。
2.3各组大鼠透射电镜观察超微结构视网膜神经节细胞超微结构见图3。空白对照组视网膜神经节细胞具有均匀正常出现的细胞核和线粒体。模型组出现空泡化,染色质边缘化,染色质浓缩,线粒体肿胀和嵴缺失。DHA治疗后,空泡化、染色质边缘化、染色质浓缩以及线粒体肿胀的不同程度改善。H-DHA组线粒体和细胞核基本正常,与空白对照组较为相似。
2.4各组大鼠视网膜组织TNF-α和IL-6水平比较各组大鼠视网膜组织TNF-α和IL-6表达水平比较,差异有统计学意义(F=18.729、80.136,P<0.001)。与空白对照组比较,模型组大鼠视网膜组织TNF-α和IL-6表达水平均升高,差异有统计学意义(t=6.846、13.079,P<0.05)。与模型组比较,M-DHA组和H-DHA组大鼠视网膜组织TNF-α和IL-6表达水平均降低,差异有统计学意义(tM-DHA组=4.132、6.828,tH-DHA组=5.824、11.965,P<0.05);L-DHA组降低,但差异无统计学意义(P>0.05,表3)。
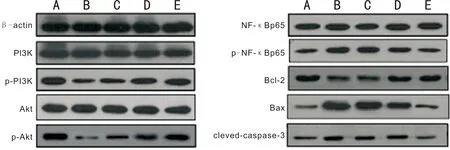
图4各组大鼠视网膜组织相关蛋白条带A:空白对照组;B:模型组;C:L-DHA组;D:M-DHA组;E:H-DHA组。


组别TNF-αIL-6空白对照组1.21±0.343.42±0.28模型组2.97±0.53a7.15±0.64aL-DHA组2.58±0.476.73±0.53M-DHA组1.87±0.38c4.92±0.48cH-DHA组1.46±0.35c3.61±0.34c
注:aP<0.05vs空白对照组;cP<0.05vs模型组。
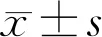

组别p-PI3K/PI3Kp-Akt/AktBaxBcl-2p-NF-κBp65/NF-κBp65cleved-caspase-3空白对照组0.59±0.030.55±0.030.07±0.010.49±0.030.13±0.010.11±0.01模型组0.13±0.01a0.07±0.01a0.59±0.03a0.22±0.02a0.38±0.02a0.19±0.01aL-DHA组0.22±0.020.11±0.010.56±0.020.23±0.010.34±0.020.18±0.02M-DHA组0.39±0.02c0.26±0.02c0.32±0.02c0.29±0.02c0.26±0.03c0.16±0.03cH-DHA组0.48±0.03c0.39±0.02c0.12±0.01c0.35±0.030.15±0.02c0.13±0.02c
注:aP<0.05vs空白对照组;cP<0.05vs模型组。
2.5各组大鼠视网膜组织相关蛋白表达各组大鼠视网膜组织Bax、p-NF-κBp65和cleved-caspase-3、p-PI3K、p-Akt和Bcl-2蛋白比较,差异有统计学意义(F=916.895、168.682、17.842、390.788、624.947、76.125,P<0.01)。与空白对照组比较,模型组大鼠视网膜组织Bax、p-NF-κBp65和cleved-caspase-3蛋白表达升高,差异有统计学意义(t=40.279、27.386、 13.856,P<0.05);p-PI3K、p-Akt和Bcl-2蛋白表达降低,差异有统计学意义(t=35.631、37.181、18.343,P<0.05)。与模型组比较,M-DHA组和H-DHA组大鼠视网膜组织Bax、p-NF-κBp65和cleved-caspase-3蛋白表达降低,差异有统计学意义(tM-DHA组=18.343、8.152、2.324,tH-DHA组=36.406、19.919、6.573,P<0.05);p-PI3K、p-Akt和Bcl-2蛋白表达升高,差异有统计学意义(tM-DHA组=28.482、20.813、3.184,tH-DHA组=27.111、35.054、8.832,P<0.05,图4,表4)。
3讨论
ARMD是一种眼科常见的视网膜黄斑退行性病变,由年龄、饮食、环境等多种因素引起的综合病症,对患者视力造成严重损伤[10]。目前,ARMD的发病机制尚不十分明确,但其病理已经证实与患者视网膜光感受器细胞的凋亡有密切关系。因此,开发新的能够抑制光感受器细胞凋亡的药物,延缓病情,减轻患者痛苦具有十分重要的意义。
DHA是人体必须的高度不饱和脂肪酸,不能由自身合成,主要从食物中获取。DHA作用广泛,具有抗神经炎症、抗氧化等功能,对帕金森、老年痴呆、黄斑变性等疾病有一定的预防作用。有报道称,与不含DHA藻油的大豆调和油饲养的大鼠相比,含DHA藻油的大豆调和油饲喂的SD大鼠视网膜组织细胞层次更为清楚,细胞生长正常并且排列紧密,杆状细胞、锥状细胞清晰可见,说明DHA有益于视网膜组织细胞的生长发育[11]。艾明等[12]研究表明,DHA可抑制N-甲基-N-亚硝脲(MNU)对视网膜光感受器细胞超微结构的损伤,具有较好的保护作用,是一种潜在延缓视网膜色素变性病程进展的有效药物。本研究结果显示,模型组大鼠视网膜总厚度、外核层和内核层厚度较空白对照组降低,视网膜神经节细胞层和外核层细胞凋亡指数升高,神经节细胞出现空泡化,染色质边缘化,染色质浓缩,线粒体肿胀和嵴缺失现象,提示模型组大鼠视网膜光感受异常,细胞凋亡。经DHA治疗后,可明显改善视网膜神经节细胞染色质边缘化和浓缩、线粒体肿胀等现象,增加视网膜总厚度、外核层和内核层厚度,以及降低视网膜神经节细胞层和外核层细胞凋亡指数,随着给药剂量的增加,视网膜神经节细胞逐渐得到恢复,具有剂量依赖性,与相关研究报道结果一致,提示DHA可保护ARMD大鼠光感受器细胞凋亡,可能是潜在治疗ARMD疾病的药物。
为了了解DHA保护ARMD大鼠光感受器细胞凋亡的作用机制,本研究基于PI3K/Akt信号通路进行了简单探讨。本研究结果显示,与空白对照组比,模型组大鼠视网膜组织p-PI3K和p-Akt蛋白表达水平降低,PI3K是一种可使肌醇环第3位羟基磷酸化的磷脂酰肌醇激酶,Akt是PI3K的下游作用靶点。PI3K被激活后生成的磷脂产物进一步激活Akt及其下游信号级联反应,参与细胞的生长和发育、抗凋亡等过程。近年来研究发现,PI3K/Akt信号通路与眼部疾病关系密切[13], 陈春丽等[14]发现上调ARMD视网膜色素上皮细胞PI3K/Akt信号通路,可降低细胞氧化应激损伤,发挥细胞保护作用。结合文献本研究结果提示PI3K/Akt信号通路可能参与ARMD的发生。本研究发现玻璃体注射DHA后,p-PI3K和p-Akt蛋白水平升高,随着注射剂量的升高,p-PI3K和p-Akt蛋白水平逐渐升高。玻璃体内注射DHA可减轻NaIO3诱导的ARMD大鼠模型的感光细胞损伤[7]。DHA抑制PI3K活性,进而降低非小细胞肺癌(NSCLC)细胞活力,诱导细胞凋亡[15]。基于此,本研究推测DHA可能通过激活PI3K/Akt信号通路,促进p-PI3K和p-Akt蛋白表达,DHA可能也通过PI3K/Akt信号通路缓解视网膜组织损伤,进而发挥对ARMD的保护作用。本研究结果显示,模型组大鼠视网膜组织Bax、p-NF-κBp65和cleved-caspase-3蛋白、炎性因子TNF-α和IL-6表达升高,p-PI3K、p-Akt和Bcl-2蛋白表达降低;研究表明PI3K/Akt信号通路可促进Bcl-2蛋白表达,抑制Bax蛋白表达,抑制细胞凋亡[16];Dilly等[17]研究发现,激活PI3K/Akt信号通路能够活化NF-κB上调TNF-α、IL-6等炎性因子的表达;仇志富等[18]研究发现,PI3K/Akt信号通路可抑制caspase-9磷酸化,降低caspase-3表达,降低细胞凋亡。以往研究证实,激活PI3K/Akt信号通路,可增强Bcl-2表达,下调Bax表达,促进慢性高眼压SD大鼠初级视皮质神经元损伤的修复,改善神经元细胞超微结构以及降低眼压[19]。基于以上研究推测ARMD大鼠视网膜组织损伤后下调PI3K/Akt信号通路,进而激活caspase-3通路,造成ARMD大鼠光感受器细胞凋亡。本研究结果显示,经DHA干预后视网膜组织Bax、p-NF-κBp65和cleved-caspase-3蛋白表达及炎性因子TNF-α和IL-6表达均降低,具有剂量依赖性。研究发现DHA可能通过Nrf2途径诱导视网膜色素上皮细胞表达HO-1,降低视网膜色素上皮细胞凋亡,从而发挥对视网膜色素上皮细胞的保护作用[5]。推测DHA可能通过上调PI3K/Akt信号通路降低ARMD大鼠光感受器细胞凋亡,进而发挥对ARMD的保护作用。
综上所述,DHA可降低ARMD大鼠光感受器的细胞凋亡,其可能通过激活PI3K/Akt信号通路,上调p-PI3K和p-Akt蛋白表达,进而抑制下游凋亡相关蛋白表达,从而发挥抗凋亡作用的,是治疗ARMD的潜在药物。本研究也存在一些不足,ARMD机制较复杂,DHA是否通过其它途径发挥保护作用,还有待后续深入研究。

