高油酸花生遗传选育的研究进展
吕建伟, 胡廷会, 成良强, 饶庆琳, 王 军
(贵州省农业科学院 油料研究所, 贵州 贵阳 550006)
花生(ArachishypogaeaL.)脂肪酸成分主要包括油酸、亚油酸、棕榈酸、硬脂酸、山嵛酸、花生酸、花生烯酸和二十四烷酸8种。其中,油酸(45%~48%)和亚油酸(32%~35%)的含量占脂肪酸组成的80%以上[1-3],二者都是有益脂肪酸。油酸能够降低人体血液中的低密度脂蛋白(LDL),保持高密度脂蛋白(HDL),减少心血管疾病的发生,对人体脂质代谢具有重要作用。与亚油酸相比,油酸的抗氧化能力强,高油酸花生(油酸含量80%、亚油酸2%左右)制品的货架保质期是普通花生(油酸45%、亚油酸35%)的3倍以上[4]。油酸和亚油酸含量的比值决定花生油的品质,高油酸花生有助于提升营养价值和保障其制品质量安全。鉴于高油酸花生的生产意义,近年来国内外育种工作者已将提高油酸含量列为花生遗传育种的主要目标之一。
当前,高油酸花生品种已在澳大利亚、阿根廷、美国、巴西、南非以及以色列等国家得到大规模推广种植[5]。近年来,国内育种单位在高油酸花生品种选育方面取得较大进展,相继育成冀花16、花育961、桂花37、开农176等近30个高油酸品种,有力推动我国普通油酸品种向高油酸品种的更新,为实现我国高油酸花生产业化提供材料支撑。借助当前分子辅助育种技术,制定合理的高油酸花生育种策略,是进一步提高高油酸育种效率的重要措施。因此,围绕高油酸花生不饱和脂肪酸的生物合成途径、高油酸性状的遗传机制、分子标记辅助育种技术以及育种策略等几个方面展开综述,旨在进一步深化高油酸花生育种实践,加快我国高油酸花生育种步伐。
1 花生油脂中不饱和脂肪酸的合成代谢途径
1.1 合成不饱和脂肪酸的重要酶类
花生油脂中的不饱和脂肪酸主要为油酸和亚油酸。甘油三酯(Triacylglycerol,TAG)是由1分子甘油与3分子长链脂肪酸酯化形成的脂肪分子,在成熟的油料种子脂肪中的含量约占97%,其脂肪酸种类和比例决定了脂肪酸组成。在TAG合成代谢的通路中,卵磷脂(Phosphatidylcholine,PC)是多不饱和脂肪酸合成的重要载体,90%以上的脂肪酸在PC上合成代谢。PC上酯化连接的油酸在脂肪酸去饱和酶(Fatty acid desaturase,FAD)催化下产生亚油酸,是油料种子中亚油酸合成的最重要途径。在植物不饱和脂肪酸合成代谢途径所涉及的FAD酶类中,酰基-ACP去饱和酶发挥了重要作用,其包括催化硬脂酸合成油酸的Δ9脂肪酸去饱和酶,以及催化油酸合成亚油酸的Δ12脂肪酸去饱和酶,而Δ12脂肪酸去饱和酶是直接决定花生脂肪酸中油酸、亚油酸含量的关键酶。
1.2 油酸、亚油酸的合成代谢途径
在多不饱和脂肪酸合成代谢途径中,卵磷脂(PC)上的亚油酸等多不饱和脂肪酸主要经2种途径被组装在TAG分子上。第1种途径是发生在酰基-CoA池和PC间的酰基编辑(Acyl editing)反应,经溶血卵磷脂酰基转移酶(Llysophosphatidylcholine acyltransferase,LPCAT)的酯化催化,完成油酰-CoA与PC的酰基化组装,再经FAD2和FAD3酶脱氢后形成不饱和脂肪酸卵磷脂(PUFA-PC),又在LPCAT酶的反向催化作用下PUFA-PC去酰基化,释放出的亚油酰-CoA(Polyunsaturated fatty acid CoA)进入酰基CoA池[6-7],最终亚油酰-CoA在二酰甘油酰基转移酶(Diacylglyceryl transferase,DGAT)的作用下组装在TAG上(图 1b、c);第2种途径是发生在二酰甘油和PC间的酯酰交换反应(图1c),主要在磷脂二酰甘油酰基转移酶(Phosphatidylglyceryl transferase,PDAT)、磷脂酰胆碱二酰甘油胆碱磷酸酶(Phosphatidylcholine diacylglycerol cholinephosphotransferase,PDCT)和肉碱酰基转移酶(Carnitine acyltransferase,CPT)等酶催化下的多不饱和脂肪酸掺入TAG的合成途径[8-12]。

图1油料作物种子甘油三酯的合成路径
Fig.1 Triglyceride synthesisi pathway in oil crop seed
2 花生高油酸性状的遗传基础
20世纪80年代,NORDEN等[13]检测发现高油酸花生种质F435,其油酸含量为80%、亚油酸含量为2%,与橄榄油中的油酸含量相当。高油酸花生种质F435在世界范围内都有育种利用,我国育成的高油酸花生品种也多数来源于该种质[14]。由于该自然突变种质在育种上的广泛应用,明晰其高油酸性状产生的遗传规律及其分子机制成为推进高油酸育种工作的关键。研究者将该突变体及其衍生材料作为研究对象开展了大量的研究工作,为高油酸花生品种选育奠定了理论基础[15-21]。
2.1 花生高油酸性状的遗传规律
在花生高油酸性状遗传研究中,研究者采用孟德尔经典分离分析方法和数量性状遗传模型分析方法,将普通油酸和高油酸品种进行杂交,统计分离世代的普通油酸、高油酸性状单株或株系的数量和分离比例,分析高油酸性状的遗传规律。研究者将F435与普通油酸品种的杂交分离世代开展油酸含量分析,证实花生高油酸性状受2对隐性基因控制[18,22-23],基因型命名为ol1ol1ol2ol2或aabb。丁锦平等[24]以亲本汕油162和SunOleic95R杂交得到的F2代遗传群体进行油亚比值(O/L值)分析发现,O/L值受2对加性-显性-上位性主基因控制;韩柱强等[25]利用高油酸亲本8-153和普通油酸亲本粤油13进行杂交,对2个亲本、F1、F2和F2:3的油酸、亚油酸进行多世代联合分析认为,花生油酸性状和亚油酸性状同时由2对主基因控制,其对油酸、亚油酸的作用效应相反,此外油酸含量还受其他微效基因的影响。BARKLEY等[5]利用高油酸和普通油酸花生种质配制了6个杂交组合,并分析了539个F2的脂肪酸成分和ahFAD2基因型,其中5个杂交组合F2的高油酸性状遗传由2对隐性基因(ol1ol1ol2ol2)控制,另1个杂交组合高油酸性状的遗传表现单基因(ol2ol2)遗传分离模式,在分子水平上分析解释了该组合普通油酸亲本含有与高油酸亲本相同的ol1ol1隐性基因位点,即由于ol1/FAD2A基因序列突变所致。
2.2 花生高油酸性状的分子机制
花生油酸到亚油酸的转化主要由ahFAD2A和ahFAD2B2对分别定位于A09和B09染色体上的同源非等位基因控制[26]。花生高油酸突变体F435的ahFAD2A和ahFAD2B基因序列在ORF区域具有99%的同源性,ahFAD2A基因的ORF-448 bp处发生G/A替换,编码的天冬氨酸转变为天冬酰胺,产生的FAD2A酶活性下降;ahFad2B基因的ORF-441_442 bp处发生A碱基插入导致移码突变,产生的FAD2B酶完全失活。F435的高油酸性状是由ahFAD2A和ahFAD2B两对同源非等位基因的共同突变产生[16-17],与F435类型的高油酸突变体不同,化学突变创制的M2-225和C458高油酸突变体的ahFAD2B基因功能丧失是由反向重复转座元件插入到ORF编码区导致[27]。总之,花生高油酸性状产生的分子机制与FAD2A和FAD2B基因的突变导致对应编码的酶失活或活性下降有关。
2.3 花生 ahFAD2基因的遗传效应
ahFAD2A和ahFAD2B2个非等位基因共包含9种基因型,其中aabb基因型花生的油酸含量最高[17],这些基因型按照突变位点数量分为0、1、2、3、4个5种类型。研究表明,随着个体的ahFAD2基因突变位点数量增多,油酸含量升高,亚油酸含量降低,突变位点数量相同(如AaBb、aaBB和AAbb)的则没有差异[5]。可见,ahFAD2A和ahFAD2B基因表现出一定的剂量效应。有研究发现,ahFAD2A对油酸和亚油酸的表型变异解释率分别为17.4%和19.5%,ahFAD2B的表型变异解释率分别为33.8%和41.0%,ahFAD2B的基因效应大于ahFAD2A的基因效应[19]。PANDEY等[26]在研究中同样发现FAD2B的表型变异解释分别为26.54%、25.59%和41.02%,FAD2A的表型变异解释分别为8.08%、6.86%和3.78%。BARKLEY等[5]还认为,ahFAD2A和ahFAD2B基因存在加性效应,协同调控花生种子油酸含量,2对基因具有不完全显性,子代油酸含量受亲本表型影响,其他微效修饰基因也参与了油酸的合成代谢。
花生ahFAD2基因还与其他脂肪酸具有一定相关性。研究表明,油酸与亚油酸、硬脂酸、花生酸的含量呈显著负相关,其中,与亚油酸相关性最高(相关性系数R=-0.701,P<0.0001)[21]。ahFAD2A和ahFAD2B基因型与油酸、亚油酸、棕榈酸和油亚比(O/L)含量显著相关,具有遗传多效性[5,22,28]。
3 常用花生高油酸分子辅助选择技术
在作物育种过程中,常规育种方法存在育种周期长、育种群体庞大且选择低效等问题,为选择出含有目标性状的优异品系,需投入大量人力、物力。随着生命科学技术的进步,分子辅助选择技术(Marker assisted selection,MAS)已在作物育种上得到应用,其可快速、准确地将含有目标性状和目的基因的个体从杂交子代中选择出来。在花生高油酸育种中,根据ahFAD2A、ahFAD2B编码区及突变位点(ahFAD2A448G>A、ahFAD2B441_442insA)信息开发出了一系列MAS检测技术,包括酶切扩增多态性(Cleaved amplified polymorphisms,CAPS)[29-30]、qRT-PCR分型检测[31-32]、PCR产物直接测序及位点特异性PCR(AS-PCR)[33-35]等技术。MAS技术能够精准地将ahFAD2(a_b_)基因型的单株从F2或F3早期分离世代群体中筛选出来,去除未携带目标基因位点的单株,可缩小群体数量,提高育种效率4~16倍[36],育种周期可缩短3年左右。
3.1 CAPS分型检测技术
酶切扩增多态性(Cleaved amplified polymorphisms,CAPS)技术利用限制性内切酶(如Hpy99I、DdeⅠ等)识别、酶切ahFAD2A/ahFAD2B基因448 bp处的 G>A和442 insA SNP位点,使酶切产物片段呈现大小不同的多态性,以此为判断依据对FAD2A/FAD2B基因分型[23,29]。根据ahFAD2A基因的上游5′UTR区和编码区设计特异引物,上游引物序列为5′- GATTACTGATTATTGACTT-3′,含有19 bp特异序列,下游引物5′-CCAACCCAAACCTTTCAGAG-3′。经PCR扩增,目的产物条带大小826 bp,纯化后利用能够识别CGACG序列的限制性内切酶Hpy99I酶切,识别位点序列的碱基G是ahFAD2A基因序列448 bp处的G碱基,因而只有野生型的ahFAD2A基因扩增片段才能够被酶切为598 bp和228 bp的产物,而纯合隐性突变型的扩增片段则不能发生酶切(图2)。

图2 利用 CAPS鉴定花生核心种质 ahFAD2A的基因型
Fig.2 GenotypingahFAD2Aof peanut core collection employing CAPS technology
3.2 AS-PCR分型检测技术
等位基因特异性PCR(allele-specific PCR)分型检测技术基于SNP位点设计特异引物,通过PCR扩增、电泳,根据电泳结果的有无判断目的基因的基因型。CHEN等[33]最先设计出花生FAD2基因的AS-PCR分型检测方法,但其方法不能准确分辨出AaBB和aaBB或AABb和AAbb的基因类型。YU等[34]根据ahFAD2A(448G>A)/ahFAD2B(441_442insA)突变碱基的差异共设计7条AS-PCR引物(表1),通过将1个错配碱基置于其中4条引物的3’端的第二或第三位以确保检测的特异性。经4个PCR反应来检测ahFAD2A/ahFAD2B的突变型或野生型以及通过琼脂糖凝胶电泳条带大小来判断各位点的杂合或纯合性,按照图22〗3所示的4个PCR反应进行。其中,反应Ⅰ、Ⅱ、Ⅲ、Ⅳ分别鉴定ahFAD2A/ahFAD2B的野生型(A)、突变型(a)、野生型(B)、突变型(b)位点,反应Ⅰ、Ⅱ和反应Ⅲ、Ⅳ分别能够双向验证ahFAD2A/ahFAD2B的纯合性。在PCR反应中,每个反应体系需要加入3条引物,其他反应条件与常规PCR相同。
根据电泳结果,当反应Ⅰ中出现2条带,则ahFAD2A含有野生型A,出现1条带,则ahFAD2A不含有野生型A;当反应Ⅱ中出现2条带时,则ahFAD2A含有突变型a,出现1条带,则ahFAD2A不含有突变型a;同样,反应Ⅲ中出现2条带,则ahFAD2B含有野生型位点B,出现1条带,则不含有野生型位点B;反应Ⅳ出现2条带,则ahFAD2B含有突变型位点b,出现1条带,则ahFAD2B不含有突变型位点b。如图4所示,泳道1~9代表9种基因型。其中,泳道1表示野生纯合基因型(AABB),泳道2表示AABb,泳道3表示AAbb,泳道4表示AaBB,泳道5表示AaBb,泳道6表示Aabb,泳道7表示aaBB,泳道8表示aaBb,泳道9表示aabb。该技术通过4次PCR反应,可快速、有效地将9种基因型分辨出来。
表1ahFAD2A/ahFAD2BAS-PCR引物序列信息
Table 1 AS-PCR primer information ofahFAD2A/ahFAD2B

引物名称Primer引物序列Sequence (5' to 3') FAD2A-F GATTACTGATTATTGACTTGCTTTG FAD2A-G GTTTTGGGACAAACACTTCTTC FAD2A-A GTTTTGGGACAAACACTTCTTT FAD2B-F CAGAACCATTAGCTTTGTAGTAGTG FAD2B-C AACACTTCGTCGCGGTTG FAD2B-A AACACTTCGTCGCGGTTT FAD2-R CTCTGACTATGCATCAGAACTTGT
注:引物序列中下划线标注指错配碱基。
Note: Mismatched bases were underlined in some primer sequences.
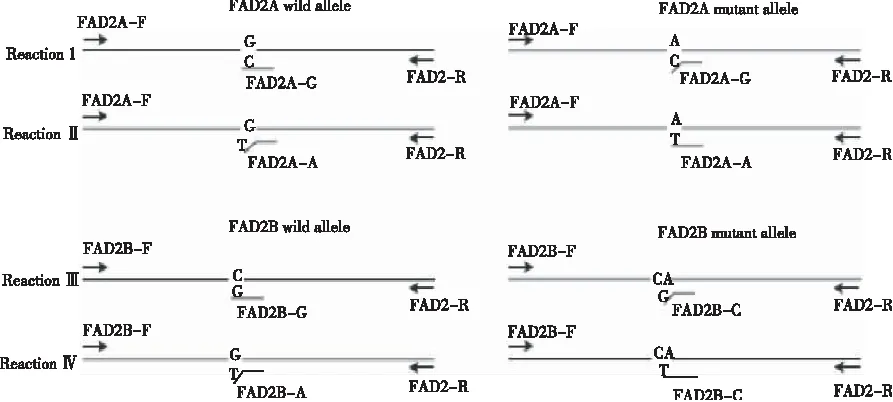
图3 FAD2 基因分型的4个 AS-PCR反应

图4 AS-PCR产物电泳检测 ahFAD2A/ahFAD2B的基因型
Fig.4 Electrophoresis detection of AS-PCR products for genotypingahFAD2/ahFAD2B
3.3 Real-time PCR分型检测技术
通过在ahFAD2A和ahFAD2B突变位点上各设计突变型探针和野生型探针,在两端保守区域设计引物进行qRT-PCR反应,然后根据荧光信号分辨其基因型[31-32,37]。根据ahFAD2A和ahFAD2B的基因序列及其突变位点设计了引物,以及与各个基因对应的突变型6-FAM和野生型VIC荧光基团探针(表2),通过实时荧光定量PCR技术,分别用于检测ahFAD2A和ahFAD2B的基因型,利用该方法可检测所有的9种基因型。

表2 荧光定量 PCR技术的引物和探针信息
3.4 KASP分型检测技术
KASP(Kompetitive Allele Specific PCR,KASP)是一种独特的竞争性位点特异PCR,基于双荧光共振能量转移技术原理对SNP位点检测分型[38-40]。ZHAO等[41]根据ahFAD2A和ahFAD2B的SNP位点信息,利用KASP技术原理将突变型等位基因引物序列ahFAD2A-Allele-l或ahFAD2B-Allele-l的5’端连接带有FAM荧光染料的Allele-l Tail引物,同样在野生型等位基因引物序列ahFAD2A-Allele-2或ahFAD2B-Allele-2的5’端连接带有HEX荧光染料的Allele-l Tail引物(表3)。当引物与ahFAD2A或ahFAD2B序列结合,荧光染料与淬灭基团分离,产生荧光信号。不同的基因型产生不同的荧光信号,从而完成基因分型。两条common引物存在碱基序列差异,可将ahFAD2A和ahFAD2B区分开,因此一个反应能够同时完成ahFAD2A和ahFAD2B的基因分型。
表3ahFAD2A和ahFAD2B基因分型的 KASP引物信息
Table 3 Information of KASP primer sequences for genotypingahFAD2AandahFAD2B

引物Primer序列Sequence(5′ to 3′)AhFAD2A-Allele-lGTTTTGGGACAAACACTTCGTTAhFAD2A-Allele-2GTTTTGGGACAAACACTTCGTCAhFAD2A-commonCGCCACCACTCCAACACCAhFAD2B-Allele-lCAAACACTTCGTCGCGGTCTAhFAD2B-Allele-2CAAACACTTCGTCGCGGTCGAhFAD2B-commonCCGCCACCACTCCAACACAAllele-l Tail (FAM tail)GAAGGTGACCAAGTTCATGCTAllele-2 Tail (HEX tail)GAAGGTCGGAGTCAACGGATT
注:下划线标识碱基为ahFAD2A和ahFAD2B野生型和突变型的SNP位点。
Note:SNP loci was marked with bold type and underlines both in wild and mutant types.
KASP技术方法中的荧光染料较qRT-PCR的Taqman探针的成本低,该技术还具有高通量、高度特异性和高度灵敏性等优点,因此被广泛应用于水稻[42]、小麦叶片锈病抗性[43]、柑橘[44-45]、大豆线虫抗性[46-47]、苹果抗病性[48]等作物的SNP检测分型。
3.5 PCR产物测序法
该方法是最直接、最准确检测亲本、杂交F1、BC1F1~BC4F1基因型的方法。亲本基因型的鉴定需要2次PCR反应,利用引物对FAD2A-F/FAD2A-R进行单个PCR扩增亲本的ahFAD2A基因片段,引物对FAD2B-F/FAD2B-R扩增亲本的ahFAD2B基因片段(表4)。利用Internal1和Internal2测序引物对基因扩增片段进行双向测序,根据突变型ahFAD2A在448 bp处G>A碱基和突变型ahFAD2B在442 bp处insA的SNP信息,读取该序列位置的测序峰图,判断亲本基因型[49]。

表4 花生 ahFAD2A和 ahFAD2B的PCR 产物测序的引物信息
3.6 技术评价
由于ahFAD2A/ahFAD2a、ahFAD2B/ahFAD2b均只存在1个碱基的差别,应用AS-PCR、荧光定量PCR和KASP技术进行PCR扩增时,无法避免假阳性结果[33],且利用AS-PCR、CAPS以及荧光定量PCR等技术对每份花生样品的检测需要至少2次PCR反应,检测程序繁琐。此外,CAPS检测技术涉及酶切,对DNA质量要求高[29],且不能将纯合野生型的AA和杂合基因型的Aa区分,只能用于检测亲本或种质资源等纯合基因型材料。荧光定量PCR检测技术应用的特异性荧光探针成本高[31-32],具有一定假阳性率。与以上技术方法相比,KASP检测方法具有高通量检测特点,适用于检测分离世代中的成百上千个单株,同时结合其他检测方法剔除假阳性单株。此外,利用F0.7/R3引物对进行一次PCR扩增和测序就能够准确检测ahFAD2A和ahFAD2B基因型,较以往报道的测序方法更加准确、高效。
3.7 分子辅助选择技术应用
随着花生高油酸性状分子遗传机制的解析,基因分型技术日趋成熟,在花生高油酸育种上得到了广泛应用[50-51]。NAWADE等[28]利用AS-PCR技术和CAPS技术检测印度174份花生种质的油酸基因型,80份花生种质在ahFAD2A位点的448bp处发生G>A碱基替换。李丽等[52]利用单粒近红外光谱技术(Near infrared reflectance spectroscopy,NIRS)和气相色谱(Gas chromatographic,GC)对F2:3家系和F4种子进行初步筛选,将筛选到的高油酸材料进行AS-PCR鉴定,得到纯合高油酸材料4个,其油酸含量介于81.1%~82.7%。JANILA等[53]利用标记辅助回交和标记辅助选择方法将SunOleic 95R高油酸材料的ahFAD2突变位点渗入到ICGV06110、ICGV06142和ICGV06420中,利用AS-PCR技术筛选出469份油酸含量在62%~83%的后代材料,较轮回亲本提高50%~110%,亚油酸含量降低40%~100%,棕榈酸含量降低10%~60%。WANG等[54]以美国花生微核心种质为研究材料,利用SNP功能标记进行荧光定量PCR,检测ahFAD2A/ahFAD2B基因分型及分布情况,发现ahFAD2B基因未发生突变,所有的102份种质均为野生型;ahFAD2A存在3种基因型,其中58份种质为野生型,2份种质为杂合突变型,42份种质为纯隐性突变型。可见,在花生高油酸育种工作中综合利用分子标记辅助选择技术和高油酸鉴定方法,可准确、高效地从育种后代群体中选择出带有高油酸性状的目标材料。
4 高油酸花生育种策略
培育高油酸花生新品种的常用技术方法是回交育种,一般以轮回亲本作为母本,高油酸供体亲本和BCnF1作为父本。该方法具有以下几方面的优点:一是采用回交法,2年可实现4~5次回交,育种后代的绝大部分细胞核遗传物质来自轮回亲本,可在短时间内稳定;二是在回交过程中,以轮回亲本(AABB)做母本,如去雄不彻底则会产生单一基因型的假杂种(AABB),易于与真杂种(AaBb)区分;三是轮回亲本作母本有利于将受细胞质遗传控制的优异性状传递给育种后代,如花生的青枯病抗性;四是以BCnF1作父本提供花粉,同时对其自交产生的F2、BCnF2种子进行系谱育种,从分离世代筛选高油酸单株。
通过连续杂交和回交,在此过程中利用分子标记辅助选择技术对F1和BCnF1进行杂交种基因型鉴定,获得基因型为AaBb的种子。在自交分离世代,利用近红外线初步筛选出油酸含量达60%以上的F2和BCnF2的种子,缩小群体选择的范围后再利用KASP技术进行基因型检测,筛选出基因型为aabb的高油酸单株。下一季将收获的高油酸单株种子种植成株行,此时aabb基因型的高油酸性状能够稳定遗传,只需从株行中筛选兼具株高、分枝数、种皮颜色、抗病性、产量以及含油量等其他育种目标的单株,在下一季将每株行性状相近的中选单株混收种成株系,并继续选择形成品系参加区域联合鉴定试验。利用以上育种策略,每年开展2~3次杂交、回交,结合分子标记辅助选择技术和近红外线分析技术进行中间环节控制,可大大缩短育种进程[14,55-56]。

