肺浸润性黏液腺癌的CT及18F-FDG PET/CT表现
包盈莹,雷永霞,李新春,余煜栋,雷强,王宇泽
广州医科大学附属第一医院放射科,广东广州 510120;*通讯作者 李新春 xinchunli@163.com
肺浸润性黏液腺癌( invasive mucinous adenocarcinoma,IMA)是肺腺癌较少见的亚型,占肺腺癌的0.14%[1],既往称为黏液性细支气管肺泡癌,在2011年肺腺癌国际多学科分类中被独立分出[2]。IMA 的CT 表现多样,常导致误诊或漏诊。本研究通过分析149 例IMA 的临床、病理学及影像学特点,提高对本病的认识及诊断率。
1 资料与方法
1.1 研究对象 选取2012年1月—2017年5月于广州医科大学附属第一医院经病理证实为肺IMA 的149 例患者,其中男77 例,女72 例;年龄22~86 岁,平均(56±13)岁。临床表现:反复咳嗽、咳痰73 例,其中咳白色泡沫黏液痰31 例,痰中带血20 例;胸痛15 例;体检发现57 例。所有患者均无其他器官肿瘤史。本研究经广州医科大学附属第一医院伦理委员会批准。
1.2 病理获取方法及诊断标准 病灶经手术切除122 例,支气管纤维镜活检或经皮穿刺活检27 例。病理诊断采用2011年国际肺癌研究协会/美国胸科协会/欧洲呼吸学会标准。
1.3 检查方法 所有患者均行胸部螺旋CT 平扫,其中132 例患者行增强扫描,采用Toshiba Aquilion 16排螺旋CT 机或Siemens Definition 128 层螺旋CT 机,扫描参数:层厚0.75~2 mm,层间距2 mm,螺距1.0,管电压120 kV,管电流采用自动毫安秒。增强扫描采用高压注射器经肘前静脉注射60%非离子型碘对比剂1.5 ml/kg,注射速度3.0~3.5 ml/s,延迟20 s 及50 s 扫描。50 例行PET/CT 检查,使用GE Discovery ST PET/CT 扫描仪,静脉注射18F-FDG(5 MBq/kg),平卧60 min 后进行显像。
1.4 图像分析 由2 名具有5年及10年以上工作经验的放射诊断医师分析图像,包括病灶大小、数目、分布、形态、内部及边缘特征、CT 值及最大标准化摄取值(SUVmax)测量、有无肺门和纵隔淋巴结肿大。意见不一致时共同协商决定。
根据病灶形态将病灶分为结节型、实变型。CT值测量:选取病灶最大层面的实性成分进行测量,感兴趣区(ROI)>实性部分75%,避开空洞、钙化及血管影,测量3 次取平均值。于增强扫描实质期测量肿瘤强化CT 值,强化程度<20 Hu 定义为轻度强化,20 Hu≤强化程度<40 Hu 为中度强化,强化程度 ≥40 Hu 为明显强化。
对于经手术切除病例,根据其病理结果记录淋巴结转移情况。对于穿刺活检病例,根据CT 检查,将淋巴结短径>1 cm 或环形强化淋巴结定义为转移淋巴结,或根据PET/CT 检查,将SUVmax 增高的淋巴结设定为转移淋巴结。
1.5 统计学方法 采用SPSS 22.0 软件,计量资料以表示。用Kolmogorov-Smirnov 检验评价数据的正态分布,方差齐性检验用Levene 法。若数据符合正态分布,采用独立样本t检验比较结节型和实变型病灶增强扫描前后的CT 值,并分析病灶类型间、单发和多发之间、有或无淋巴结转移之间的SUVmax 是否存在差异;若不符合正态分布,则采用Mann-WhitneyU检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 CT 表现
2.1.1 病变大小、数量及分布 149 例IMA 患者中,结节型118 例(74.2%),其中单发103 例(87.3%),多发15 例(12.7%);周围型96 例(81.4%),中央型22 例(18.6%),病灶最大径0.8~9.3 cm,平均(3.52±2.03)cm。实变型31 例(20.8%),其中13 例(41.9%)呈肺段分布,4 例(12.9%)单叶分布,14 例(45.2%)两肺多发。
2.1.2 病灶密度特征 118 例结节型中,实性结节116 例(98.3%),混合磨玻璃结节2 例(1.7%);轻度强化60 例(57.7%),中度强化40 例(38.5%),明显强化4 例(3.8%)。实变型IMA 轻度强化22 例(78.6%),中度强化6 例(21.4%)。以上病灶平扫密度均低于同层面肌肉密度。结节型增强扫描后CT值与强化程度均高于实变型强化程度(P<0.05)(表1)。56 例病灶密度欠均匀,内见囊状低密度影。结节型及实变型IMA 内部及边缘特征见表2、3 及图1~5。
表1 不同类型IMA 的CT 值及SUV 值比较(±s)
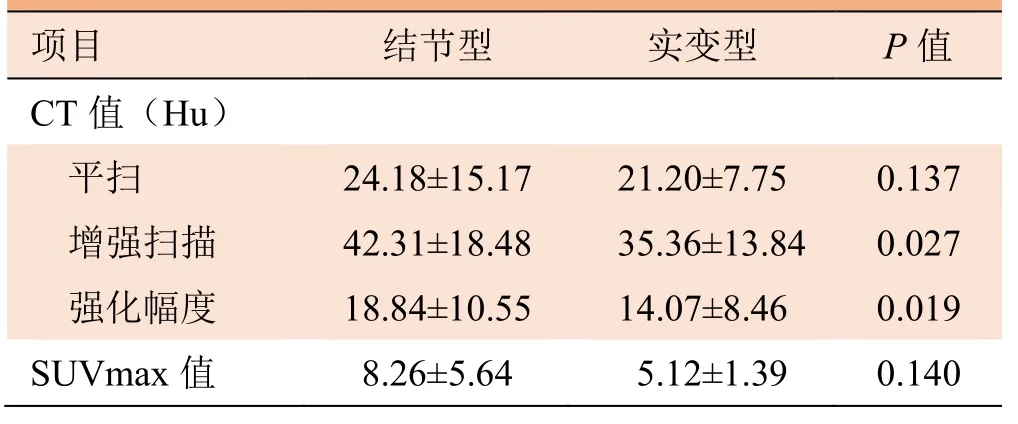
表1 不同类型IMA 的CT 值及SUV 值比较(±s)
项目 结节型 实变型 P 值 CT 值(Hu) 平扫 24.18±15.17 21.20±7.75 0.137 增强扫描 42.31±18.48 35.36±13.84 0.027 0.019 强化幅度 18.84±10.55 14.07±8.46 SUVmax 值 8.26±5.64 5.12±1.39 0.140
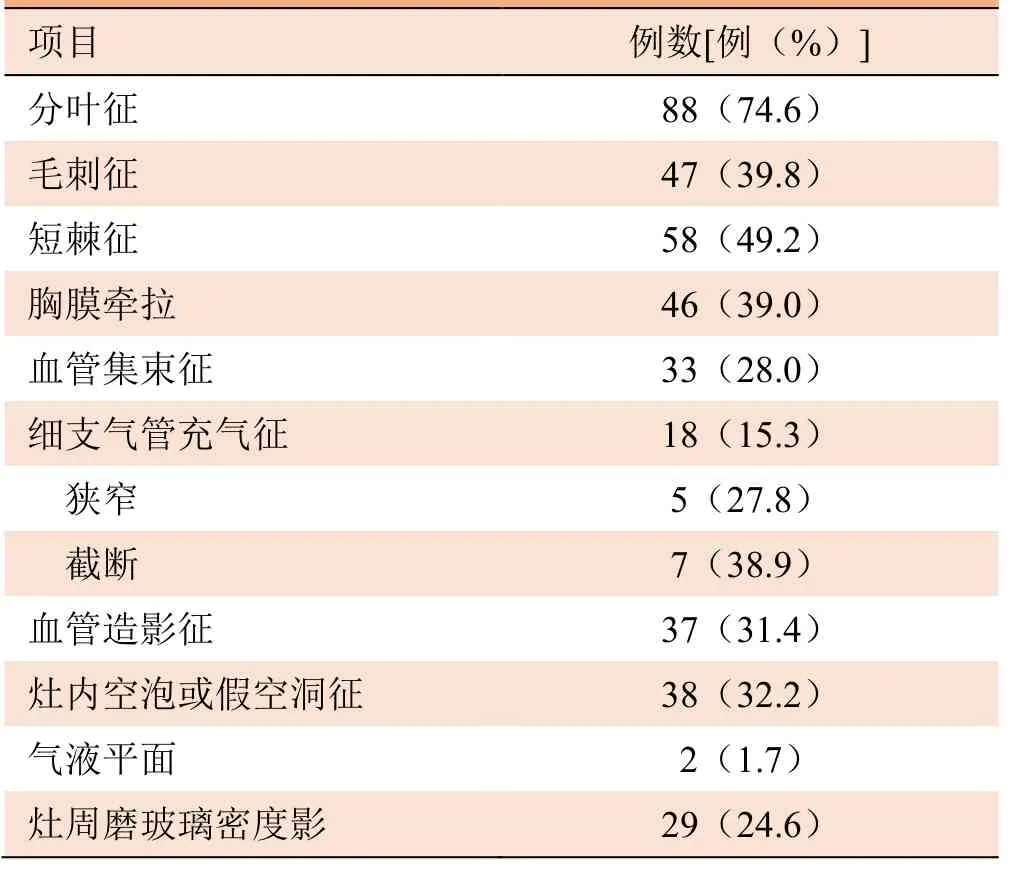
表2 118 例结节型肺IMA 内部及边缘CT 特征
2.2 PET/CT 表现 50 例行PET/CT 患者的SUVmax值为7.95±5.45,结节型及实变型IMA 平均SUVmax值分别为8.26±5.64、5.12±1.40,差异无统计学意义(P>0.05);发生淋巴结转移(n=19)的病灶SUVmax值明显高于无淋巴结转移(n=31)的病灶(10.98±6.12比6.09±4.07,P<0.01)。
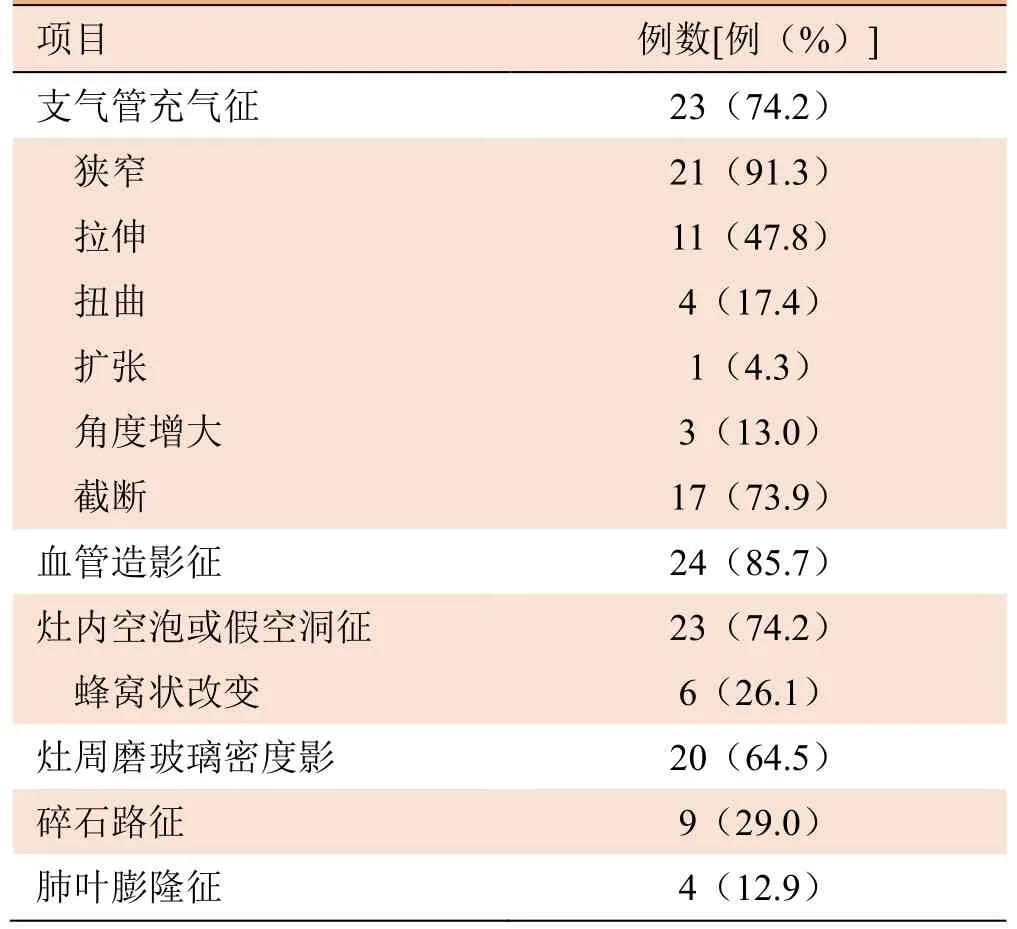
表3 31 例实变型肺IMA 内部及边缘CT 特征
2.3 误诊及延诊 118 例结节型IMA 病灶中,10 例误诊,分别误诊为真菌、结核、良性病变、肉芽肿性病变、炎性病变,31 例未明确诊断。31 例实变型IMA病灶中,5 例误诊为特殊感染,7 例误诊为肺炎,4 例误诊为间质性肺炎,5 例未明确诊断。
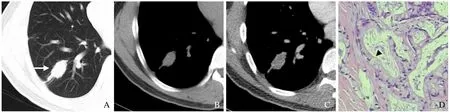
图1 男,39 岁,结节型IMA。
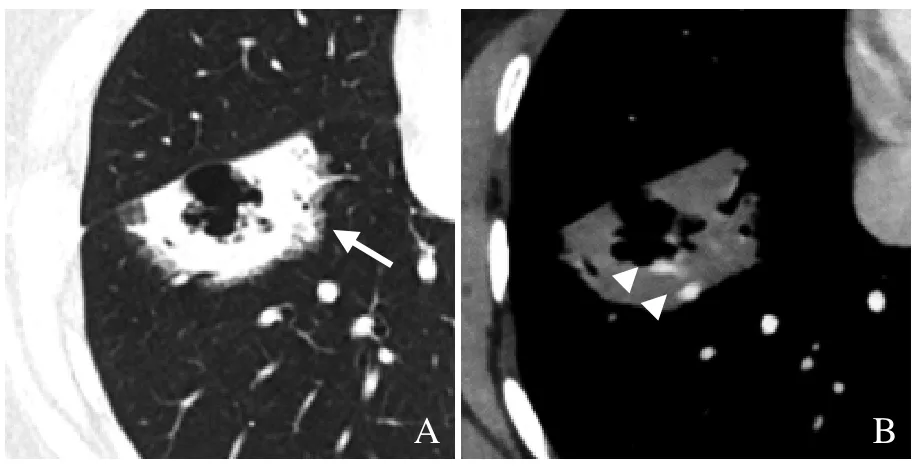
图2 女,35 岁,结节型IMA。
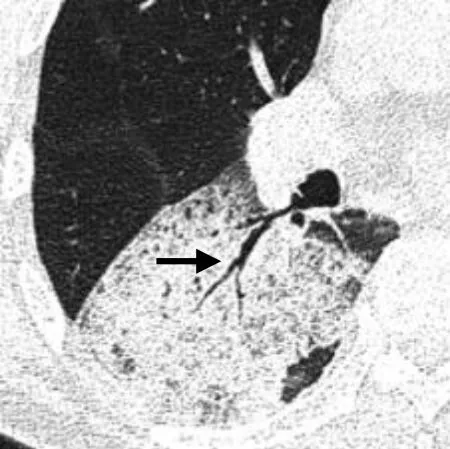
图3 男,64 岁,实变型IMA。
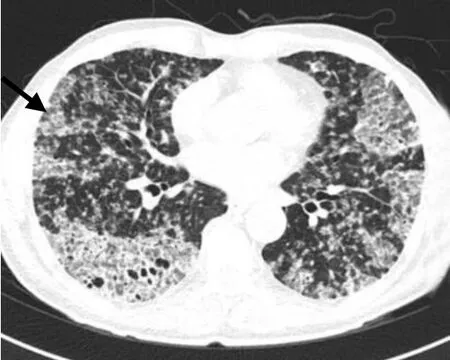
图4 男,74 岁,实变型IMA。
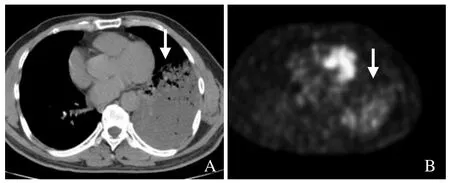
图5 男,65 岁,实变型IMA。
3 讨论
IMA 是肺内低度恶性肿瘤[3],多见于中老年患者,临床症状无特异性,不易早期发现。IMA 的影像学表现多样,结节型IMA 大多数表现为外周带的实性或部分实性、密度较低的结节或肿块。CT 表现包括分叶、毛刺、短棘征、胸膜牵拉征、血管集束征等一般腺癌的影像学特点,还可表现为细支气管充气征、空泡征或假空洞征、晕征等。实变型IMA 呈肺内大片状密度增高影,其内可见支气管充气征、空泡征或假空洞征、血管造影征,周围可伴有磨玻璃密度影、铺路石征、肺叶膨隆征及结节影。
本研究发现,74.2%的实变型及15.3%的结节型IMA 出现支气管充气征,这是由于肿瘤鳞屑样生长的特点,以肺泡壁作为生长基质,很少破坏肺部原本的组织结构,而保留了肿瘤内的支气管[4]。然而肿瘤浸润支气管壁,可使支气管变得狭窄、拉伸、僵直。本组实变型IMA 中,91.3%的支气管出现狭窄、僵直、粗细不均,17.4%的支气管走行纡曲,13%的支气管角度增大,而支气管扩张较少见,仅占4.3%,与Jung 等[5]的报道一致。结节型IMA 中38.9%的充气细支气管进入病灶后走行中断。IMA 内走行狭窄、扭曲或中断的支气管,可与肺炎或良性结节进行鉴别。
本研究中,74.2%的实变型及32.2%的结节型IMA可见空泡征或假空洞征,表现为实性病灶内小囊状透亮影,内壁光滑,而假空洞征的囊状透亮影内可见多发分隔影,形态不规则。这些囊状透亮影的病理学基础为近端气道堵塞形成单向活瓣,导致远端小气道或肺泡腔扩张[6];或者原来存在的囊腔未被破坏[7]。本组6 例实变型可见多发大小不等的囊状透亮影,呈蜂窝征改变。本组病例中仅2 例真性空洞,其内可见气液平面,与聂凯等[6]的报道一致。由于肿瘤非破坏性的生长方式,使病灶内部有足够的血流,故坏死较少见[4]。
灶周磨玻璃密度影的病理基础为黏液溢出或巨噬细胞聚集到肺泡腔内,或正常肺泡上皮被肿瘤组织替代,肺泡腔未完全闭塞[8-9]。Sawada 等[10]研究认为病理上黏液溢出是边缘模糊的,因此影像学上磨玻璃密度影也是边界不清的。而部分病例分界清晰是由于肺小叶边缘的小叶间隔阻挡病灶扩散所致[11]。本组病例中48.3%的结节型IMA 和60.0%的实变型IMA 磨玻璃影与肺野交界面分界清晰。
本组病例所有病灶均较同层面肌肉密度低,实变型IMA 增强扫描后CT 值与强化程度均低于结节型(P<0.05),推测是由于肿瘤细胞内外含有大量黏液,而黏液的密度较肿瘤密度低,导致病灶密度常较低且不均匀。王晓梅等[1]研究认为可能是因为实变型IMA黏液成分较多,细胞较松散,导致实性成分密度及增强程度减低,与本研究结果相符。
本组28.0%的结节型IMA 可见血管集束征,表现为病灶周围血管增粗并向病灶延伸,与王铮等[12]的研究结果一致,该研究认为肿瘤产生的血管生成因子可使病灶供血血管及新生毛细血管增粗、增生。本研究中85.7%的实变型IMA 和31.4%的结节型IMA 内见血管造影征,与Shimizu 等[13]的研究结果一致,表现为增强扫描时低密度病灶内可见强化血管走行,病理基础为肺泡腔内充满低密度黏液,增强扫描病灶强化程度较低,肿瘤鳞屑样生长的特点使血管保留下来,而未被破坏的血管强化程度较高,从而凸显出来。
本组结节型与实变型IMA 的SUVmax 差异无统计学意义,考虑与结节型SUVmax 标准差较大有关,Shimizu 等[13]研究认为结节型病灶的细胞成分及黏液成分含量相差较大,含细胞成分较多的病灶SUVmax较高,而含黏液成分较多者SUVmax 较小。本研究发现,发生淋巴结转移的IMA 放射性摄取明显高于无淋巴结转移者,提示IMA 放射性摄取与肿瘤的侵袭性相关。大多数文献报道IMA 的18F-FDG 摄取值较低[10,14-17],推测FDG PET 对评估含黏液的肿瘤价值有限;而本研究总体SUVmax 仍较高,考虑可能与病灶的黏液含量及浸润性有关。
与肺腺癌的其他亚型相比,IMA 的淋巴结转移或远处转移较少见,而肺内转移较常出现[13]。IMA 有显著的多中心、多肺叶及双侧肺浸润趋势,并可通过气道播散[18-19]。本组19 例患者可见两肺弥漫多发结节、实变、磨玻璃密度影,结节形态基本一致,主要沿小叶中心或支气管中心分布,Akira 等[20]从尸检中发现这些结节是由黏液或肿瘤细胞充满肺泡腔并包绕充气细支气管或支气管形成的。
总之,IMA 的CT 及PET/CT 表现有一定的特征 性,病灶密度及强化程度均较低,易发生肺内转移。结节型IMA 除一般腺癌特征外,还可见空泡征、细支气管充气征、晕征;实变型IMA 可见病理性支气管征、肺叶膨隆征、血管造影征、碎石路征等;病灶SUVmax 对判断淋巴结转移有重要意义。

