pEGFP-N1-IL-17通过调控Fas/FasL信号通路影响喉癌Hep-2细胞的凋亡
张红健,宋 杨,杨 明,季加标,杨见明
头颈部有一种发病率较高的肿瘤,以鳞状细胞癌为主,就是喉癌[1]。喉癌在临床治疗上主要以手术或者手术联合放化疗方式,会不同程度地影响患者的喉功能和生活质量都会大大下降。所以必须研究更多的像免疫治疗这类的方法来治疗喉癌[2]。白介素-17(IL-17)是CD4+T Th17等细胞分泌的一种细胞因子[3]。IL-17的相关研究主要集中在肿瘤疾病方面[4]。还有研究[5]显示Lewis肺癌荷瘤小鼠的MDSCs细胞的凋亡也是可以被IL-17抑制的。也有研究[6]表明Fas 又称 Apo-1 或 CD95 分子,属于肿瘤坏死因子受体家族类,为 Fas 配体( FasL)的受体,Fas与FasL的结合,促进细胞凋亡[7]。有相关研究[8-9]显示喉癌组织中Fas和FasL的表达是下降的,说明存在某些细胞因子阻断Fas介导的凋亡途径。研究[6]表明,IL-17可以通过IL-6/IL-6R/JAK1/STAT3通路来调控Hep-2细胞的侵袭和转移。
1 材料与方法
1.1 细胞培养喉癌细胞(Hep-2细胞)购自南京凯基生物科技发展有限公司。细胞培养基(DMEM+青霉素+链霉素+10%胎牛血清),用5%的CO2细胞培养箱在37 ℃条件下培养。Opti-MEM(×1)和Lipofectamine 2000均购于美国Life Technology公司。
1.2 试剂Opti-MEM培养基、TRIzol Reagent购于美国Invitrogen公司;血清购自美国Hyclone公司;总RNA提取试剂盒购于德国Qiagen公司。pEGFP-N1-IL-17购于武汉金凯瑞生物工程有限公司;胎牛血清购于浙江天杭生物科技股份有限公司;DMEM培养液购于美国HyClone公司;抗PI3K单克隆抗体和抗p-PI3K抗体均购于美国Abcam公司。抗FasL抗体和抗Fas抗体均购于美国CST公司;Cleaved-Caspase3、Cleaved-Caspase8抗体均购于美国Immunoway公司;抗β-actin 抗体购于北京中杉金桥生物技术有限公司;山羊抗兔二抗和山羊抗鼠二抗均购于美国ABclonal公司;Annexin V-FITC/PI凋亡检测试剂盒购于美国BD公司;蛋白 Marker、ECL荧光剂(显影剂)胰酶、5×SDS-PAGE蛋白上样缓冲液、一抗稀释液、二抗稀释液、SDS-PAGE凝胶配制试剂盒、BCA法蛋白浓度检测试剂盒均购于上海碧云天生物有限公司;逆转录试剂盒PrimeScriptTMRT Master Mix购自北京TaKaRa Clontech公司;扩增引物购自上海生工生物工程股份有限公司;荧光染料Maxima SYBR Green/ROX qPCR购自美国Thermo公司。
1.3 仪器超净工作台(型号:SW-9800)购于苏州泰安空气技术有限公司。恒温细胞培养箱(型号:NAPCO-8800)购于美国SHELLAB公司;CytoFLEX流式细胞仪(Tanon)购自美国BECKMAN COULTER公司;Western blot 电泳仪购于上海天能科技有限公司;逆转录反应仪器购自美国ABI公司;Mastercycle epgradient Eppendorf PCR 扩增仪购自德国Eppendorf公司。
1.4 qRT-PCR法检测重组质粒IL-17(pEGFP-N1-IL-17)转染喉癌Hep-2细胞后IL-17的表达收集转染的细胞加1 ml TRIzol试剂,提取总RNA。(提取六孔板每个孔中RNA,加水配到8 μl):在37 ℃温度条件下进行逆转录反应15 min。每组有3个复孔。反应条件:95 ℃、20 s预变性,循环内95 ℃、10 s变性,60 ℃退火20 s,70 ℃延伸10 s,共设置40个循环,然后设置(95 ℃、15 s,60 ℃、30 s,95 ℃、15 s)反应步骤。扩增完成之后采用ΔCt法分析定量结果。
1.5 IL-17过表达重组质粒的构建与鉴定结构序列设计合成2对引物:第1对引物位于IL-17cDNA的起始密码和终止密码前后端,两侧分别含AgeI酶切位点,用于PCR钓取扩增目的基因:正义链5′-CGCTGATGGGAACGTGGACTAC-3′和反义链5′-GGTGGACAATCGGGGTGACA-3′。第2对引物根据目的基因及载体本身序列设计,用于鉴定IL-17定向连接的阳性克隆菌落以及测序,通过PCR扩增获得目的基因IL-17cDNA片段,纯化后经Age I酶切消化。用Age I酶酶切载体质粒、回收线性载体片段。用T4噬菌体DNA连接酶将IL-17线性化载体连接,再转化、涂板、挑取克隆、扩增,试剂盒提取质粒,酶切,最后用PCR凝胶电泳鉴定,再测定序列。通过运用PCR法,从质粒中将人IL-17cDNA扩增,并将其成功插入pEGFP-N1载体中,经过测序和验证之后,pEGFP-N1-IL-17载体成功构建。把质粒pEGFP-N1和PCR产物进行双酶切(BamH I和EcoR I),再用T4连接酶连接酶切产物,过夜后转入感受态细胞E.coliDH5a中进行扩增,挑取克隆提质粒行双酶切鉴定并选择纯化pEGFP-N1-IL-17重组质粒,在北京华基因生物工程公司进行测序。
1.6 重组质粒pEGFP-N1-IL-17转染喉癌Hep-2细胞把培养瓶中的喉癌Hep-2细胞用不含EDTA的胰酶消化,消化后把相同数量的细胞接种到6孔板中,铺匀,使其在转染日的细胞密度能达到90%,6孔板中的每个孔中加入2 ml培养液(DMEM配的培养基用于Hep-2细胞),在37 ℃细胞培养箱中培养6孔板。细胞长到贴壁状态以后,弃培养液,PBS洗2次。每孔加入1 500 μl Opti-MEM (注意用无酶枪头)。加药时注意用无酶枪头、避光,设置6孔板的3个孔分别为空白对照组、阴性对照组和实验组。先将空白对照组、阴性对照组和实验组的3个孔的药加好:取6个无酶EP管,分成3组:空白对照组、阴性对照组和实验组。空白对照组的2个无酶EP管每管加入250 μl Opti-MEM,再在其中一管中加入Lipofectamine 2000 5 μl,混匀,另一管不加;阴性对照组的2个无酶EP管,一管加Lipofectamine 2000 5 μl混匀,另一管加10 μl pEGFP-N1-NC,混匀;实验组的2管其中一管加5 μl Lipofectamine 2000充分混匀,另一管加10 μl pEGFP-N1-17,充分混匀,避光静置5 min后将每组的两管药混匀,再避光20 min,然后将这3组药分别加入空白对照组、阴性对照组、实验组的板孔中(已经用PBS洗2次,每孔加入1 500 μl Opti-MEM的6孔板中)。在各组的药加好之后,把6孔板置于37 ℃细胞培养箱中培养6 h,到时间后用PBS洗2次,再换上细胞培养基(DMEM +10%胎牛血清用于Hep-2细胞),每孔加2 ml,培养24 h。
1.7 Western blot法检测重组质粒pEGFP-N1-IL-17转染喉癌Hep-2细胞后IL-17的表达用Western blot法分别检测空白对照组、阴性对照组、实验组中IL-17的表达情况。制备Hep-2细胞悬液,以相同的数量接种到6孔板中,培养6 h,弃去培养基,清洗细胞,空白对照组中加入培养基,阴性对照组加入pEGFP-N1-NC,实验组加入pEGFP-N1-IL-17处理6 h,弃去培养液,用PBS洗2次,再换上细胞培养基,每孔加2 ml,培养24 h。弃去培养液,4 ℃预冷,PBS清洗细胞,培养板中加入蛋白裂解液(含PMSF及磷酸化酶抑制剂)充分裂解细胞,13 000 r/min,4 ℃,离心20 min,吸取上清液;BCA试剂盒检测蛋白浓度后分装保存。加入5×loading buffer(比例为4 ∶1)和相应体积的总蛋白样品,在干浴锅中煮蛋白液使其变性,保存在-20 ℃冰箱中。每个泳道加20 μg蛋白样本进行SDS-PAGE凝胶电泳;分离凝胶中的蛋白要转移到PVDF膜上。5%脱脂牛奶孵育PVDF膜2 h。TBST洗涤,洗涤3次,每次10 min。抗IL-17抗体孵育过夜。再用TBST洗涤3次,每次10 min。二抗孵育膜1 h,TBST洗涤3次,每次10 min,用ECL化学发光底物显影检测蛋白。最后用Image-Pro plus 图像处理系统分析并计算Western blot灰度值。
1.8 Western blot法检测重组质粒pEGFP-N1-IL-17对喉癌Hep-2细胞中Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8蛋白表达的影响用Western blot法分别检测空白对照组、阴性对照组、实验组中的Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8蛋白的表达情况。制备Hep-2细胞悬液,以相同的数量接种到6孔板中,培养6 h。弃去培养基,清洗细胞,空白对照组加入培养基,阴性对照组加入pEGFP-N1-NC,实验组加入阳性pEGFP-N1-IL-17处理6 h后用PBS洗2 次,再换上细胞培养基,每孔加2 ml,培养24 h,弃去培养基,PBS清洗细胞,在培养板中加入蛋白裂解液裂解细胞,13 200 r/min、4 ℃离心20 min,提取上清液分装保存。加入5×loading buffer(比例为4 ∶1)和相应体积的总蛋白样品,在干浴锅中煮蛋白液使其变性,保存在-20 ℃ 冰箱中。每个泳道加20 μg蛋白电泳;转移蛋白到PVDF膜上。5%脱脂牛奶孵育PVDF膜2 h。TBST洗涤3次,每次10 min。用Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8、β-actin 抗体孵育过夜。再用TBST洗涤3次,每次10 min,再用TBST洗涤3次,每次10 min。二抗孵育膜1 h,TBST洗涤3次,每次10 min,显影,分析 Western blot 灰度值。
1.9 流式细胞仪检测重组质粒pEGFP-N1-IL-17对喉癌Hep-2细胞凋亡的影响将喉癌Hep-2细胞消化,接种到6孔板中相同的量(每孔细胞计数为1×106),等细胞长至贴壁状态以后,倒掉培养液,PBS洗2次,空白对照组加入培养基,阴性对照组加入pEGFP-N1-IL-NC,实验组加入pEGFP-N1-IL-17处理6 h后用PBS洗2次,再换上细胞培养基,每孔加2 ml,培养24 h,用不含EDTA的胰酶消化细胞,用15 ml离心管收集,300 r/min、4 ℃离心5 min,弃去上清液,400 μl PBS洗涤2次,用PE-7AAD染料对Annexin V-FITC/PI染色。用流式细胞仪检测,最后分析实验结果。

2 结果
2.1 qRT-PCR、Western blot法检测重组质粒IL-17表达情况将双酶切和测序结果均正确的质粒转染后的Hep-2细胞,转染重组质粒IL-17的喉癌Hep-2细胞作为实验组,转染pEGFP-N1-NC空载体的喉癌Hep-2细胞作为对照组,48 h后收集细胞并分为2份:1份提取RNA,通过qRT-PCR在mRNA水平检测细胞IL-17表达水平;另一份提取蛋白,通过Western blot在蛋白水平检测细胞IL-17表达水平。结果均表明重组质粒IL-17在喉癌Hep-2细胞能够成功表达,见图1。
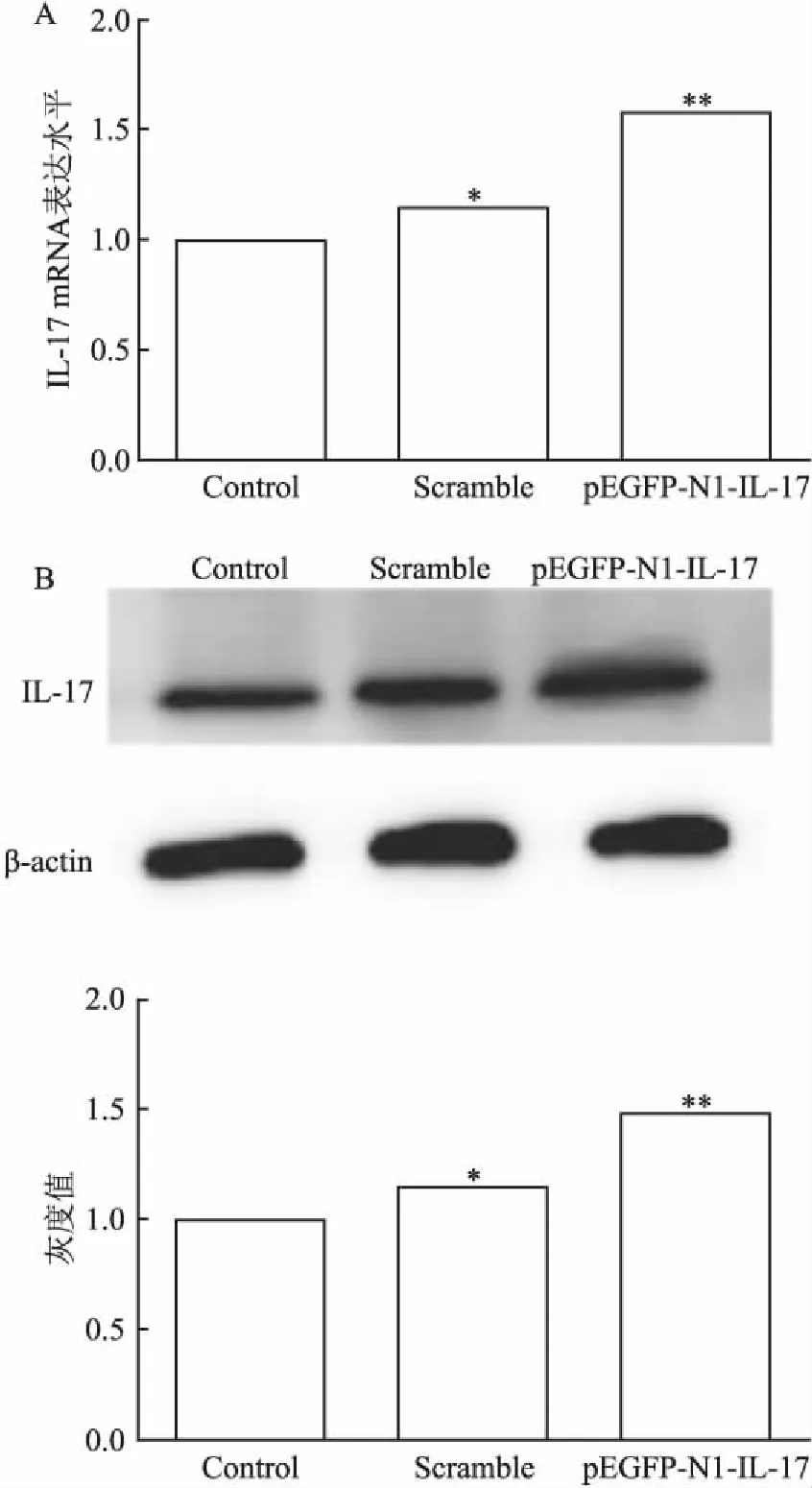
图1 qRT-PCR、Western blot法检测重组质粒 IL-17转染喉癌Hep-2细胞后IL-17的表达情况
A: qRT-PCR检测结果;B:Western blot法检测结果;Control:空白对照组;Scramble:阴性对照组;pEGFP-N1-IL-17:实验组;与空白对照组比较:*P<0.05,**P<0.01
2.2 重组质粒pEGFP-N1-IL-17对喉癌Hep-2细胞中Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8蛋白表达的影响与空白对照组相比,阴性对照组细胞内的Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8蛋白的表达无明显变化(F=58.170,P=0.218)。与空白对照组比较,实验组4种蛋白明显降低,差异有统计学意义(F=72.15,P<0.01)。见图2。
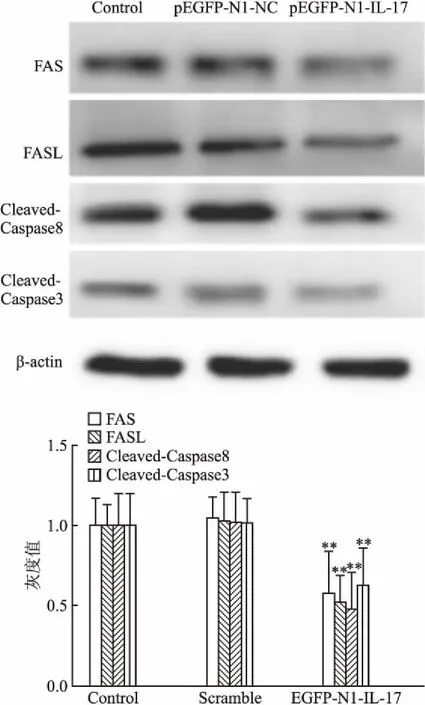
图2 Western blot 法检测重组质粒 pEGFP-N1-IL-17转染喉癌Hep-2细胞中Fas、FasL、 Cleaved-Caspase3、Cleaved-Caspase8蛋白表达的变化
与空白对照组(Control)比较:*P<0.05,**P<0.01
2.3 重组质粒(pEGFP-N1-IL-17)对Hep-2细胞凋亡的影响空白组凋亡率为(11.4±1.52)%,阴性对照组凋亡率为(12.64±7.28)%,实验组凋亡率为(3.39±5.37)%,实验组与空白对照组和阴性对照组比较,实验组的凋亡率明显降低(F=58.48,P<0.01)。见图3。
3 讨论
喉癌是以鳞状细胞癌为主的头颈部常见的恶性肿瘤[1]。对喉癌患者来说,非手术疗法可以保留喉的正常解剖结构和喉的生理功能,这种治疗方法对喉癌患者具有很大的意义[2]。IL-17是CD4+T Th17 等细胞分泌的一种细胞因子[3]。IL-17的相关研究主要集中在肿瘤疾病方面[4]。还有研究[5]显示Lewis肺癌荷瘤小鼠的MDSCs细胞的凋亡也是可以被IL-17抑制的。细胞凋亡是由多基因调控的,主要有两条途径来调控:一是细胞膜上的受体途径,二是细胞内的线粒体途径[10]。细胞膜上的受体途径中Fas与Fasl结合可触发凋亡,细胞凋亡有一条主要途径是由Fas、FasL介导的,此通路的某些环节缺失可能与肿瘤细胞的无限增殖有关。Fas作为一种细胞表面受体,与其配体FasL结合后,使细胞表面形成胞内衔接子三聚体,导致 caspase1、3、6、7形成级联反应诱导细胞的凋亡[11]。本实验Western blot研究结果表明:用pEGFP-N1-IL-17转染24 h后的喉癌Hep-2细胞内 Fas、FasL、Cleaved-Caspase3、Cleaved-Caspase8蛋白表达显著降低,差异有统计学意义(P<0.01)。同时Annexin V-FITC/PI细胞凋亡检测的结果表明:与空白对照组比较,用pEGFP-N1-IL-17转染24 h后的喉癌Hep-2细胞的凋亡率明显降低,差异有统计学意义(P<0.01)。
本研究结果表明,重组质粒pEGFP-N1-IL-17转染后的喉癌Hep-2细胞Fas及其配体FasL明显下调,同时Cleaved-Caspase3、Cleaved-Caspase8表达也明显下调,提示重组质粒pEGFP-N1-IL-17可能通过下调 Fas和FasL蛋白表达,抑制caspase 8后阻断caspase3的活化,从而抑制喉癌细胞Hep-2凋亡。所以IL-17可能通过Fas/FasL信号通路来抑制喉癌Hep-2细胞凋亡,为研究喉癌的机制和治疗喉癌提供了依据。除Fas/Fasl介导的死亡受体途径,IL-17是否可以通过其他途径抑制喉癌Hep-2细胞凋亡仍需探索。
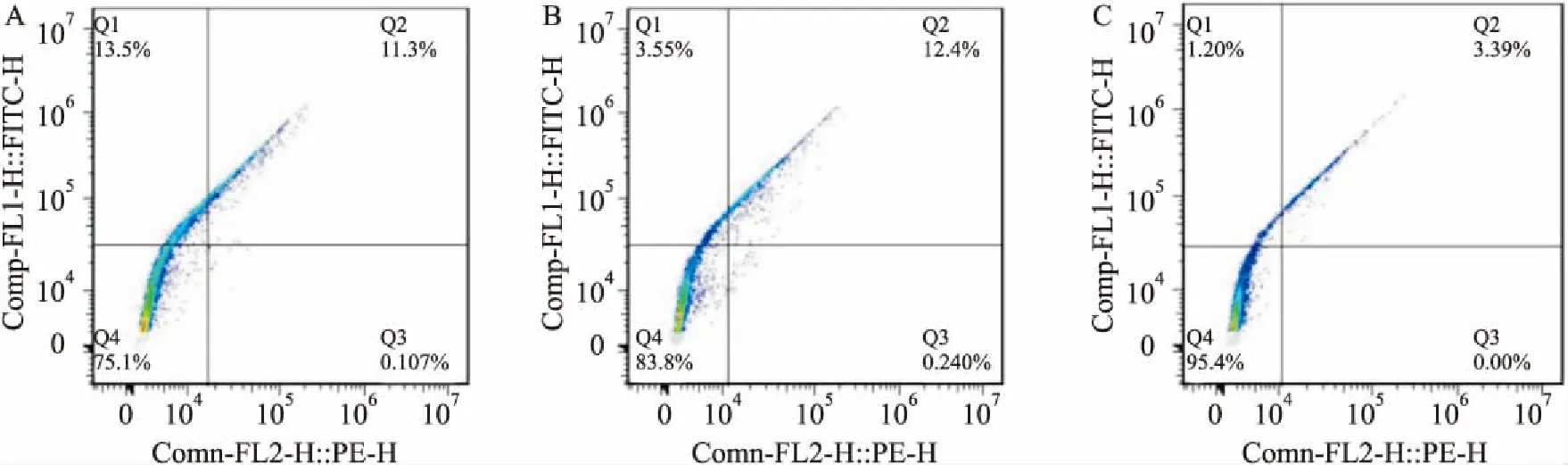
图3 流式细胞术检测重组质粒(pEGFP-N1-IL-17)对Hep-2细胞凋亡的影响A:空白组;B:pEGFP-N1-NC组;C:pEGFP-N1-IL-17组

