miR-637调控CDK6/cyclinD1/Rb信号通路对人胃癌细胞增殖、迁移和侵袭的影响
刘玉海,刘明明,刘新华
胃癌是最常见的恶性肿瘤之一。在我国,胃癌发病率和死亡率分别位于恶性肿瘤的第三位和第五位,近年来仍有上升趋势[1-2]。胃癌的发生发展是多基因、多因素参与的复杂过程,其发病机制尚不完全明确。microRNA(miRNA)是一类由18~25个核苷酸组成的小分子非编码RNA,通过与靶基因的mRNA结合,抑制其翻译或促进降解,从而起到调控靶基因表达的作用。大量研究[3-5]表明,miRNA直接或间接参与了肿瘤的发生发展过程。miR-637在肝癌[6]、神经胶质瘤[7]、甲状腺癌[8]等肿瘤细胞中表达下调,过表达miR-637可以抑制肿瘤细胞的增殖、侵袭和迁移。表明miR-637可能是一个肿瘤抑制因子。但miR-637对胃癌细胞的影响尚不明确。本文拟研究miR-637在人低分化胃腺癌细胞系AGS、中分化胃腺癌细胞系SGC-7901和正常胃黏膜上皮细胞系GES-1中的表达水平,探讨miR-637对胃癌细胞增殖、迁移和侵袭的影响及作用机制。
1 材料与方法
1.1 材料人胃癌细胞系SCG7901、AGS和人胃黏膜上皮细胞系GES-1均购自美国ATCC细胞库;RPMI-1640培养液、胎牛血清、胰蛋白酶、双抗购自美国Hyclone公司;CCK-8增殖检测试剂盒购自上海碧云天生物科技有限公司;miR-637 mimics、抑制剂、转染试剂Lipofectamine 2000、RNA 提取试剂TRIzol购自美国Invitrogen公司;Transwell小室购自美国Corning公司;Western blot所用的CDK6、cyclin D1、E2F1、Rb、β-actin一抗均购自美国Proteintech公司;磷酸化Rb一抗、二抗购自美国CST公司。
1.2 细胞培养和转染胃癌细胞系SCG7901、AGS和胃黏膜上皮细胞GES-1,用含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI-1640培养基,在5% CO2、37 ℃的培养箱中培养,培养至汇聚度达到95%时传代。细胞转染时,取对数生长期细胞接种于6孔板中培养24 h,按转染试剂盒说明书操作方法,用Lipofectamine 2000分别将miR-637 mimics及阴性对照miR-NC、miR-637 inhibitor及阴性对照IN-NC转入AGS和SCG7901细胞中,转染6 h后更换新鲜培养基并继续培养48 h后,用实时定量PCR(qRT-PCR)鉴定转染效率,并进行后续功能实验。
1.3 RNA提取及qRT-PCR根据RNA提取试剂盒的说明书,用TRIzol试剂提取各组细胞中的总RNA,利用Takara反转录试剂盒逆转录为cDNA后,根据说明书进行荧光定量PCR扩增,以U6 RNA和GAPDH为内参,采用2-ΔΔCt法将Ct值结果进行处理,对miR-637和CDK6 mRNA相对表达水平进行定量分析。各基因引物见表1。
1.4 细胞增殖实验各组细胞用胰蛋白酶消化,吹打成单细胞悬液。细胞计数后,以每孔2 000个接种于96孔板,每孔200 μl培养基,5% CO2、37 ℃培养,分别于培养1、2、3、4、5 d后,按20 μl/孔加入CCK-8溶液,2 h后在振荡器上振荡15 min,用酶标仪检测450 nm的吸光度,以时间(d)为横坐标,吸光度值(OD)为纵坐标,绘制出各组细胞生长曲线。

表1 各基因qRT-PCR引物一览表
1.5 划痕实验检测细胞迁移能力将各组细胞接种于6孔板中,待细胞汇聚度达到100%后,用灭菌枪头在单层细胞层上用力划线,划痕后0 h和48 h分别在显微镜下观察细胞划痕的恢复情况并拍照。用图像分析软件分析细胞划痕宽度并计算划痕愈合率。划痕愈合率=(划痕宽度0 h-划痕宽度48 h)/划痕宽度0 h×100%。实验重复3次,取平均值。
1.6 Transwell检测细胞侵袭能力各组细胞消化后吹打成单细胞悬液。细胞计数后,按5×104个/孔的密度接种到预先加入matrigel的transwell小室中,下室中加入含10%胎牛血清的培养基,培养24 h后,用棉签擦去上室内层细胞。小室下层细胞用无水甲醇固定15 min,结晶紫染色,每孔随机选取5个视野进行计数统计。实验重复3次,取平均值,计算抑制率。
1.7 Western blot用Western blot及IP细胞裂解液将各组细胞裂解,提取细胞中总蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度,用10% SDS-PAGE电泳,每孔泳道加入30 μg总蛋白,湿转法转膜后,封闭液室温封闭1 h,加入一抗(用一抗稀释液1 ∶1 000稀释),4 ℃下孵育过夜,TBST洗膜3次,每次15 min。加入TBST 1 ∶2 000稀释的二抗,室温孵育1 h,TBST洗膜3次,每次15 min。采用增强化学发光法(enhanced chemiluminescence, ECL)进行显影检测蛋白条带,以β-actin蛋白作为内参。

2 结果
2.1 miR-637在胃癌细胞系中低表达用qRT-PCR检测了正常胃黏膜上皮细胞系GES-1和胃癌细胞系AGS、SGC7901中miR-637的表达量。结果如图1所示,与正常胃黏膜细胞GES-1相比,miR-637在胃癌细胞SGC7901和AGS中的表达量显著降低,差异有统计学意义(t=16.63,P<0.01;t=15.88,P<0.01)。

图1 miR-637在胃癌细胞中的表达与GES-1细胞比较:**P<0.01
2.2 miR-637抑制胃癌细胞增殖在胃癌细胞系SGC7901和AGS中转入miR-637 mimics、inhibitor以及阴性对照miR-NC、IN-NC后,用qRT-PCR鉴定miR-637的相对表达量,以GAPDH为内参。结果显示,转染mimics的SGC7901和AGS细胞相对表达量均显著高于阴性对照组miR-NC,差异有统计学意义(t=-21.96,P<0.01;t=-21.32,P<0.01)(图2A)。转染inhibitor的SGC7901和AGS细胞相对表达量均显著低于阴性对照组IN-NC(图2B),差异有统计学意义(t=4.67,P<0.05;t=4.89,P<0.05)。PCR结果表明在细胞内过表达miR-637和降低miR-637表达量成功,转染后的细胞系可以进行后续功能研究。
用CCK-8试剂盒检测miR-637 mimics和inhibitor对胃癌细胞增殖的影响。结果如图3所示,在人胃癌细胞SGC7901、AGS中转入mimics后,OD值低于转入阴性对照(miR-NC)的细胞,表明细胞增殖水平降低,第3天之后两组细胞的OD值差异具有统计学意义(P<0.05)(图3A、3B);而转入inhibitor后,OD值高于转入阴性对照(IN-NC)的细胞,表明细胞的增殖能力增强,第2天之后两组细胞OD值差异具有统计学意义(P<0.05)(图3C、3D)。细胞增殖实验的结果表明,miR-637作为抑癌基因抑制胃癌细胞的增殖。
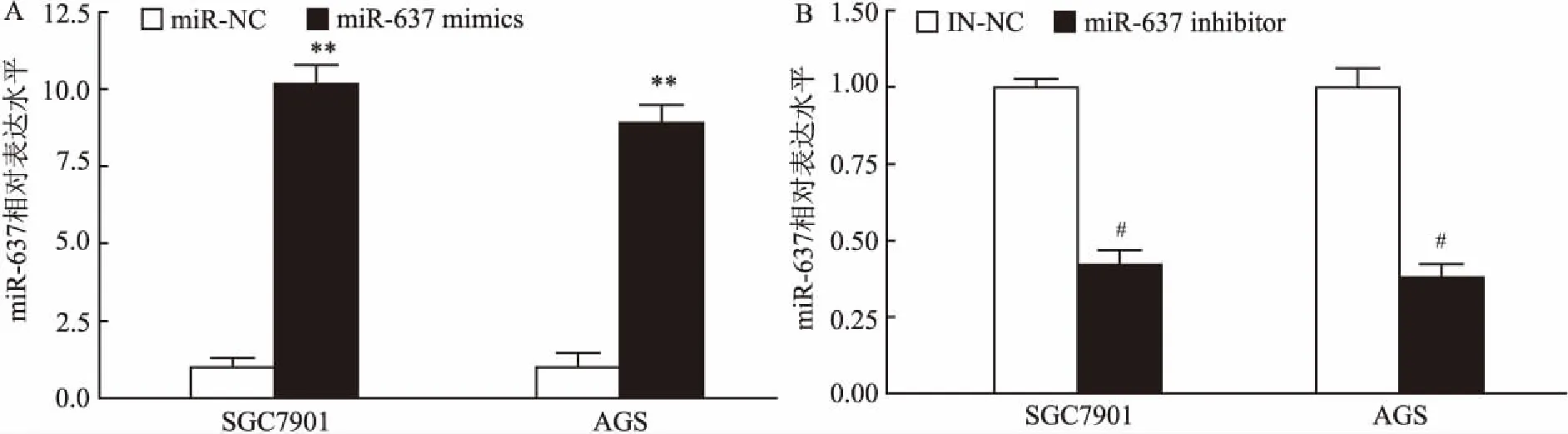
图2 细胞中miR-637过表达和抑制的验证
A:转染miR-637 mimics和miR-NC后miR-637相对表达水平;与miR-NC组比较:**P<0.01;B:转染miR-637 inhibitor和IN-NC后miR-637相对表达水平;与IN-NC组比较:#P<0.05
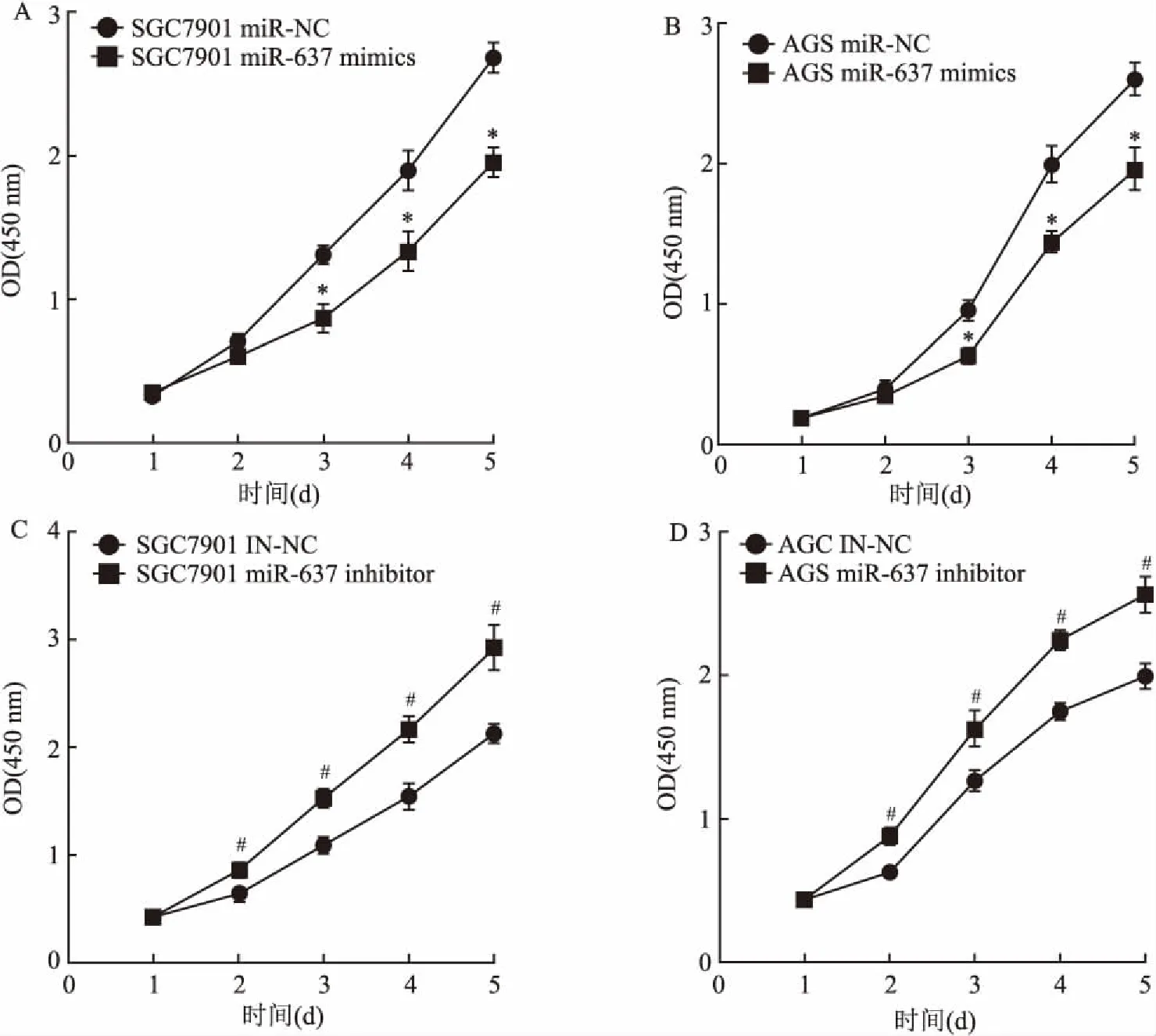
图3 miR-637对胃癌细胞增殖的影响
A、B:转染miR-637 mimics和miR-NC后细胞生长曲线;与miR-NC组比较:*P<0.05;C、D:转染miR-637 inhibitor和IN-NC后细胞生长曲线;与IN-NC组比较:#P<0.05
2.3 miR-637抑制胃癌细胞的迁移能力用划痕愈合实验检测了转染miR-637 mimics和inhibitor对两株胃癌细胞迁移能力的影响。SGC7901细胞转入mimics后,划痕愈合率为(33.3%±3.7%),转入阴性对照miR-NC为(60.4%±4.2%);AGS细胞转入mimics后,划痕愈合率为(28.6%±3.4%),转入miR-NC为(55.3%±4.8%)(图4A),差异有统计学意义(t=6.84,P<0.01;t=7.86,P<0.01)。SGC7901细胞转入inhibitor后,划痕愈合率为(78.9%±7.5%),转入阴性对照IN-NC为(53.1%±6.7%);AGS细胞转入inhibitor后,划痕愈合率为(89.4%±16.1%),转入IN-NC为(37.1%±3.7%)(图4B),差异有统计学意义(t=-4.44,P<0.05;t=-5.48,P<0.05)。划痕实验的结果表明,转入mimics抑制了细胞的迁移,而转入inhibitor促进了细胞的迁移,提示miR-637可以抑制胃癌细胞的迁移能力。

图4 miR-637对胃癌细胞迁移能力的影响
A:转染miR-637 mimics和miR-NC后细胞划痕愈合情况;B:转染miR-637 inhibitor和IN-NC后细胞划痕愈合情况
2.4 miR-637抑制胃癌细胞的侵袭能力进一步用Transwell实验检测了miR-637 mimics和inhibitor对两株胃癌细胞侵袭能力的影响。在显微镜200倍视野下对侵袭穿过小室的细胞进行计数。SGC-7901细胞转入mimics后,穿过小室的细胞数为(35.1±4.8)个,转入miR-NC为(27.3±1.4)个;AGS细胞转入mimics的为(20.9±2.3)个,转入miR-NC的为(14.1±2.0)个(图5A),差异有统计学意义(t=3.48,P<0.05;t=4.98,P<0.05)。SGC-7901细胞转入inhibitor的为(32.6±3.0)个,转入IN-NC的为(44.3±5.4)个;AGS细胞转入inhibitor的为(15.7±2.3)个,转入IN-NC的为(24.7±3.1)个(图5B),差异有统计学意义(t=-3.28,P<0.05;t=-4.03,P<0.05)。Transwell实验的结果表明,转入mimics减少了侵袭的细胞数,而转入inhibitor增加了侵袭的细胞数,提示miR-637可以降低胃癌细胞的侵袭能力。
2.5 miR-637抑制CDK6/cyclinD1/Rb信号传导通路本研究采用qRT-PCR和Western blot两种方法分别检测了miR-637对CDK6 mRNA和蛋白表达量的影响,结果如图6A、6B所示,与转染miR-NC相比,转染miR-637 mimics的SGC7901和AGS细胞中CDK6 mRNA表达量显著下降,差异有统计学意义(t=7.32,P<0.05;t=5.08,P<0.05)。与转染IN-NC相比,转染miR-637 inhibitor的SGC7901和AGS细胞中CDK6 mRNA相对表达量显著升高,差异有统计学意义(t=-7.65,P<0.01;t=-6.18,P<0.05)。
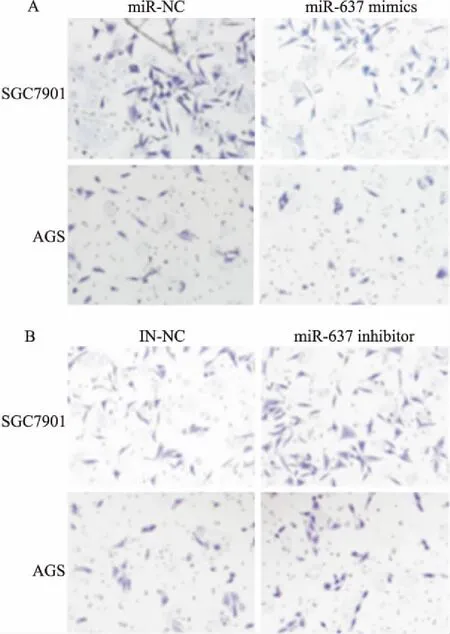
图5 miR-637对胃癌细胞侵袭能力的影响 结晶紫染色×200
A:转染miR-637 mimics和miR-NC后穿过transwell小室的细胞;B:转染miR-637 inhibitor和IN-NC后穿过transwell小室的细胞
Western blot结果显示,与对照组相比,转染mimics降低了SGC-7901和AGS细胞中CDK6的表达水平,而转染inhibitor上调了CDK6的表达(图6C)。进一步用Western blot实验检测了miR-637 mimics和inhibitor对CDK6下游信号通路的影响。结果如图6D所示,与miR-NC相比,转染mimics能下调周期相关蛋白cyclin D1、转录因子E2F1的表达以及Rb的磷酸化水平,对Rb的表达水平没有显著影响。而转染inhibitor能增加cyclin D1、E2F1的表达和Rb的磷酸化水平。上述结果表明,miR-637可以抑制CDK6/cyclinD1/Rb信号传导通路。
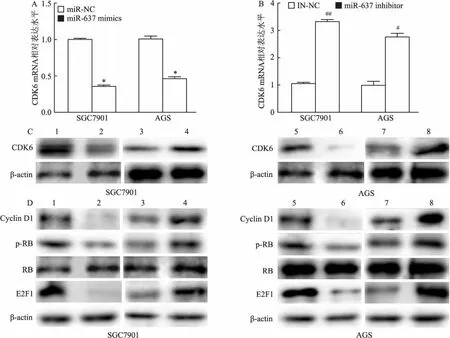
图6 miR-637对CDK6/cyclinD/Rb和E2F1信号通路的影响
A:转染miR-637 mimics和miR-NC后CDK6 mRNA的相对表达水平;与miR-NC组比较:*P<0.05;B:转染miR-637 inhibitor和IN-NC后CDK6 mRNA的相对表达水平;与IN-NC组比较:#P<0.05,##P<0.01;C、D:Western blot检测CDK6和下游信号分子的变化情况;1:SGC7901 miR-NC组;2:SGC7901 mimics组;3:SGC7901 IN-NC组;4:SGC7901 inhibitor组;5:AGS miR-NC组;6:AGS mimics组;7:AGS IN-NC组;8:AGS inhibitor组
3 讨论
胃癌是一种具有侵袭性的恶性肿瘤,转移率高,导致胃癌患者5年生存期较低,仅30%~35%[9]。癌症的发生发展是多种促癌和抑癌基因表达异常、信号传导通路调控失常的综合结果。因此,深入研究阐明胃癌发生发展中的关键基因和信号分子,对于发现潜在治疗靶点、开发早期诊断标志物和靶向治疗药物都具有重要意义和应用价值。miRNAs与靶基因mRNA的3′-UTR通过碱基互补配对结合,调控靶基因的表达,从而促进或者抑制肿瘤的增殖、转移和对药物的敏感性。研究证实,多种miRNA与胃癌细胞的增殖、侵袭和迁移能力有密切关系,例如miR-23a/b通过调控PDCD4促进了胃癌细胞的生长、抑制细胞凋亡[10];miR-125a通过调控STAT3抑制胃癌细胞的迁移和侵袭[11];miR-362-5p在胃癌组织中表达量高于癌旁组织,并在体外促进了胃癌细胞的增殖和迁移[12],但miR-637与胃癌的关系尚未见报道。本研究发现,与正常胃黏膜细胞相比,胃癌细胞系SGC7901和AGS中miR-637的表达量显著降低。在胃癌细胞中转染miR-637 mimics可显著抑制细胞的增殖、迁移和侵袭,而转染inhibitor则促进胃癌细胞的增殖、迁移和侵袭,说明miR-637是胃癌发生发展的抑制因子。
CDK6是重要的细胞周期调控因子。CDK6与细胞周期蛋白cyclin D1形成复合体而激活,激活后的复合体通过磷酸化下游肿瘤抑制因子Rb导致其失活,同时上调转录因子E2F1的表达,今后推动细胞周期的转换,促进细胞增殖[13]。CDK6的过表达与非小细胞型肺癌、乳腺癌、胃癌、卵巢癌等多种恶性肿瘤密切相关,已成为抗肿瘤药物的作用靶点[14]。
有文献[15]报道,在慢性阻塞性肺病中,缺氧导致miR-637下调,从而增加下游靶基因CDK6在肺部平滑肌细胞中的表达,导致肺动脉高压,表明miR-637可以调控CDK6的表达。因此,在本研究中检测了胃癌细胞过表达和沉默miR-637时CDK6 mRNA和蛋白水平的变化情况。结果表明,过表达miR-637可显著下调CDK6的表达,同时降低cyclin D1、转录因子E2F1的表达,抑制Rb的磷酸化,从而抑制细胞增殖、迁移和侵袭。

