高血压人群原发性醛固酮增多症患者代谢改变的性别特异性研究
荣利伟,骆秦,王梦卉,张德莲,努尔比亚·阿不都塞拉木,陶维俊,李南方*
原发性醛固酮增多症(primary aldosteronism,PA)以肾上腺皮质醛固酮生成过多为特征,占高血压患者的4.6%~16.6%,在难治性高血压中更高[1-2]。长期醛固酮过多与心肌梗死、心房颤动、卒中和慢性肾脏疾病风险的增高密切相关[3-5]。与原发性高血压病(EH)患者相比,PA患者常伴发更多的心血管并发症,醛固酮对心血管的危害可能独立于高血压的作用之外[3,6-7]。除了对血压、血管内容积的影响外,PA还可能使机体代谢发生改变[8],发生氧化应激,从而导致靶器官损害[9-10]。多项研究报道PA与糖代谢紊乱和代谢综合征(metabolic syndrome,MS)的发生密切相关。醛固酮过多引起的低血钾症可以影响胰岛素的分泌,导致糖代谢紊乱[5,11-12]。醛固酮过多本身也可影响胰岛素的分泌,促使胰岛素抵抗的发生[13-14]。研究显示,与EH患者相比,PA患者中糖尿病和MS的患病率明显增高[5,15-16]。然而一项大型的横断面研究报道,PA和EH之间糖代谢和脂代谢紊乱的发生情况没有差异[17]。因此代谢紊乱在PA和EH中是否存在差异尚不明确。这些PA患者中代谢紊乱改变研究结果的差异,可能与不同性别PA患者代谢改变存在差异有关,但目前关于不同性别对PA患者代谢影响的研究较少。肥胖个体醛固酮生成过多是其心血管疾病和代谢紊乱发生的重要原因之一[18],研究显示醛固酮在肥胖男性中与微血管胰岛素敏感性和代谢改变无关[19],仅在女性中与肥胖、体质指数(BMI)及血压直接相关[20]。此外通过盐皮质激素受体拮抗剂(MRA)阻滞醛固酮作用女性(雌性)比男性(雄性)更有效[21-22]。据此本研究的目的是分析不同性别PA患者的代谢改变,为醛固酮的作用机制和PA的诊治提供新的证据。
本文要点:
原发性醛固酮增多症(PA)与糖代谢紊乱和代谢综合征的发生密切相关。与原发性高血压病(EH)患者相比,PA患者常伴发更多的心血管并发症。本研究主要结果为:(1)进行年龄匹配后,男性PA患者血压水平明显高于EH患者,女性血压水平无明显差异;(2)肥胖女性中,PA患者糖代谢异常的比例明显高于EH患者,而男性未发现此种差异。提示:PA患者存在严重靶器官损害,在男性中主要由于高血压,在女性中除高血压外还可能与较重的代谢紊乱有关,PA患者代谢改变可能存在性别特异性。
1 对象与方法
1.1 研究对象 选入2009—2010年就诊于新疆维吾尔自治区人民医院高血压诊疗中心并诊断为高血压的患者1 058例。纳入标准:(1)已服用2种或2种以上降压药物,血压仍不能降至140/90 mm Hg(1 mm Hg=0.133 kPa)以下;(2)自发性低钾血症;(3)肾上腺意外瘤、早发高血压及脑卒中等心脑血管疾病,以及有肾上腺疾病家族史等疑似PA。排除标准:(1)高血压严重无法控制;(2)肝、肾功能不全,严重心血管并发症(心肌梗死、心绞痛、卒中或心脏衰竭);(3)甲状腺功能异常;(4)疑似库欣综合征、嗜铬细胞瘤、肾实质性高血压、肾血管性高血压等继发性高血压。
1.2 研究方法
1.2.1 一般资料统计 患者基本信息,包括姓名、性别、年龄、身高、体质量、腹围、血压、用药情况、高血压、糖尿病史等。
1.2.2 一般生化检测 血、尿标本留取:患者普通饮食,未补钾时先要求受试者准确留取24 h尿,隔夜空腹12 h后8:00~10:00采集血样。入选者分别采集外周静脉血于乙二胺四乙酸(EDTA)抗凝管中,进行肝功能(丙氨酸氨基转移酶、天冬氨酸氨基转移酶、胆红素、清蛋白等)、肾功能(血尿素氮、肌酐、尿酸、尿蛋白等)、血糖、血脂、电解质等检测。血、尿电解质测定采用离子选择电极法(日本日立公司7600-010全自动生化分析仪,电极参比液购自Beckman Coulter,美国)进行检测,血、尿钾批间变异(coefficient of variation,CV)<2%,血、尿钠批间CV<1%,血脂测定采用酶法,血糖测定采用葡萄糖氧化酶法。
1.2.3 特殊生化指标检测 血醛固酮(plasma aldosterone concentration,PAC)、血肾素活性(plasma renin activity,PRA)测定准备:要求患者检测前停用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、二氢吡啶类钙拮抗剂和β-受体阻滞剂至少4周,停用利尿剂和盐皮质激素拮抗剂至少6周。如果有必要,降压药可替换为缓释维拉帕米或α-肾上腺素受体拮抗剂(多沙唑嗪或特拉唑嗪)或两者的结合以减少对PAC、PRA和醛固酮肾素比(ARR)测量的干扰。患者普通饮食,低血钾患者采用口服补钾的方法将血钾调整至3.5~4.5 mmol/L再抽坐位血。于当地时间9:00抽取坐位静脉血(空腹,保持坐位15 min以上),测定醛固酮和肾素活性,计算ARR。ARR按照以下公式计算:ARR(ng/dl∶ ng·ml-1·h-1)=PAC(ng/dl)/PRA(ng·ml-1·h-1)。盐水试验:试验前须空腹、保持坐位15 min以上,当地时间9:00开始.在4 h内静脉滴注0.9%氯化钠溶液2 000 ml(500 ml/h,滴速恒定),在整个过程中需要密切监测血压和心率变化。在静脉滴注前和静脉滴注后分别测定PAC及PRA。PAC和PRA的检测均采用放射免疫法,试剂盒分别购自Beckman Coulter(美国)和北京北方生物研究所(中国)。PAC参考范围为3.81~31.3 ng/dl(坐位状态),PRA参考范围为0.20~1.90 ng·ml-1·h-1(坐位状态),PAC试剂盒批间CV是9.8%,批内CV是4.5%:PRA试剂盒批间CV<15%,批内CV<10%。
1.3 相关诊断标准
1.3.1 PA的筛查与诊断 严格按照美国内分泌学会的PA诊断治疗专家共识[23],PA阳性的筛检试验 是 基 于 ARR>20 和 /或 PAC>10 ng/dl。 对 PA 的诊断依据生理盐水输注试验(saline infusion test,SIT)的结果判定。受试者SIT后PAC>10 ng/dl被认为是 确 诊 PA,PAC 5~10 ng/dl认 为 是 不 确定 PA,PAC<5 ng/dl或 ARR<20可以排除 PA。2次 PAC水平均值<5 ng/dl者,同时排除其他继发性高血压作为EH组。两次PAC水平均值>5 ng/dl而<10 ng/dl的为不确定PA。最终127例患者被确诊为PA,259例患者为不确定PA,672例患者被确诊为EH。对确诊PA患者和EH患者按性别、年龄(±1岁)标准以1∶3的比例进行匹配,最后124例PA患者和372例EH患者完成匹配。
1.3.2 MS的诊断 参考2009年多机构联合声明(Joint Interim Statement,JIS)对 MS的诊断标准[24],具备以下3项或3项以上者为MS:(1)腹围升高:男性腹围≥90 cm、女性≥80 cm;(2)高三酰甘油:空腹≥1.7 mmol/L和/或进行降三酰甘油药物治疗者;(3)低高密度脂蛋白胆固醇(HDL-C):空腹血HDL-C男性<1.0 mmol/L、女性<1.3 mmol/L和/或进行低HDL-C药物治疗者;(4)血压升高:收缩压≥130 mm Hg和/或舒张压>85 mm Hg和/或已确诊为高血压降压治疗者;(5)高血糖:空腹血糖(FPG)≥5.6 mmol/L和/或餐后2 h血糖(2 hPG)>7.8 mmol/L或已确诊为糖尿病并治疗者。由于本研究中腹围数据不很精确,因此同时参考中华医学会糖尿病分会对超重或肥胖(BMI≥25 kg/m2为超重或肥胖)及MS的定义[25],分别以腹围和BMI两个标准分别研究MS的患病情况,记作WCMS和BMIMS。
1.4 统计学方法 采用SPSS 22.0统计软件进行统计分析。正态分布计量资料以(x ±s)表示,两组间比较采用独立样本t检验,三组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以百分率表示,比较采用χ2检验或Fisher's确切概率法;在分别控制年龄、血压、血肌酐、尿酸后,采用多元线性回归分析不同性别超重或肥胖患者血糖的影响因素。以P<0.05为差异有统计学意义,计数资料三组间两两比较,需调整检验水准为0.017。
2 结果
2.1 基线情况 按照排除纳入标准,总共1 058例患者进入了PA的筛检流程并完善了相关的检查项目,如:坐位醛固酮及PRA、盐水负荷试验、血糖、血脂、血压等。该人群男667例(63.0%),平均年龄为(45.5±9.0)岁,醛固酮为(14.8±8.2)ng/dl,PA 的检出率为12.0%(127/1 058),糖尿病检出率为13.5%(143/1 058)。三组患者年龄、收缩压、舒张压、血糖、糖尿病患者占比、总胆固醇、血钾、坐位醛固酮、坐位肾素、ARR比较,差异有统计学意义(P<0.05),性别、腹围、BMI、三酰甘油、HDL-C、WCMS、BMIMS、肌酐、尿酸比较,差异无统计学意义(P>0.05,见表1)。
2.2 PA患者与性别、年龄相匹配的EH患者一般情况的比较 在性别、年龄匹配的患者中,总体患者,PA组收缩压、坐位醛固酮、ARR明显高于EH组,总胆固醇、血钾、坐位肾素水平明显低于EH组,差异有统计学意义(P<0.05);男性患者,PA收缩压、舒张压、坐位醛固酮、ARR明显高于EH组,血钾、坐位肾素水平明显低于EH组,差异有统计学意义(P<0.05);女性患者,PA组总胆固醇、血钾、坐位肾素水平明显低于EH组,坐位醛固酮、ARR明显高于EH组,差异有统计学意义(P<0.05,见表2)。
2.3 不同性别PA和EH患者代谢相关指标检出率的比较 男性PA和EH患者之间、女性PA和EH患者之间,肥胖、血脂异常、血糖异常、MS的检出率比较,差异无统计学意义(P>0.05,见表3)。但在超重或肥胖患者中,女性PA患者高血糖症的检出率明显高于EH组(P<0.05),而男性患者中MS和代谢相关指标的检出率在PA和EH间差异无统计学意义(P>0.05,见表4)。
2.4 不同性别超重或肥胖患者血糖的影响因素的多元线性回归分析 以不同性别超重或肥胖患者的血糖为因变量,以年龄、收缩压、舒张压、三酰甘油、肌酐、尿酸、盐水后醛固酮为自变量,进行多元线性回归分析,结果显示:年龄、三酰甘油是男性超重或肥胖患者血糖的影响因素(P<0.05);年龄、三酰甘油、盐水后醛固酮是女性超重或肥胖患者血糖的影响因素(P<0.05,见表5)。
3 讨论
本研究结果显示,与EH患者相比,男性PA患者血压水平较高,女性血压水平未见明显差异。MS和代谢相关参数异常的检出率在不同性别PA和EH患者之间整体上未见明显差异,而在肥胖女性PA患者中高血糖症的检出率明显高于EH患者,男性患者中MS和代谢相关指标异常检出率在PA和EH间均未见明显差异。在肥胖女性个体中,盐水后醛固酮与血糖独立相关。
本研究在性别、年龄相匹配的PA和EH患者间未发现糖脂代谢指标的差异,与本研究结果相似,MATROZOVA等[17]分析了大量的PA和EH患者后,发现与EH患者相比,PA患者糖脂代谢异常比例不高,认为PA中MS患病率较EH患者高的可能性不大。同样SOMLÓOVÁ等[26]回顾性分析了100例PA患者,其中50例特发性醛固酮增多症、50例醛固酮腺瘤,和90例年龄、病程相匹配的EH患者做对照,结果显示MS患病率在PA和EH之间相似。之前许多研究报道PA与糖代谢紊乱、MS密切相关[5,12-13]。醛固酮过多引起低血钾症,通过影响胰岛素的分泌,导致糖代谢异常[12-13]。甚至醛固酮过多本身也可影响胰岛素的分泌,促使胰岛素抵抗的发生[13-14]。德国的一项研究显示与年龄、性别、血压相匹配的对照组相比,PA患者中MS的患病率明显增高,其中糖尿病患病率的升高是主要的贡献因素[5]。上述研究的差异可能由于代谢紊乱在PA和EH间发生机制不同有关,不同性别、不同亚型[26]的PA其各代谢紊乱的情况可能不相同,而多数研究没有考虑这些因素。本研究发现与EH患者相比,虽然PA患者的年龄偏大、血压偏高,但其血脂水平却较低,目前PA和EH代谢紊乱的机制还不十分清楚。
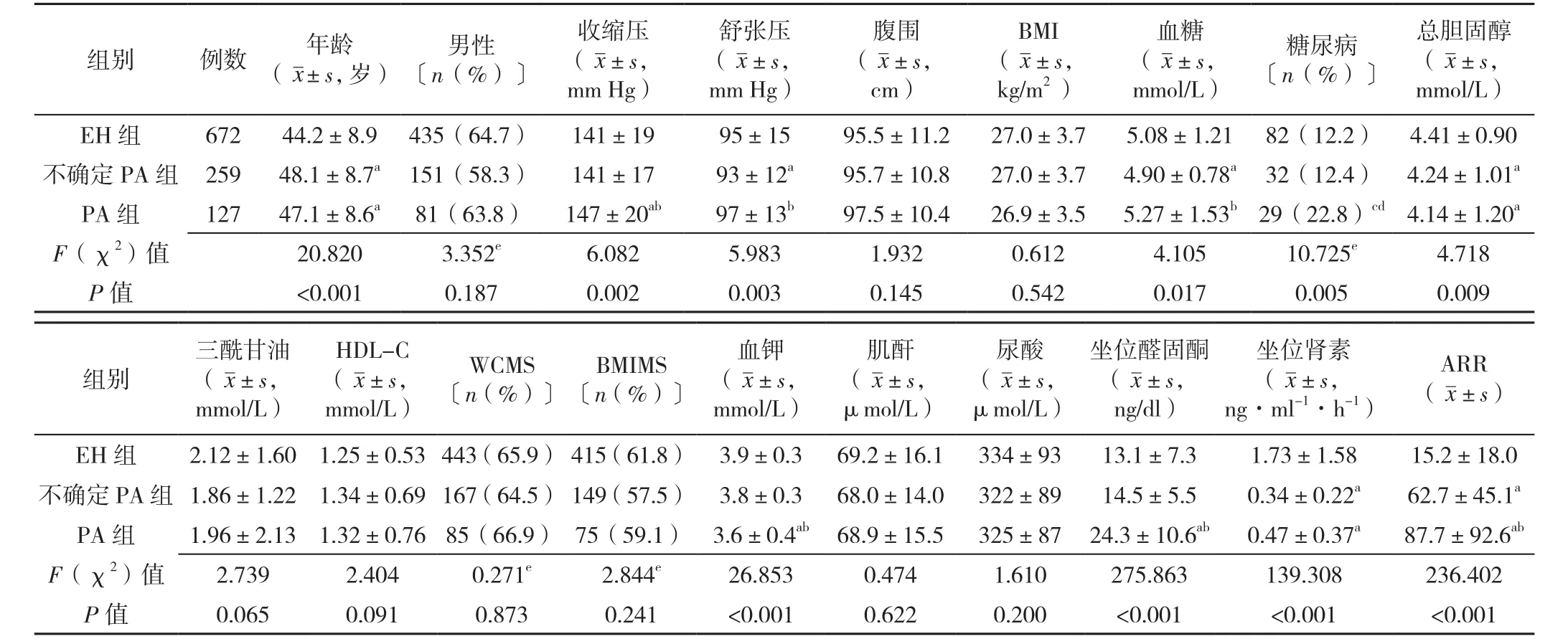
表1 三组患者的基线情况比较Table 1 Comparison of baseline characteristics among three groups

表2 PA患者与性别和年龄相匹配的EH患者一般情况的比较Table 2 Comparison of general conditions of PA patients and EH patients matched for age and sex

表3 不同性别PA和EH患者代谢相关指标检出率的比较〔n(%)〕Table 3 Comparison of detection rates of metabolic related parameters in PA patients and EH patients with different genders
本研究仅在肥胖女性中发现PA患者高血糖症的患病率明显高于EH,而男性患者中未发现这种差异。对于不同性别PA患者对代谢影响的研究目前还较少,肥胖个体醛固酮生成过多是心血管疾病和代谢紊乱的重要因素之一[18],而肥胖个体醛固酮过多仅在女性个体中与内脏肥胖和BMI及血压直接相关[20],而且通过盐皮质激素受体拮抗剂阻滞醛固酮的作用女性比男性更有效[21-22]。研究显示在肥胖的男性患者中未发现醛固酮和微血管胰岛素敏感的关系[19]。在这项研究中分析了25例非肥胖和53例腹型肥胖的男性个体,结果显示腹型肥胖参与者和非肥胖的参与者之间醛固酮水平和钠盐分泌没有差异,也未发现醛固酮与胰岛素介导的肌肉微血管恢复受损(impaired insulin-mediated muscle microvascular recruitment,IMMR)、胰岛素敏感性之间的相关性,醛固酮的绝对水平不能解释肥胖与非肥胖个体间微血管、胰岛素敏感性和血压之间的差异。SHAMISS等[27]发现未经治疗的PA患者胰岛素的敏感性明显高于EH患者。研究报道PA患者经盐皮质激素受体拮抗剂或肾上腺切除术治疗后,胰岛素敏感性恢复正常[28-29],然而没有发现PA患者在长期药物或手术治疗后,其糖耐量受损得到改善[30]。PA和EH的糖代谢异常是否有共同的作用机制尚不清楚。醛固酮合酶基因变异(CYP11B2,参与醛固酮合成的主要酶)和高血糖之间的相关性已在EH患者中发现[31],醛固酮水平和胰岛素抵抗的相关性也已经在正常血压和高血压的人群中观察到[32-33]。醛固酮的基因组生物学作用是通过与核受体家族成员和MR相互作用而介导的。MR与胰岛素受体基因启动子中的糖皮质激素反应元件的直接作用,导致胰岛素受体下调[34]。关于人体脂肪组织中MR的存在以及醛固酮作为调节脂肪组织功能和介导脂肪组织中胰岛素抵抗作用的可能角色尚不清楚。同样我们发现在肥胖女性个体中,盐水后醛固酮与高血糖症独立相关,而未发现血钾和醛固酮与高血糖症的相关性。不同性别非肥胖个体中及所有个体整体分析,均未发现血钾、醛固酮或盐水后醛固酮与高血糖症的相关性。研究表明肥胖个体脂肪源性瘦素增加,可能是脂肪介导醛固酮水平升高的关键环节。肥胖个体内源性瘦素增加或外源性补充瘦素会增加醛固酮合酶(CYP11B2)的表达和醛固酮的生成,瘦素缺乏或阻滞瘦素信号会降低醛固酮水平[35]。在肾脏皮质细胞,瘦素依赖的CYP11B2的表达及其介导的钙依赖通道机制是肥胖个体醛固酮升高的原动力而非脂肪体积[35],瘦素导致肥胖个体高血压的机制是:女性通过瘦素激活醛固酮盐皮质激素轴[22],男性通过瘦素介导的交感系统激活[36]。肥胖可以通过瘦素诱导内皮细胞功能紊乱和刺激心肌胶原沉积[35],肥胖小鼠MRA可以消除MR介导心血管疾病的损害[37-39]。在肥胖个体,雄性可以通过内皮源性超极 化(endothelium-derived hyperpolarization,EDH) 抑制内皮细胞功能紊乱[40],但肥胖可以损伤女性中这种内皮细胞源性超极化(EDH),内皮细胞MR敲除可以消除肥胖个体内皮细胞功能紊乱的发生,但雄性中没有观察到这种作用[40-41]。研究显示,机体内皮细胞的一氧化氮(NO)合成减少,会增加氧化物质的氧化应激,影响内皮细胞功能[42],进而产生胰岛素抵抗[43]。肥胖女性个体EDH缺乏,因此内皮细胞功能发生紊乱,造成胰岛素抵抗,使机体的代谢发生紊乱,而在男性中不存在这种风险。PA患者代谢改变的性别特异性还可能和机体性激素的改变有关,最近有研究发现PA患者中性激素水平与对照组相比有明显差异[44],研究纳入了85例PA患者、46例EH患者和76例正常个体作为对照,结果血清硫酸脱氢表雄酮(DHEA-S)在女性PA患者中较低,PA亚型中只有女性醛固酮腺瘤患者的DHEA-S水平较低。脱氢表雄酮(DHEA)及其硫酸盐衍生物硫酸脱氢表雄酮(DHEA-S)是灵长类动物肾上腺产生的,两者受到促肾上腺皮质激素(ACTH)的刺激,并由网状带分泌,其与机体代谢密切相关[45]。在本研究中年龄匹配的男性PA患者血压水平明显高于EH患者,而女性中糖代谢异常的比例明显高于EH患者,与上述文献观点相符。目前PA患者代谢紊乱的情况还不十分清楚,PA分型、瘦素、性激素等都与糖脂代谢密切相关。PA患者严重靶器官损害,在男性中主要由于高血压,而女性中除高血压外还可能与较重的代谢紊乱有关,PA患者代谢改变可能存在性别特异性。

表4 不同性别超重或肥胖PA和EH患者代谢相关指标检出率的比较〔n(%)〕Table 4 Comparison of detection rates of metabolic related parameters in overweight or obese PA patients and EH patients with different genders

表5 不同性别超重或肥胖患者血糖的影响因素的多元线性回归分析Table 5 Multivariate linear regression analysis of factors affecting blood glucose in overweight or obese patients
总之,研究发现,仅在肥胖女性PA患者中糖代谢异常的比例明显高于年龄匹配的EH患者,而男性未发现这种差异。在超重或肥胖的女性个体中,只有盐水后醛固酮与高血糖症独立相关,未发现血钾、血醛固酮与高血糖症的相关性。但在我们的研究中,PA患者按性别和是否肥胖分组后各亚组样本量相对较小,同时由于胰岛素、瘦素、性激素、PA分型等相关数据缺乏,我们没有对不同性别中糖脂代谢紊乱差异的可能原因进行深入分析。同时用BMI≥25 kg/m2标准定义女性超重或肥胖可能造成女性糖代谢异常比例相对较高,对于PA中不同性别代谢改变的情况仍需要进一步的体内外研究进行验证。
作者贡献:骆秦、李南方进行文章构思和设计、数据收集、统计分析,对文章进行批判性审查和修订;荣利伟进行文章撰写、设计、数据整理、统计分析及结果解释;王梦卉进行资料收集,参与数据初步统计分析和文章撰写;张德莲进行资料收集,并参与文章结果的解释;努尔比亚·阿不都塞拉木、陶维俊参与数据收集、数据初步整理及统计分析。
本文无利益冲突。

