大菱鲆幼鱼对饲料中泛酸最适需求量的研究*
王雅平 李宝山 王际英 王成强 王晓艳 王丽丽 王世信 孙永智 郝甜甜
大菱鲆幼鱼对饲料中泛酸最适需求量的研究*
王雅平1,2李宝山2王际英2①王成强2王晓艳2王丽丽1,2王世信2孙永智2郝甜甜2
(1. 上海海洋大学 水产科学国家级实验教学示范中心 农业农村部鱼类营养与环境生态研究中心 水产动物遗传育种中心上海市协同创新中心 上海 201306;2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006)
为研究大菱鲆()幼鱼对泛酸的最适需求量,在基础配方中添加不同梯度的泛酸钙,制成6组泛酸含量分别为6.24、10.64、15.02、23.81、41.40和76.57 mg/kg等氮等能实验饲料,投喂初始体重为(24.73±0.10) g的大菱鲆幼鱼80 d。结果显示:1)泛酸对幼鱼成活率(SR)无显著影响(>0.05),10.64~76.57 mg/kg饲料组增重率(WGR)和特定生长率(SGR)显著提高(< 0.05);泛酸含量超过23.81 mg/kg时,肝体比(HSI)显著降低(<0.05);2)随着饲料中泛酸含量的提高,全鱼粗蛋白、粗脂肪和肌肉粗蛋白均呈先升后降趋势,肝脏脂肪含量显著下降(<0.05);3)肠道消化酶、Na+, K+-ATPase和肝脏胆碱酯酶(ChE)活力随泛酸添加量的增加呈先上升后下降趋势,10.64~76.57 mg/kg饲料组肠道肌酸激酶(CK)活力显著提高(<0.05);4)血清、肝脏中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活力均呈先升后降趋势;6.24 mg/kg饲料组血清丙二醛(MDA)含量显著高于其他5组(<0.05);5)随泛酸含量的增加,肝脏脂肪合成酶(FAS)基因表达量先升后降,脂蛋白酯酶(LPL)基因表达量显著上升(<0.05)。研究表明,饲料中添加适宜的泛酸能显著增强大菱鲆幼鱼肠道消化、吸收能力和机体抗氧化能力,并可提高脂肪代谢相关基因的表达水平,从而提高其生长性能。以增重率为判据,经折线模型拟合得出,初体重为24.73 g的大菱鲆幼鱼对泛酸的需求量为16.08 mg/kg饲料。
大菱鲆;泛酸;生长性能;需求
泛酸(Pantothenic acid)又称维生素B5,是生物体必需的一种水溶性维生素(杨延辉等, 2008)。泛酸在生物体内主要以辅酶A(CoA)和酰基载体蛋白(Acyl carrierprotein, ACP) 2种活性形式存在,其主要代谢功能包括脂肪酸、胆固醇和类固醇的合成,参与能量代谢,合成抗体和乙酰化胆碱(Jobling, 2012; Zhu, 2004);泛酸还具有抗脂质过氧化作用,当泛酸不足时,过氧化物酶体脂肪酸β-氧化受到抑制,从而增加机体氧化损伤(Chen, 2015);除此之外,泛酸不足还会引起鱼体生长迟缓、厌食、棒状鳃、鳍条出血等器官病变,严重缺乏时还会导致鱼体死亡(Jobling, 2012)。目前,国内外对鱼类泛酸需求的研究较多,如黑带石斑鱼() (Lin, 2012)的泛酸需求量为11.0 mg/kg,宝石鲈() (宋理平, 2009)为12.40 mg/kg,大黄鱼()(张春晓, 2006)为11.20 mg/kg,真鲷() (Yano, 1988)为10 mg/kg,杂交条纹狼鲈(×) (Raggi,2016)为18.8 mg/kg。
大菱鲆(L)属鲽形目(Pleuronectiformes),鲆科(Bothidae),菱鲆属,俗称“多宝鱼”,是名贵的低温经济鱼类。自20世纪90年代引种到我国以来,已经在我国北方沿海地区大规模养殖(彭墨等, 2014; 陈慕雁等, 2005)。目前,关于大菱鲆维生素的研究主要集中在脂溶性维生素(牛化欣等, 2014),而在水溶性维生素方面研究较少(谢全森等, 2008)。泛酸是生物体必需的营养素,但在大菱鲆中尚未见对泛酸需求量的相关报道。因此,本研究以大菱鲆为研究对象,通过研究饲料中添加不同梯度的泛酸对其生长、体组成、饲料利用、抗氧化性能、脂肪代谢的影响,确定大菱鲆对饲料泛酸的最适需求量,为泛酸在大菱鲆的饲料研究与应用提供基础数据。
1 材料与方法
1.1 实验设计与饲料制作
以鱼粉、酪蛋白为主要蛋白源,鱼油为主要脂肪源,补充矿物质和维生素预混料(不含泛酸),配制成6组等氮等能的基础饲料(表1)。每千克基础饲料中分别添加0、5、10、20、40和80 mg的D-泛酸钙(购自盛瑞源生物科技公司,纯度>96%),命名为P1、P2、P3、P4、P5、P6组,P1为对照组。按实验配方将所需原料粉碎过80目筛,按比例称重混匀,加入鱼油及适量水再次混匀,经螺旋挤压机加工成粒径为3 mm的饲料颗粒,60℃烘干后放置-20℃冰箱备用。利用高效液相层析色谱(HPLC)测得实验饲料中泛酸的含量分别为6.24、10.64、15.02、23.81、41.40和76.57 mg/kg。
1.2 实验用鱼和饲养管理
实验所用大菱鲆幼鱼购自蓬莱宗哲养殖有限公司。养殖实验于2017年11月11日~2018年2月4日在山东省海洋资源与环境研究院室内循环水养殖系统进行。正式实验前挑选体质健壮的大菱鲆幼鱼暂养于圆形养殖桶(桶高80 cm,直径70 cm,水深50 cm)中,投喂P1组饲料驯化,14 d后挑选规格均匀的大菱鲆幼鱼[(24.73±0.10) g] 540尾,随机分配至18个养殖桶中,每桶30尾鱼,每种实验饲料随机投喂3个养殖桶的实验鱼。养殖实验进行80 d,每天投喂2次(08:00,16:00),初始日投喂量占体重的1.5%左右,并根据摄食情况及时调整投喂量。投喂30 min后排残饵,数颗粒,记录残饵数量。养殖期间,确保水质符合以下条件:水温(17.0±0.5)℃,盐度28~32,pH 7.6~ 8.2,溶氧>7.0 mg/L,氨氮浓度和亚硝酸<0.1 mg/L。
表1 实验饲料基础配方及营养成分(干物质%)

Tab.1 Formulation and nutrient composition of the basal experimental diets (dry matter %)
注: a. 矿物质预混料配方参考王际英等(2014). b. 维生素预混料(mg/kg饲料): 硫胺素,15 mg;核黄素,15 mg;烟酸,100 mg;吡哆醇,20 mg;氰钴胺,4 mg;生物素,1 mg;肌醇,200 mg;叶酸,5 mg;氯化胆碱,1000 mg;抗坏血酸,240 mg;维生素A,20 mg;维生素D,8 mg;维生素E,150 mg;维生素K,10 mg
Note: a. Same contents of mineral premix as reference Wang(2014). b. Vitamin mixture (mg/kg diet): Thiamin, 15 mg; Riboflavin, 15 mg; Niacin acid, 100 mg; Pyridoxine, 20 mg; Cyanocobalamin, 4 mg; Biotin, 1 mg; Inositol, 200 mg; Folic acid, 5 mg; Choline chloride, 1000 mg; Ascorbic acid, 240 mg; Retinol acetate, 20 mg; Cholecalciferol, 8 mg; Alpha-tocopherol, 150 mg; Vitamin K, 10 mg
1.3 样品采集
全鱼、背肌、肝脏、肠道及血清取样方法参考 梅琳等(2015)。
同时,每桶中随机取3尾实验鱼,无菌条件下解剖,取肝尖置于2 ml无RNase离心管中并迅速于液氮中速冻,–80℃超低温冰箱中保存,用于组织中相关基因的荧光定量分析。
1.4 测定指标与分析方法
1.4.1 生长指标计算
增重率(Weight gain rate WGR, %)=(鱼体末重–鱼体初重)/鱼体初重×100;
特定生长率(Specific growth rate, SGR, %/d) =(ln鱼体末重–ln鱼体初重)/养殖周期×100;
饲料系数(Feed conversion ratio, FCR)=摄食量/体增重×100;
摄食率 (Feed intake, FI, %/d)=摄食量/[(鱼体初重量+鱼体末重量)/2×养殖周期]×100
蛋白质效率(Protein efficiency ratio, PER)=(鱼体末重–鱼体初重)/蛋白质总摄入量;
脏体比(Viscerosomtic index, VSI)=内脏团湿重/鱼体末重×100;
肝体比(Hepatosomatic index, HSI, %)=肝脏湿重/鱼体末重×100;
肥满度(Condition factor, CF,)=鱼体末重/体长3× 100;
存活率(Survival rate, SR, %)=终末鱼尾数/初始鱼尾数×100。
1.4.2 体成分测定 实验饲料及体壁中水分用105℃恒重法测定(GB/T6435-2006),粗蛋白用凯氏定氮法测定(GB/T6432-2006),粗脂肪用索氏抽提法测定(GB/T6433-2006),粗灰分用550℃失重法测定(GB/T 6438-2007),能量用燃烧法测定(IKA, C6000, 德国)。
1.4.3 酶活测定 肠道淀粉酶(Amylase)、脂肪酶(Lipase)、胰蛋白酶(Trypsin)、Na+,K+-ATPase、肌酸激酶(Creatine Kinase,CK)活性、肝脏中胆碱酯酶(Acetylcholinesterase,AChE),血清和肝脏中超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase, CAT)活力及丙二醛(Malondialdehyde, MDA)含量均采用南京建成生物工程研究所试剂盒测定。酶活力单位参照试剂盒说明书。
1.4.4 肝脏脂代谢相关基因差异表达分析 按照TaKaRa公司的RNAiso Plus试剂盒说明书提取肝脏总RNA,通过电泳检测RNA的完整性,然后检测其纯度。最后,采用PrimeScript™ RT reagent Kit with gDNA Eraser反转录试剂盒合成cDNA,并置于–20℃待用。
使用Primer 5.0设计引物,同时设计引物作为内参,所有引物均由生工生物技术(上海)股份有限公司合成,引物序列参见表2。使用TaKaRa公司生产的SYBR® Premix ExTMⅡ试剂盒进行荧光定量PCR,具体步骤参见说明书。PCR程序为:95℃、30 s,1个循环;95℃、5 s,57℃、30 s,72℃、60 s共40个循环:95℃熔解曲线检测反应特异性。在本实验中,FAS、LPL、-的扩增效率分别是0.986、0.980、0.991。每个复孔设置参照基因,根据2-ΔΔCt计算法进行相对定量后,分析肝脏中FAS和LPL的相对表达量。
1.5 数据统计分析
采用SPSS18.0软件进行单因素方差分析(One-way ANOVA),差异显著(<0.05)时用Duncan’s检验进行多重比较分析。统计数据以平均值±标准差(Means± SD,=3)的形式表示。采用折线模型拟合得出大菱鲆幼鱼对饲料中泛酸基于增重率的最适需求量。
2 结果
2.1 饲料泛酸含量对大菱鲆幼鱼生长性能、饲料利用及形体指标的影响
由表3可见,添加泛酸对大菱鲆幼鱼的存活率(SR)无显著影响(>0.05),均在98%以上。随饲料泛酸含量的增加,大菱鲆幼鱼的增重率(WGR)和特定生长率(SGR)均呈先上升后下降趋势,P3、P4组显著高于其他组(<0.05),各添加组均显著高于对照组(<0.05)。各添加组的饲料系数(FCR)和摄食率(FI)呈先降后升趋势,且均显著低于对照组(>0.05)。添加组蛋白质效率(PER)显著上升(<0.05),在P3组达到最大。添加泛酸对脏体比(VSI)和肥满度(CF)无显著影响(>0.05),肝体比(HSI)呈先下降后上升趋势,P4和P5组显著低于其他各组(<0.05)。
表2 定量PCR引物序列
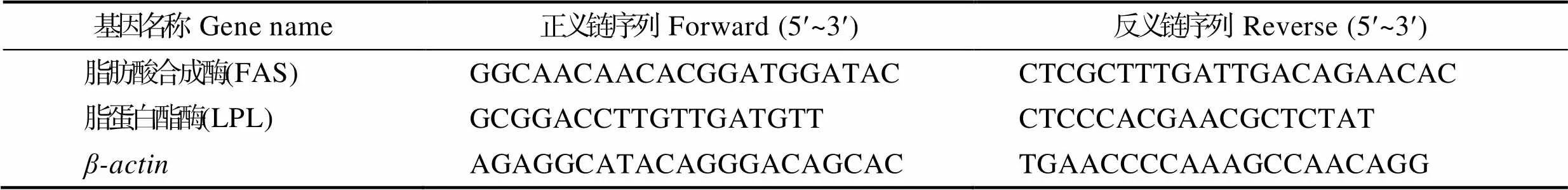
Tab.2 Nucleotide sequences of the primers used to assay gene expression by real-time PCR
表3 饲料泛酸含量对大菱鲆幼鱼生长性能、饲料利用及形体指标的影响

Tab.3 Effects of dietary pantothenic acid on growth performance, feed utilization and body indices of juvenile S. maximus
注: 同一行肩标不同表示不同组间差异显著(<0.05),下表同
Note: Values within the same row with different letters are significantly different (<0.05). The same as the following
采用折线模型分析方法,拟合增重率与饲料中泛酸含量的关系:初始体重为(24.73±0.10) g的大菱鲆幼鱼饲料中泛酸的最适含量为16.08 mg/kg (图1)。
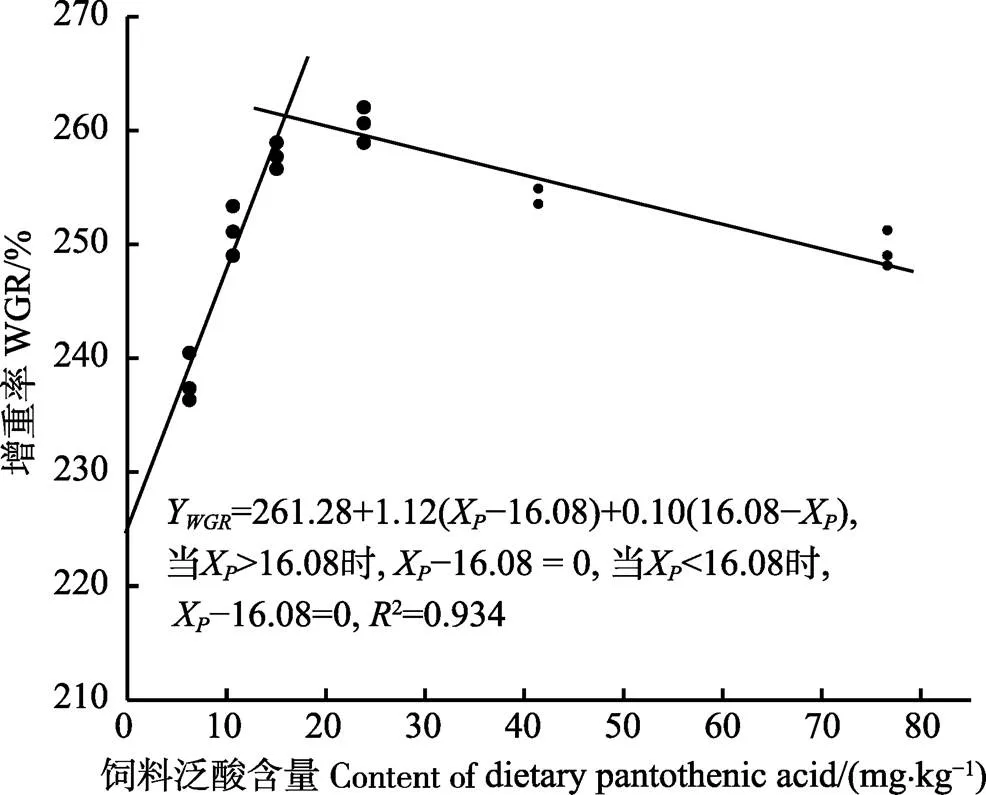
图1 大菱鲆幼鱼增重率与饲料泛酸含量的折线回归分析
2.2 饲料泛酸含量对大菱鲆幼鱼体组成的影响
饲料中添加泛酸对大菱鲆幼鱼体组成的影响见表4。由表4可知,全鱼体组成中,水分含量在77.59%~ 79.51%之间,且各组之间无显著差异(>0.05);粗脂肪含量先上升后下降,P3组达到最大值;随着泛酸含量的增加,粗蛋白和粗灰分显著上升,最终呈平稳趋势。肌肉体组成中,水分含量无显著差异(>0.05);P3和P4组粗蛋白含量显著高于其他组(<0.05);粗脂肪及粗灰分含量差异不显著(>0.05);肝脏粗脂肪含量随泛酸的增加显著下降(<0.05)。
2.3 饲料泛酸含量对大菱鲆幼鱼消化相关酶活的影响
随着饲料泛酸含量的增加,大菱鲆幼鱼淀粉酶、脂肪酶和Na+,K+-ATPase活力呈先上升后下降趋势,P4组脂肪酶显著高于其他各组(<0.05),淀粉酶和Na+,K+-ATPase活力在P5组达到最大值。P5组胰蛋白酶活力显著高于其他组(<0.05)。各添加组肌酸激酶(CK)和胆碱酯酶(ChE)活力显著高于对照组(<0.05) (表5)。
2.4 饲料中泛酸含量对大菱鲆幼鱼肝脏和血清抗氧化能力的影响
随着饲料中泛酸含量的增加,肝脏中过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活力均呈先上升后下降趋势,P3-P6组丙二醛(MDA)含量显著低于对照组(<0.05)。血清中过氧化氢酶(CAT)活力随饲料泛酸含量的升高呈先升后降趋势,P4组达到最高值(< 0.05)。P2~P4组的超氧化物歧化酶(SOD)活力显著高于对照组(<0.05),并在P4组达到最大值。血清中丙二醛(MDA)含量随泛酸添加量的增加显著下降(< 0.05),P6组含量最低(表6)。
表4 饲料中泛酸水平对大菱鲆幼鱼常规成分的影响(%湿重)
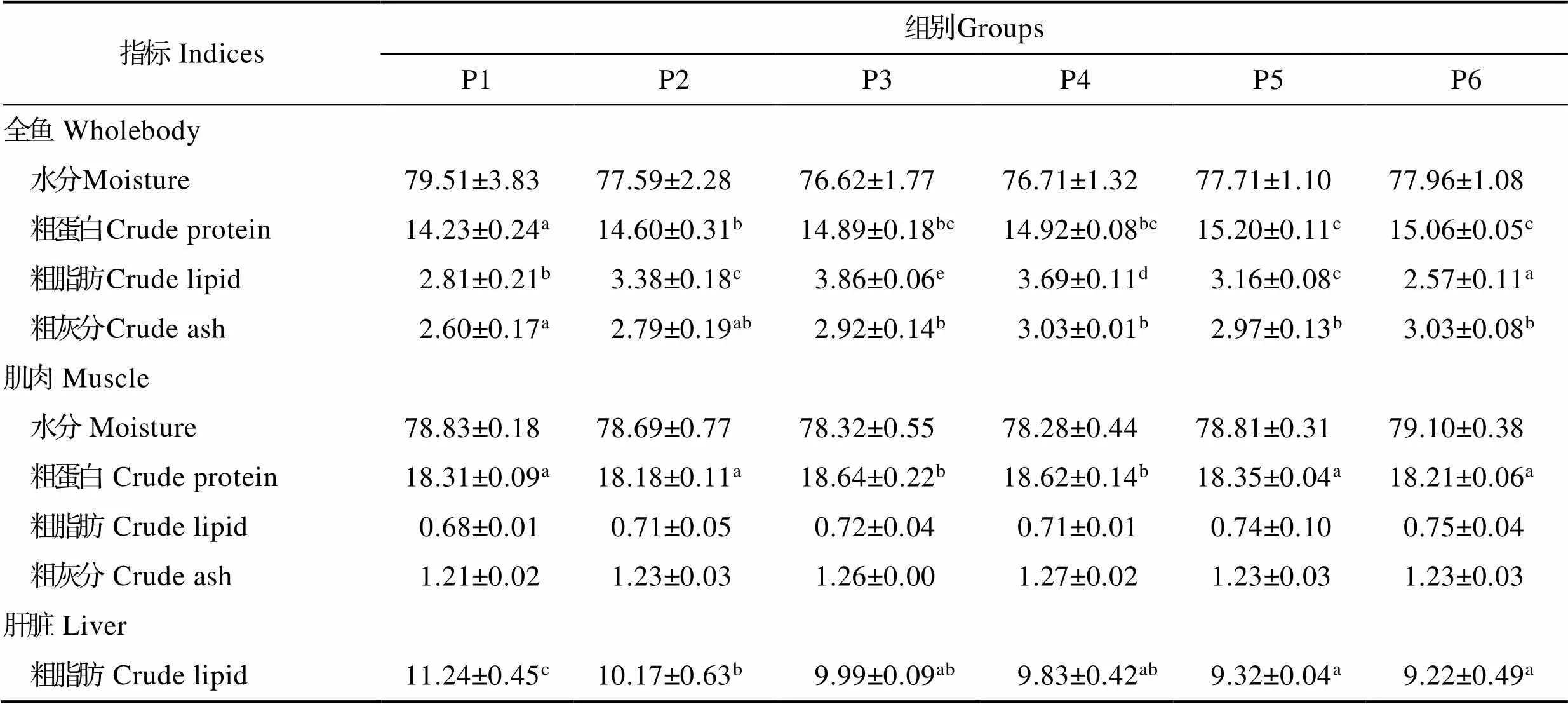
Tab.4 Effects of dietary pantothenic acid levels on proximate composition of juvenile S. maximus (% wet weight)
表5 泛酸对大菱鲆幼鱼肠道消化相关酶活的影响

Tab.5 Effects of pantothenic acid on the activities of intestinal digestive physiology and liver physiological enzymes of juvenile S. maximus
表6 泛酸对大菱鲆幼鱼肝脏和血清抗氧化能力的影响
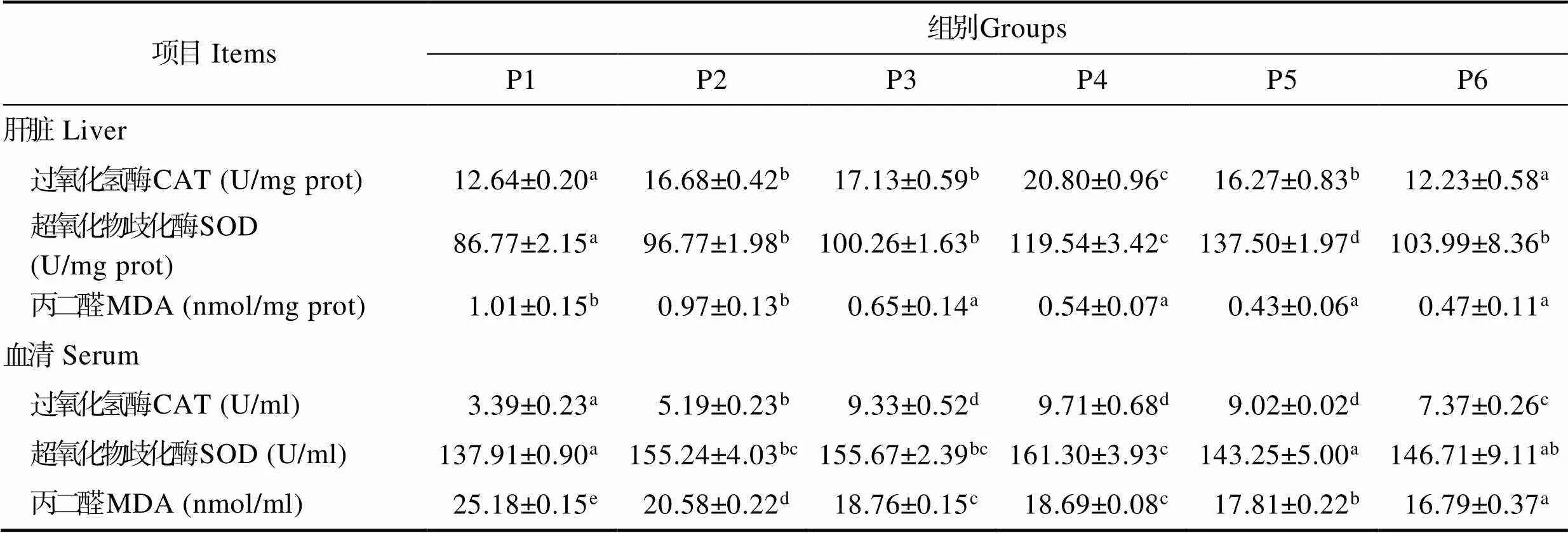
Tab.6 Effects of dietary pantothenic acid on liver and serum antioxidant capacity of juvenile S.maximus
2.5 饲料泛酸含量对大菱鲆幼鱼肝脏FAS和LPL相对表达量的影响
研究结果显示,大菱鲆肝脏脂肪合成酶(FAS)mRNA表达量随泛酸含量的增加呈先升后降趋势,P3、P4组显著高于P1、P6组(<0.05) (图2);脂蛋白酯酶(LPL)mRNA表达量随泛酸增加呈上升趋势,且P4到P6组显著高于其他组(<0.05) (图3)。
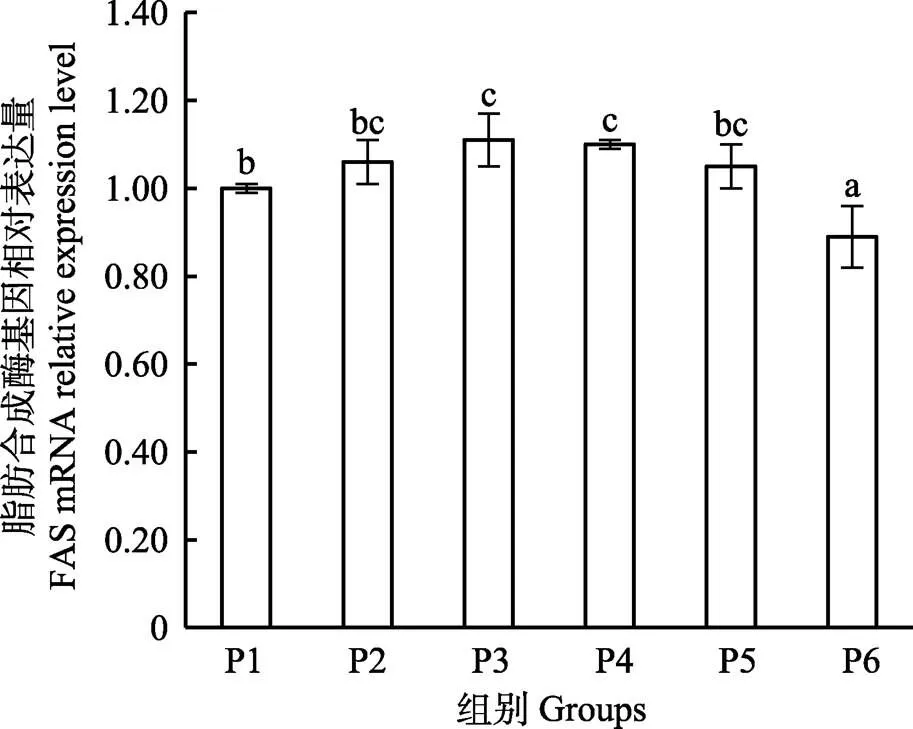
图2 肝脏脂肪合成酶基因相对表达量
标有相同上标字母的数值表示差异不显著(>0.05),下同
Values with the same letters are not significantly different at>0.05. The same as belwo

图3 肝脏脂蛋白酯酶基因相对表达量
3 讨论
3.1 饲料中添加泛酸对大菱鲆幼鱼生长性能、饲料利用、形体指标的影响

3.2 饲料中添加泛酸对大菱鲆幼鱼体组成的影响
体蛋白,体脂肪和体灰分沉积会造成水生动物的增重,饲料中主要营养物质的利用效率对水生动物生长有重要影响(Mommsen, 2001)。饲料泛酸水平对不同鱼种的体组成影响存在差异。研究表明,饲料泛酸显著影响翠鳢鱼体粗蛋白和粗灰分含量(Zehra, 2018),湖鳟脂肪含量随着饲料泛酸水平增加而增加(Poston, 1982)。本研究中,饲料中添加泛酸对全鱼和背肌水分无显著影响,当泛酸含量从6.24 mg/kg增加到41.40 mg/kg时,实验鱼体粗蛋白和粗脂肪积累增多,泛酸含量继续增加时,蛋白沉积受到抑制,与在草鱼(刘安龙等, 2007)、吉富罗非鱼(黄凤等, 2014)的研究结果类似。其促进蛋白和脂肪沉积的原因是:第一,泛酸以辅酶A的形式在蛋白质的合成和转运中发挥重要作用(Wen, 2009);第二,泛酸作为酰基载体蛋白的组成之一,调节脂肪的代谢(田娟等, 2009);第三,从本研究结果可知,泛酸可显著提高肠消化和吸收酶的活性,从而提高大菱鲆幼鱼对蛋白质、脂肪的消化吸收能力。P2~P5组全鱼粗灰分含量与P1组差异显著,这与吉富罗非鱼的研究结果一致(黄凤等, 2014),可能是泛酸提高了肠道对钙磷的吸收,促进了其在体内的蓄积(张璐等, 2016)。本研究结果显示,适宜的泛酸添加水平对大菱鲆背肌的粗脂肪和粗灰分的蓄积有一定的促进作用,但无显著差异。胆固醇和甘油三酯主要在肝脏内合成,P1组肝脏脂肪含量显著增加,可能是因为泛酸不足影响到脂肪酸氧化,造成多余脂肪在肝脏中沉积(黄凤等, 2014)。该结果与石斑鱼的研究结果类似(Lin, 2012)。
3.3 饲料中添加泛酸对大菱鲆幼鱼肠道消化相关酶的影响
化学性消化是水生动物的主要消化方式,而消化酶在其中发挥重要作用。肠上皮营养物质消化是消化酶催化ATP结合的过程,其活力可直接揭示鱼类的消化能力(Qian, 2015)。本研究中,摄食缺乏泛酸的饲料降低了蛋白酶、淀粉酶和脂肪酶活力,表明泛酸缺乏导致鱼体肠道消化功能受阻。随着泛酸含量从6.24 mg/kg增加到41.40 mg/kg,肠道消化酶活力显著增加,表明泛酸是维持鱼类肠道消化功能的重要营养物质,这可能是因为肠道功能与组织CoA的含量成正比,泛酸作为CoA的组成成分,参与蛋白质和脂质的代谢和转运,提高消化酶活性,增强蛋白质等营养物质在体内的消化利用率(Qian, 2015; Feng, 2013)。Na+-K+泵主要由肠上皮刷状缘细胞表面存在的ATP酶构成,其活性可以间接反映肠黏膜的吸收功能(Almansa, 2001)。肌酸激酶参与细胞内能量转运和ATP再生(Tang, 2009)。本研究中,泛酸添加量超过10.64 mg/kg时,Na+,K+-ATP酶和CK活力显著上升。说明适宜水平的泛酸可以通过提高肠道Na+,K+-ATP酶活性提高ATP水解能力,并使CK的活力增强,为氨基酸、葡萄糖等营养物质在肠内的转运提供能量,从而促进营养物质在肠道的消化和吸收。这与文泽平(2008)对建鲤的研究结果相一致。泛酸在乙酰胆碱的合成中承担重要作用,而胆碱酯酶能迅速破坏组织内的乙酰胆碱。添加组ChE活力显著高于P1组。可能是脂肪代谢的增加导致肝脏中酰基CoA增多,继而产生大量的乙酰胆碱,过多的底物诱导ChE活力增强(杜金梁等, 2017)。
3.4 饲料中添加泛酸对大菱鲆幼鱼肝脏和血清抗氧化酶的影响
体内抗氧化酶(SOD-CAT)系统可以清除体内自由基,对维持机体正常代谢和生理功能有重要作用。SOD-CAT系统代表机体抵抗氧化应激和增加抗自由基酶活性的第一道防线(Liu, 2007)。SOD-CAT系统代表机体抵抗氧化应激与增加抗自由基酶活性的第一道防线(Winston, 1991),本研究结果显示,饲料中添加一定量的泛酸后,能显著提高肝脏和血清中的CAT活性,与对团头鲂的报道一致(Qian, 2015)。本研究中,肝脏和血清SOD活性均在对照组中最低,当饲料泛酸添加量超过23.81 mg/kg时,二者表现出不同的变化趋势:血清中的SOD活性呈下降趋势,肝脏中的SOD活力继续上升。说明饲料中过多的泛酸降低了血清的抗氧化能力。凡纳滨对虾() (袁野等, 2016)、团头鲂(Qian, 2015)的研究中也有类似报道。脂质过氧化产生的MDA含量可以反映机体受自由基攻击程度,MDA从膜上产生的位置释放后,可与蛋白质、核酸反应,进而抑制蛋白质的合成(李涌泉等, 2008)。本研究结果显示,添加量超过10.64 mg/kg时,肝脏MDA含量显著下降,而泛酸水平超过6.24 mg/kg时,血清中MDA含量显著下降。这一结果与在凡纳滨对虾(袁野等, 2016)、鲤鱼(Li, 2015)上的研究一致。Ayyat等(2011)的研究发现,CoA通过增强脂肪酸的代谢来清除脂质过氧化物。表明适宜水平的泛酸可以抵抗脂质过氧化和保护组织。
3.5 饲料中泛酸含量对肝脏FAS和LPL相对表达量的影响
鱼体脂肪沉积主要是受体内脂肪合成、降解和转运共同调控的结果。因此,测定鱼类肝脏中脂肪代谢相关基因的表达量,可以有效地反映鱼体脂肪沉积情况(徐超等, 2016)。FAS是脂肪酸从头合成的限速酶,对体内脂肪从头合成发挥主导作用(Guo, 2007)。本研究中,随着泛酸含量的增加,FAS表达量呈先升后降趋势,这表明适量泛酸能够提高肝脏中FAS的表达水平;这也暗示适量的泛酸可能促进机体脂肪的合成水平,类似的结果在团头鲂中也有报道(Qian, 2015)。LPL促进组织对脂肪酸的摄取,进而增强对肝脏脂肪酸的β-氧化能力(朱定贵等, 2011)。本研究结果显示,相比对照组,P4~P6组的LPL表达量显著升高,同时,鱼体肝脏粗脂肪含量减少,产生这一结果的原因可能是由于LPL表达量的增加,提高了脂肪的氧化代谢速率,同时FAS表达量显著降低,使得肝脏脂肪合成量下降。这一研究结果与瓦氏黄颡鱼()的研究结果一致(覃川杰等, 2015)。
4 结论
综上所述,泛酸是大菱鲆幼鱼维持正常生长和生理所必需的维生素。饲料中适宜水平的泛酸可以增强机体消化吸收和清除自由基的能力,并能影响肝脏中脂肪代谢相关基因的表达水平。以增重率为评价指标,24.73 g大菱鲆幼鱼最适泛酸需求量为16.08 mg/kg饲料。
Almansa E, Sanchez J, Cozzi S,. Segmental heterogeneity in the biochemical properties of the Na+,K+-ATPase along the intestine of the gilthead seabream (L.). Journal of Comparative Physiology B Biochemical Systemic & Environmental Physiology, 2001, 171(7): 557
Ayyat MS, El-Marakby HI, Sharaf S. Effect of dietary protein level, stocking density, and dietary pantothenic acid supplementation rate on performance and blood components of nile tilapia. Journal of Applied Aquaculture, 2011, 23(2): 122–135
Chen MY, Zhang XM, Lian JH. Development of some digestive enzymes and alkaline phosphataseActivities in turbotlarvae and juveniles. Periodical of Ocean University of China (Natural Science), 2005, 35(3): 483–486 [陈慕雁, 张秀梅, 连建华. 大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化. 中国海洋大学学报(自然科学版), 2005, 35(3): 483–486]
Chen YQ, Zhao SP, Zhao YH. Efficacy and tolerability of coenzyme A vs pantethine for the treatment of patients with hyperlipidemia: A randomized, double-blind, multicenter study. Journal of Clinical Lipidology, 2015, 9(5): 692–697
Du JL, Cao LP, Jia R,. Effects of rhizoma alismatis extract on biochemical index and CYP1A protein expression of hepatocyte steatosis injury induced by oleic acid in Jian Carp (var. Jian). Southwest China Journal of Agricultural Sciences, 2017, 30(1): 226–232 [杜金梁, 曹丽萍, 贾睿, 等. 泽泻提取物对油酸诱导建鲤脂肪肝细胞损伤中生化指标及CYP1A蛋白表达的影响. 西南农业学报, 2017, 30(1): 226–232]
Feng L, Peng Y, Wu P,. Threonine affects intestinal function, protein synthesis and gene expression of TOR in Jian Carp (var. Jian). PLoS One, 2013, 8(7): e69974
Guo F, Cavener DR. The GCN2 eIF2α Lpha kinase regulates fatty-acid homeostasis in the liver during deprivation of an essential amino acid. Cell Metabolism, 2007, 5(2): 103–114
Huang F, Jiang M, Wen H,. Dietary pantothenic acid requirement of GIFT tilapia (). Journalof Fisheries of China, 2014, 38(9): 1530–1537 [黄凤, 蒋明, 文华, 等. 吉富罗非鱼对饲料中泛酸的需要量. 水产学报, 2014, 38(9): 1530–1537]
Jobling M. National Resarch Council (NRC): Nutrient requirements of fish and shrimp. Aquaculture International, 2012, 20(3): 601–602
Liu AL, Wen H, Jiang M,. Dietary Pantothenic Acid Requirement of Grass Carp () Fingerlings. Fisheries Science, 2007, 26(5): 263–266 [刘安龙, 文华, 蒋明, 等. 草鱼幼鱼对饲料中泛酸需要量的研究. 水产科学, 2007, 26(5): 263–266]
Liu Y, Wang WN, Wang AL,. Effects of dietary vitamin E supplementation on antioxidant enzyme activities in(Boone, 1931), exposed to acute salinity changes. Aquaculture, 2007, 265(1–4): 351–358
Li L, Feng L, Jiang WD,. Dietary pantothenic acid deficiency and excess depress the growth, intestinal mucosal immune and physical functions by regulating NF-κB, TOR, Nrf2 and MLCK signaling pathways in grass carp (). Fish & Shellfish Immunology, 2015, 45(2): 399–413
Li YQ, Wang L, Liu N,. Effects of cadmium on enzyme activity and lipid peroxidation in freshwater crab. Acta HydrobiologicaSinica, 2008, 32(3): 373– 379 [李涌泉, 王兰, 刘娜, 等. 镉对长江华溪蟹酶活性及脂质过氧化的影响. 水生生物学报, 2008, 32 (3): 373–379]
Liu K. Studies on nutritional physiology of pyridoxine, myo- inositol and Pantothenic acid for cobia. Master’s Thesis of Ocean University of China, 2008 [刘凯. 军曹鱼()吡哆醇、肌醇和泛酸营养生理的研究. 中国海洋大学硕士研究生学位论文, 2008]
Lin Y, Lin H, Shiau S,. Estimation of dietary pantothenic acid requirement of grouper,according to physiological and biochemical parameters. Aquaculture, 2012(324–325): 92–96
Mei L, Zhou HH, Mai KS,. Effects of dietary substitution of fishmeal by fermented silkworm pupae on the growth, feed intake, digestion and immunity of juvenileturbot (L.). Progress in Fishery Sciences, 2015, 36(3): 85– 92 [梅琳, 周慧慧, 麦康森, 等. 蛹肽蛋白替代鱼粉对大菱鲆(L.)幼鱼生长、饲料利用、消化代谢酶及免疫性能的影响. 渔业科学进展, 2015, 36(3): 85–92]
Mommsen TP. Paradigms of growth in fish. Comparative Biochemistry and Physiology Part B, 2001, 129(2–3): 207– 219
Niu HX, Lei JL, Chang J,. Effect of a vitamin E- supplemented high-fat diet on the growth, lipidmetabolism and antioxidant function of turbot (L.). Journal of Fishery Sciences of China, 2014, 21(2): 291–299 [牛化欣, 雷霁霖, 常杰, 等. 维生素E对高脂饲料养殖大菱鲆生长、脂类代谢和抗氧化性能的影响. 中国水产科学, 2014, 21(2): 291–299]
Poston HA, Page JW. Gross and histological signs of dietary deficiencies of biotin and pantothenic acid in lake trout,. Cornell Veterinarian, 1982, 72(3): 242
Peng M, Xu W, Mai KS,. Growth performance, fatty acids composition and lipid deposition injuvenile turbot () fed diets with various fish oil substitution levels by linseed oil. Journal of Fisheries of China,2014, 38(8): 1131–1139 [彭墨, 徐玮, 麦康森, 等. 亚麻籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂肪沉积的影响. 水产学报, 2014, 38(8): 1131–1139]
Qian Y, Li XF, Zhang DD,. Effects of dietary pantothenic acid on growth, intestinal function, anti-oxidative status and fatty acids synthesis of juvenile blunt snout bream. PLoS One, 2015, 10(3): e0119518
Raggi T, Buentello A, Gatlin DM,. Characterization of pantothenic acid deficiency and the dietary requirement of juvenile hybrid striped bass,.. Aquaculture, 2016: 326–329
Stowell SL, Iii DMG. Effects of dietary pantethine and lipid levels on growth and body composition of channel catfish,. Aquaculture, 1992, 108(1–2): 177–188
Song LP. Study of nutritional requirement of jade perch. Doctoral dissertation of Shandong Normal University, 2009 [宋理平. 宝石鲈营养需求的研究. 山东师范大学博士研究生学位论文, 2009]
Tan CJ, Shao T, Yang JP,. The effect of starvation on lipid metabolism of darkbarbel catfish,, Acta HydrobiologicaSinica, 2015, 39(1): 58–65 [覃川杰, 邵婷, 杨洁萍, 等. 饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响. 水生生物学报, 2015, 39(1): 58–65]
Tian J, Leng XJ, Li XQ,. Effect of dietary carnitine on growth performance, body composition and lipid metabolism enzymes of grass carp,. Journal of Fisheries of China, 2009, 33(2): 295–302 [田娟, 冷向军, 李小勤, 等. 肉碱对草鱼生长性能、体成分和脂肪代谢酶活性的影响. 水产学报, 2009, 33(2): 295–302]
Tang L, Wang GX, Jiang J,. Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp (var. Jian). Aquaculture Nutrition, 2009, 15(5): 477–483
Wen ZP, Zhou XQ, Feng L,. Effect of dietary pantothenic acid supplement on growth, body composition and intestinal enzyme activities of juvenile Jian carp (var.). Aquaculture Nutrition, 2009, 15(5): 470–476
Winston GW, Giulio RTD. Prooxidant and antioxidant mechanisms in aquatic organisms. Aquatic Toxicology, 1991, 19(2): 137– 161
Wen ZP. Effect of pantothenic acid on functions of digestion, absorption and immune of juvenile Jian carp (varJian). Master’s Thesis of Sichuan Agricultural University, 2008 [文泽平. 泛酸对幼建鲤消化吸收功能和免疫功能的影响. 四川农业大学硕士学位研究生论文, 2008]
Xu C, Li XF, Tian HY,. Effects of feeding rates on plasma lipid profiles and the mRNA expressions ofgenes related to lipid metabolism in juvenile blunt snout bream (). Journal of Fisheries of China, 2016, 40(11): 1732–1741 [徐超, 李向飞, 田红艳, 等. 不同投饵率对团头鲂幼鱼血脂水平及脂肪代谢相关基因表达的影响. 水产学报, 2016, 40(11): 1732–1741]
Xie QS, Li JW, Yang ZC. Japanese flounder fish vitamins and trace elements in the nutritional needs of progress. Modern Agricultural Science and Technology, 2008(12): 5–7 [谢全森, 李俊伟, 杨振才. 鲆鲽鱼类维生素及微量元素营养需求研究进展. 现代农业科学, 2008(12): 5–7]
Yano T, Nakao M, Furuichi M,. Effects of dietary choline, pantothenic acid and vitamin C on the serum complement activity of red sea bream. Nippon Suisan Gakkaishi, 1988, 54(1): 141–144
Yuan Y, Huang XL, Lu Y,. Effects of different dietary pantothenic acid levels on growth performance, feed utilizationand serum indices of juvenile. Journal of Fisheries of China, 2016, 40(9): 1349–1358 [袁野, 黄晓玲, 陆游, 等. 饲料中不同泛酸水平对凡纳滨对虾生长性能、饲料利用及血清指标的影响. 水产学报, 2016, 40(9): 1349–1358]
Yang YH, Xiao CL. The functions and biosynthesis of pantothenate. Chemistry of Life, 2008, 28(4): 448–452 [杨延辉, 肖春玲. 泛酸的功能和生物合成. 生命的化学, 2008, 28(4): 448–452]
Zehra S, Khan MA. Dietary pantothenic acid requirement of fingerling(Bloch) based on growth, feed conversion, liver pantothenic acid concentration and carcass composition. Aquaculture Nutrition, 2018, 1–8
Zhu W, Mai KS, Tan BP,. Dietary pantothenic acid requirement of juvenile abalone,Ino// International Symposium on Abalone Biology, Fisheries and Culture. 2004: 1045–1049
Zhu DG, Chen T, Xie RT,. Fatty acid composition injuveniles and female broodstock of yellow catfishin spawning season. Fisheries Science, 2011, 30(8): 482–484 [朱定贵, 陈涛, 谢瑞涛. 瓦氏黄颡鱼稚鱼和生殖季节雌鱼的脂肪酸组成研究. 水产科学, 2011, 30(8): 482–484]
Zhang CX. Studies on nutritional physiology of major B vitamins and mineral-phosphorus for large yellow croaker,R. and Japanese seabass,. Doctoral dissertation of Ocean University of China, 2006 [张春晓. 大黄鱼、鲈鱼主要B族维生素和矿物质–磷的营养生理研究. 中国海洋大学博士学位研究生论文, 2006]
Zhang L, Jing LI, Mai K,. Effects of different dietary vitamin D contents on growth performance, calcium and phosphorus metabolism of juvenile Japanese seabass (). Chinese Journal of Animal Nutrition, 2016, 28(5): 1402–1411 [张璐, 李静, 麦康森, 等. 饲料中不同维生素D含量对鲈鱼幼鱼生长性能和钙磷代谢的影响. 动物营养学报, 2016, 28(5): 1402–1411]
Study on the Optimum Dietary Pantothenic Requirement of Juvenile Turbot (L.)
WANG Yaping1,2, LI Baoshan2, WANG Jiying①, WANG Chengqiang2, WANG Xiaoyan2, WANG Lili1,2, WANG Shixin2, SUN Yongzhi2, HAO Tiantian2
(1. National Demonstration Center for Experimental Fisheries Science Education, Centre for Research on Environmental Ecology and Fish Nutrion (CREEFN) of the Ministry of Agriculture and Rural Affairs Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306; 2. Shandong Key Laboratory of Marine Ecological Restoration, Shandong Marine Resource and Environment Research Institute, Yantai 264006)
An 80-day feeding trial was conducted to investigate the pantothenic acid dietary requirements of juvenile turbot. Six isoenergetic and isonitrogenous diets were formulated using fish meal and casein as a protein source. The basal diet was supplemented with calcium D-pantothenic acid at 6.24, 10.64, 15.02, 23.81, 41.40, or 76.57 mg/kg and fed to juveniles weighing (24.73±0.10) g. The results were as follows: 1) No significant differences in juvenile turbot survival rate (SR) were found between the dietary treatments (>0.05) and the weight growth rate (WGR) and specific growth rate (SGR) increased as pantothenic acid levels increased from 10.64 to 76.57 mg/kg (<0.05). For dietary pantothenic acid content greater than 23.81 mg/kg, the hepatosomatic index decreased significantly (<0.05). 2) The crude protein and lipid levels of the whole body and crude protein levels of the muscle initially increased and then decreased with increasing dietary pantothenic acid levels, whereas the crude lipid content of the liver decreased (<0.05). 3) The activities of the intestinal digestive enzymes Na+, K+-ATPase and hepatic cholinesterase (ChE) initially increased and then decreased with increasing dietary pantothenic acid levels, whereas intestinal creatine kinase (CK) activity increased significantly from 10.64 to 76.57 mg/kg (<0.05). 4) Hepatic and serum catalase (CAT) and superoxide dismutase (SOD) activities were significantly lower in the control group than in the groups with calcium pantothenic acid-enriched diets (<0.05). Turbot fed a 6.24 mg/kg pantothenic acid diet had a higher serum malondialdehyde content than those fed other diets (<0.05). 5) Fatty acid synthetase (FAS) expression increased and then decreased with increasing levels of pantothenic acid. Lipoprotein lipase (LPL) expression was significantly up-regulated in the liver with increasing levels of pantothenic acid (<0.05). In conclusion, appropriate levels of dietary pantothenic acid significantly improved intestinal digestion and absorption capacity, thus, improving nonspecific immunity and the expression of fat-related genes, and consequently, the growth and body composition of juvenile turbot. Based on broken-line regression analysis of WGR, the optimum dietary pantothenic acid requirement of juvenile turbot with a body weight of 24.73 g was 16.08 mg/kg.
Juvenile turbot; Pantothenic acid; Growth performance; Requirement
S963
A
2095-9869(2019)06-0066-10
10.19663/j.issn2095-9869.20180821001
http://www.yykxjz.cn/
王雅平, 李宝山, 王际英, 王成强, 王晓艳, 王丽丽, 王世信, 孙永智, 郝甜甜. 大菱鲆幼鱼对饲料中泛酸最适需求量的研究. 渔业科学进展, 2019, 40(6): 66–75
Wang YP, Li BS, Wang JY, Wang CQ, Wang XY, Wang LL, Wang SX, Sun YZ, Hao TT. Study on the optimum dietary pantothenic requirement of juvenile turbot (L.). Progress in Fishery Sciences, 2019, 40(6): 66–75
* 山东省重点研发计划(2016GSF115005)和烟台市科技计划(2018ZHGY066)共同资助 [This work was supported by Shandong Key Research and Development Plan (2016GSF115005), and Science and Technology Development Project of Yantai (2018ZHGY066)]. 王雅平,E-mail: m15552437686@163.com
王际英,研究员,E-mail: ytwjy@126.com
2018-08-21,
2018-09-21
WANG Jiying, E-mail: ytwjy@126.com
(编辑 江润林)

