非洲紫罗兰花梗高频再生体系的建立
李 莺,张玉姣、瞿亚梅、屈 雯、杨帅帆
(西安文理学院 生物与环境工程学院,秦岭野生观赏植物研究中心,陕西 西安 710065)
非洲紫罗兰(SaintpauliaionanthaWendl)又名非洲苦苣苔,系苦苣苔科多年生常绿宿根草本花卉。非洲紫罗兰品种繁多,其株型小巧,花色多种多样,一年开花3~4次,是深受大众喜爱的观赏花卉之一,非洲紫罗兰一般在人工栽培条件下,授粉率结实率很低,不易得到种子,且其繁殖周期长,不能满足市场的大量需求,因此,采用组培快繁是解决其繁殖的有效途径之一[1]。
目前,有关非洲紫罗兰的研究主要集中于组织培养、生理生化、花色机理、栽培管理和转基因技术等方面。我国从20世纪80年代到现在一直在开展非洲紫罗兰的组织培养及工厂化育苗的研究工作,但主要集中在以其叶片为外植体进行离体培养[2],而采用花梗进行离体培养方面的研究未见报道,因此我们在前人研究的基础上,采用花梗为外植体进行离体组织培养,以期获得高频的再生体系。
1 材料与方法
材料引自陕西省西安市朱雀花卉市场,品种'Diana'。
1.1 外植体的消毒与培养
选取适量非洲紫罗兰的总花梗作为外植体置于烧杯中,用纱布封口后流水冲洗3h,转移至超净工作台。先在70%乙醇中浸泡10s,无菌水中冲洗2次,然后用2%的次氯酸钠溶液灭菌5 min,再用无菌水冲洗3次,用无菌滤纸将消毒完成的外植体上的残留液体吸干。花梗切成0.5~1 cm左右的小段,接种后将培养皿放置在PQX-330A-22H多段人工气候培养箱内培养,光照12 h·d-1,光照强度40~50 mol m-2s-1,光照培养温度为25±1℃,暗培养温度为18±1℃,培养湿度为60%。
1.2 初代培养
将微量元素中的硫酸锰减少到1/4的改良MS作为为基本培养基,将已消毒的花梗切成小段接种在以下四种培养基中:① 改良的MS+1.0 mg·L-16-BA + 0.1 mg·L-1IBA(以下单位相同);② 改良MS+6-BA2.0+ IBA0.2;③ 改良MS+6-BA1.0 +NAA0.1;④ 改良MS+6-BA2.0+NAA0.2。每组培养基接种6个培养皿, 每个培养皿接种4~6个小段,观察并统计出愈率。
出愈率=(诱导出愈伤组织外植体数/接种外植体数)×100%
1.3 继代培养
将诱导出愈伤组织的外植体进行继代培养,在③号改良MS+ 6-BA1.0 + NAA 0.1培养基,上进行不定芽的诱导及增殖培养,观察并统计出芽率及增殖系数。出芽率=(诱导出不定芽外植体数/接种外植体数)×100%,增殖系数=继代后的芽苗数/继代前的芽苗数。
1.4 生根培养
将已长出4片及以上真叶的不定芽挑出接种在以下生根培养基中:⑤ MS+ NAA0.1;⑥ MS+ NAA0.5;⑦ MS+NAA0.5+ IAA0.5,观察并统计生根率。
生根率=(生根的外植体数/接种外植体数)×100%
1.5 炼苗移栽
选取生长健壮、生根良好的试管苗,打开瓶盖,炼苗3~5 d。移栽于草炭和蛭石1:1的基质上,统计其成活率。
2 结果与分析
2.1 初代培养
将总花梗分别接种到四组培养基中培养,30 d观察到花梗诱导出少量愈伤组织,愈伤组织紧密,黄绿色,60 d统计结果见表1。
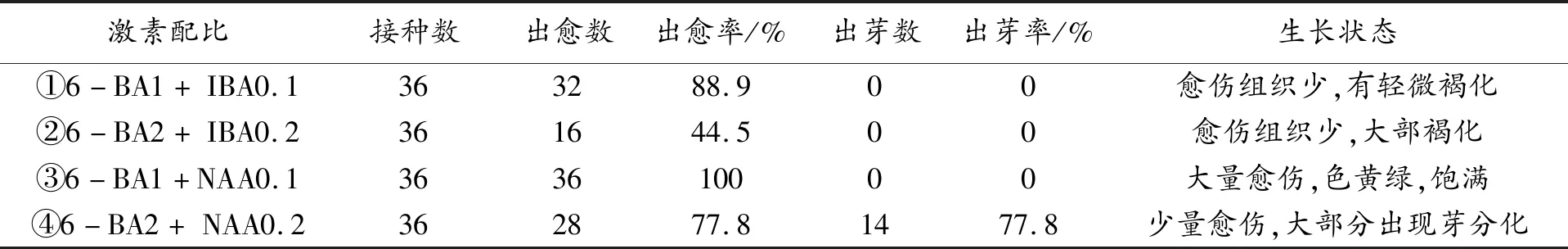
表1 不同激素配比对花梗诱导愈伤组织的影响
30 d,四组培养基中总花梗均诱导出少量愈伤组织,其中③号最先出现紧密型愈伤组织。60 d观察,①号培养基内仅有少量水浸状愈伤组织且有轻微褐化,如图1-a;②号培养基内愈伤组织不明显,大部分褐化,如图1-b;③号培养基内所有花梗均诱导出浅绿色紧密型愈伤组织,即出愈率100%,且愈伤组织形态饱满充盈,没有褐化现象,如图1-c;④号培养基内仅有少量愈伤组织,但已有芽分化,部分外植体完全褐化,诱导出少量愈伤组织后均分化出不定芽,所以出愈率和出芽率均为77.8%,如图1-d。
实验表明:③号培养基是总花梗诱导愈伤组织的最适培养基,④号培养基是总花梗快速诱导芽分化的较适培养基。
2.2 继代培养
将总花梗诱导出的愈伤组织转移至③号即改良的MS+6-BA1.0+NAA0.1上进行继代培养。30 d观察,所有的继代的愈伤组织均分化出不定芽,出芽率高达100%,且每块愈伤组织平均分化5~6个芽,60 d则观察每块可高达50~60个芽,增殖系数近10倍,增殖的不定芽叶片极小,如图1-e.f。因此,改良的MS+6-BA1.0+NAA0.1是优质的芽增殖培养基。
2.3 生根培养
将继代增殖培养产生不定芽小苗接种到3种生根培养基中诱导生根。30 d统计结果见表2。

表2 不同浓度植物生长调节剂生根的影响
30 d时,三组培养基内的所有不定芽均已生根。其中⑤号培养基,不定芽明显增高,较纤细,叶片微卷,基部少量褐化,根浓密较短;⑥号培养基中,不定芽植株矮小,叶片形状不规则,大叶极大,小叶极小,根浓密较短,⑦号培养基中,植株矮小,基部少量褐化,根毛浓密。由表4可看出,三组培养基均能诱导不定芽生根,因此, NAA在0.1~0.5 mg·L-1范围内均适宜诱导生根。
2.4 炼苗移栽
选择生长一致的试管苗,移栽于草炭和蛭石1:1的基质上,60 d后统计其成活率高达95.33%,见图1-h。
3 讨论与结论
多数关于非洲紫罗兰的组织培养实验中都选择了叶片作为外植体,幼嫩叶片是优良的外植体[1]。例如黄靖[3]在使用叶片和茎段作为外植体诱导愈伤组织时,35 d叶片诱导率为100%,而茎段为0%;吴丽芳[4]等人的研究表明,70 d叶片的诱导率达64.7%,叶柄的诱导率仅有8.4%,而以其花梗为外植体进行组织培养的研究未见报道,本实验在前人研究的基础上采用总花梗作为外植体进行组织培养研究,实验结果表明:非洲紫罗兰的总花梗也是一种适合于组培快繁的外植体。
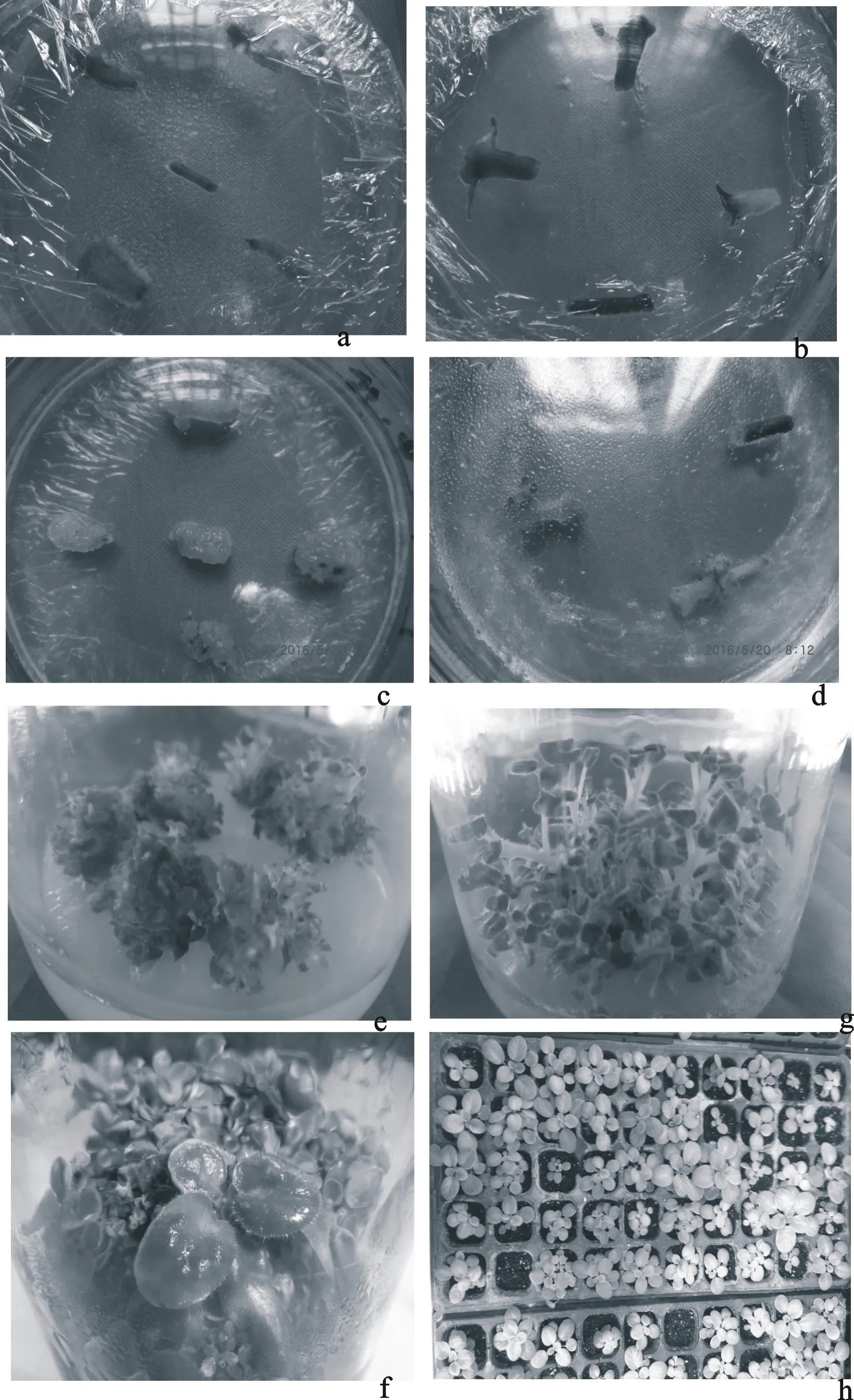
图版1非洲紫罗兰花梗组织培养
a.①号培养基诱导愈伤组织;b.②号培养基诱导导愈伤组织;c.③号培养基诱导导愈伤组织;d.④号培养基诱导愈伤组织和不定芽; e增殖培养1; f增殖培养 2; g诱导不定芽生根 h炼苗移栽的试管苗
初代培养中所使用的四组培养基中,通过比较①、③组和②、④组,在6-BA浓度相同的情况下,6-BA与NAA配比出愈率高于6-BA 与IBA配比,说明6-BA与NAA的配比组合是最适宜的。这与张晓军[5]等人的实验表明6-BA与NAA的搭配优于KT与NAA的搭配及ZT与NAA的搭配,即6-BA与NAA配比组合是最适宜的观点一致。而比较①、②组和③、④组,随着6-BA浓度由1 mg·L-1增加到2 mg·L-1时,NAA或IBA由0.1 mg·L-1增加到2 mg·L-1时,愈伤组织诱导率反而下降,说明, 6-BA1.0 mg·L-1与NAA0.1 mg·L-1为诱导愈伤组织的最适配比,与黄靖[3]、赵兴兵[6]、耿明清[7]等人的结论一致。
总之,非洲紫罗兰的花梗是理想的外植体。改良的MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA培养基既适宜初代培养又适宜继代培养,初代培养出愈率高达100%,继代培养中可再分化不定芽,出芽率100%,在改良的MS+ NAA0.1-0.5 mg·L-1范围均可诱导生根,生根率100%,试管苗移栽到草炭和蛭石1:1的基质上成活率高达95.33%。

