辛伐他汀-胶原蛋白海绵用于大鼠直接盖髓后牙髓中VEGF、BMP-2的表达
关为群 张杨安 李群 刘玲玲
牙髓是位于牙髓腔内疏松的结缔组织,其对外来刺激能产生一系列的防御反应。对于外伤、龋病、机械性露髓的患牙,希望通过有效的盖髓材料覆盖于牙髓的暴露处,以消除感染、充分调动牙髓组织的再生修复能力,从而促进牙髓愈合,保存牙髓活力。研究发现,在牙髓损伤愈合的过程中有众多的细胞因子参与如FGF-2、BMPs、VEGF等[1-2],这些细胞因子在促进牙髓细胞增殖、分化以及修复性牙本质形成方面起着重要的作用[3-4]。
辛伐他汀是临床上治疗胆固醇高血脂症、动脉粥样硬化的一线药物。近年来发现辛伐他汀除了降低血脂的作用外还具有促进牙髓细胞的增殖和分化,血管再生,抵抗炎症反应等作用。本课题组前期体外实验也发现辛伐他汀对牙髓细胞增殖和分化具有积极的作用[5],因此本研究将进一步体内检测辛伐他汀直接盖髓术后牙髓组织VEGF及BMP-2的表达情况,对辛伐他汀促进牙髓细胞损伤后修复机制进行初步的探讨。
1 材料与方法
1.1 实验动物及分组
8周龄成年雄性SD大鼠(上海斯莱克实验动物有限公司)120只,清洁级,体重(200±5)g,口腔卫生状况良好,无龋齿及牙周疾病。本实验经福建医科大学动物实验伦理委员会批准。将上述的120只大鼠分为3组,即辛伐他汀-胶原蛋白海绵组(SIM组)、胶原蛋白海绵组(CS组)及氢氧化钙组(CH组),每组40只。每只大鼠左上颌第一磨牙为实验牙,并设对侧上颌第一磨牙为正常对照牙。
1.2 主要的试剂与材料
辛伐他汀(Sigma,美国);Ca(OH)2(上海二医张江生物材料有限公司);胶原蛋白溶液(北京科劳得生物制品技术开发有限公司);乙二胺四乙酸二钠(上海国药集团化学试剂有限公司);DG16探针(北京鑫兴嘉业商贸有限公司);玻璃离子(富士公司,日本)。VEGF兔多克隆抗体及BMP-2兔多克隆抗体(Abcam公司,英国);ElivisionTMplus免疫组化试剂盒及DAB显色剂(福州迈新生物技术开发有限公司)。
1.3 辛伐他汀-胶原蛋白复合海绵的制备
准确称取25 mg辛伐他汀将其溶解在0.2 ml的无水乙醇中,然后加入浓度为0.2 mol/L的氢氧化钠0.3 ml,在50℃下加热2 h后,用1 N盐酸中和到pH为7.2,用 PBS定容至1 ml,终浓度为60 mmol/L作为母液,4℃下储存,使用前取母液1.67μl,加入到100 ml的胶原蛋白溶液中,磁力搅拌器下搅拌均匀,终浓度为1μmol/L,将搅拌均匀的混合液倒入六孔板中,并置于-80℃冰箱中冷冻12 h,随后转入到冷冻干燥机中在抽真空的状态下冷冻干燥24 h,即得到辛伐他汀-胶原蛋白复合海绵。在无菌操作台上将复合物剪成0.5 mm3的小块,经60Co辐照灭菌处理后放于4℃冰箱中冷藏保存、备用。
1.4 实验动物模型的建立
按3 ml/kg的剂量于大鼠腹腔注射10%水合氯醛麻醉大鼠,取仰卧位将其固定在手术台上,3%过氧化氢和生理盐水交替冲洗口腔,用0.5%的碘伏消毒口腔及其周围组织,用1/4号球钻在用水冷却的条件下于左上颌第一磨牙的咬合面中央窝处间断钻磨,直至窝洞底透出粉红色,随后换用DG16探针轻轻穿髓,穿髓孔的直径为0.35 mm,以见到轻微出血点作为穿髓成功的标准。生理盐水冲洗窝洞,无菌小棉球除去多余水分。分别将制备好的氢氧化钙、辛伐他汀-胶原蛋白复合海绵以及胶原蛋白海绵覆盖于穿髓孔处,尽量不向髓腔方向加压,严密封闭穿髓孔,玻璃离子充填,适当降低双侧下颌第一磨牙,整个实验严格按照无菌操作进行。术后第1、3、7、14、28天各组随机选取8只,采用心脏灌注的方法处死大鼠,迅速分离出含有第一磨牙的上颌骨,立即置于4%多聚甲醛中继续体外固定48 h。
1.5 组织标本的制备及免疫组化染色
将固定好的标本放入10%的EDTA(pH=7.4)溶液中,25℃恒温下进行脱钙,脱钙时间为12周,流水冲洗12 h,去除玻璃离子,梯度乙醇脱水,正丁醇透明,浸蜡,常规石蜡包埋,制作平行于牙体长轴方向做近远中向连续切片,厚度为4μm,用于免疫组化染色。采用Elivision方法进行免疫组化染色。所用VEGF抗体浓度为1∶600,BMP-2抗体浓度为1∶300,均设阳性及阴性对照。DAB显色,苏木素复染,脱水,透明,中性树胶封片,显微镜下观察。
1.6 结果判断和图像分析
结果判断:VEGF阳性染色主要定位于细胞质或细胞膜中,而BMP-2阳性染色主要定位于细胞质中,呈清晰棕色或棕褐色为阳性。以染色深浅作为阳性强度的判定标准,强阳性、阳性、弱阳性、阴性表达分别为深棕黄色、棕黄色、浅黄色、无着色。
图像分析:随机选取通过穿髓孔且冠根完整的切片,每组各5张,在高倍镜下,随机选3个不重复的阳性区域,运用Image-Pro Plus 6.0图像分析软件测量其平均吸光度值(A值),并取均值,数据用表示。
1.7 统计学分析
应用SPSS 19.0软件统计分析,对实验数据进行正态性及方差齐性检验,若资料服从正态分布且方差齐同,则对同一时间点不同处理组先进行单因素方差分析(one-factor ANOVA),若结果具有统计学差异,则进一步采用LSD-t检验进行两两分析;此外,各实验组不同时间点与正常对照之间采用Dunnett-t检验,若资料非正态分布或(和)方差不齐则采用秩和检验。按α=0.05水准,P<0.05为差异具有统计学意义。
2 结 果
2.1 VEGF、BMP-2正常牙髓组织中的表达情况
在正常的牙髓组织中VEGF在血管内皮细胞中呈阳性表达,而牙髓细胞及成牙本质细胞则无表达。而BMP-2在正常的牙髓组织中均未出现表达,呈阴性表达(图1)。
2.2 VEGF在实验组牙髓组织中的表达情况
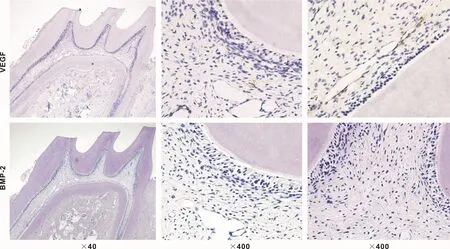
图1 VEGF、BMP-2在正常牙髓组织中的表达情况Fig 1 VEGF and BMP-2 expression in normal dental pulp tissue
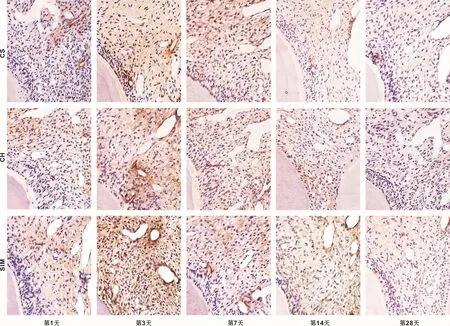
图2 VEGF在实验组牙髓组织中的表达情况 (×400)Fig 2 VEGF expression in experimental dental pulp tissue (×400)
图2示,术后第1天:穿髓点下方血管轻度扩张,血管内皮细胞呈强阳性表达,成纤维细胞的胞质中出现着色呈阳性表达,中性粒细胞弱表达,成牙本质细胞则无表达。术后第3天:中性粒细胞及内皮细胞都呈强阳性表达,血管扩张、增生,成牙本质细胞呈阳性表达,成纤维细胞表达数量增多,呈强阳性表达。术后第7天:血管增生,内皮细胞呈强阳性表达,新分化的成牙本质样细胞呈阳性表达,成纤维细胞增殖区呈阳性表达。术后第14天:血管内皮细胞和成纤维细胞表达减弱,呈阳性表达,成牙本质细胞弱阳性表达,新形成的修复性牙本质下方排列较为整齐的成牙本质样细胞呈弱阳性表达。术后第28天:实验组表达情况与正常对照组的相似,血管内皮细胞呈阳性表达,而成牙本质细胞及成纤维细胞均呈阴性表达。
2.3 BMP-2在实验组牙髓组织中的表达情况
图3示,术后第1天:穿髓孔周围的血管内皮细胞呈强阳性表达,少量的成纤维细胞出现表达呈弱阳性,而成牙本质细胞则无表达。术后第3天:血管内皮细胞呈强阳性表达,成纤维细胞表达数量增加以及浸润的中性粒细胞都呈阳性表达,成牙本质细胞开始表达呈弱阳性。术后第7天:穿髓孔下方及周围的血管内皮细胞呈强阳性表达,成纤维细胞及成牙本质细胞强阳性表达且阳性细胞数量明显增加,新生的成牙本质细胞样细胞呈阳性表达。术后第14天:成牙本质细胞样细胞以及两侧成牙本质细胞表达均有所减弱,血管内皮细胞及成纤维细胞呈阳性表达。术后第28天:牙髓组织恢复正常,基本检测不到BMP-2的表达。
2.4 图像分析统计结果
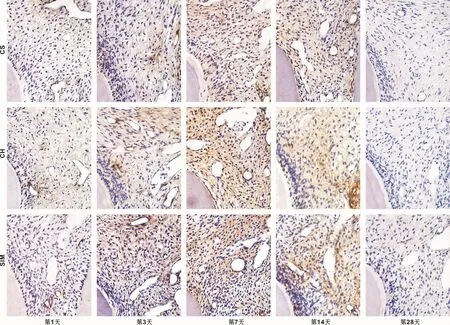
图3 BMP-2在实验组牙髓组织中的表达情况 (×400)Fig 3 BMP-2 expression in experimental dental pulp tissue (×400)
表1 3组盖髓术后VEGF阳性染色A值 ()Tab 1 A value of VEGF positive staining of three direct pulp capping groups ()
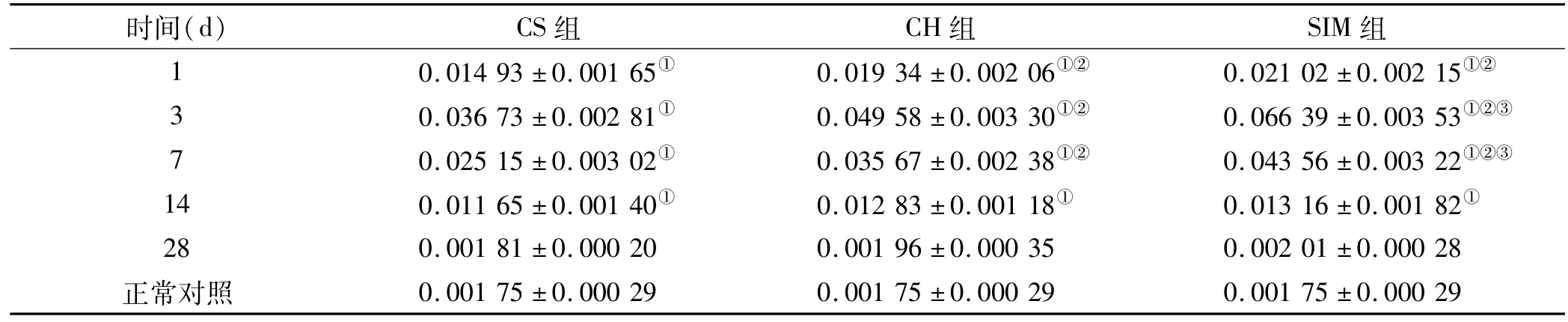
表1 3组盖髓术后VEGF阳性染色A值 ()Tab 1 A value of VEGF positive staining of three direct pulp capping groups ()
注:①与正常对照相比,P<0.05;②与CS组相比,P<0.05;③与CH组相比,P<0.05
时间(d) CS组 CH组 SIM组1 0.014 93±0.001 65① 0.019 34±0.002 06①② 0.021 02±0.002 15①②.000 29 0.036 73±0.002 81① 0.049 58±0.003 30①② 0.066 39±0.003 53①②③7 0.025 15±0.003 02① 0.035 67±0.002 38①② 0.043 56±0.003 22①②③14 0.011 65±0.001 40① 0.012 83±0.001 18① 0.013 16±0.001 82①28 0.001 81±0.000 20 0.001 96±0.000 35 0.002 01±0.000 28正常对照 0.001 75±0.000 29 0.001 75±0.000 29 0.001 75±0 3
表2 3组盖髓术后BMP-2阳性染色A值 ()Tab 2 A value of BMP-2 positive staining of three direct pulp capping groups ()

表2 3组盖髓术后BMP-2阳性染色A值 ()Tab 2 A value of BMP-2 positive staining of three direct pulp capping groups ()
注:①与正常对照相比,P<0.05;②与CS组相比,P<0.05;③与CH组相比,P<0.05
时间(d) CS组 CH组 SIM组1 0.005 27±0.000 95① 0.005 63±0.001 12① 0.006 01±0.000 99①.000 20 0.012 39±0.001 50① 0.017 38±0.002 52①② 0.021 81±0.001 94①②7 0.034 11±0.002 81① 0.046 58±0.003 22①② 0.064 59±0.003 88①②③14 0.024 93±0.003 02① 0.034 98±0.002 85①② 0.042 09±0.003 32①②③28 0.000 68±0.000 15 0.000 74±0.000 19 0.000 81±0.000 18正常对照 0.000 63±0.000 20 0.000 63±0.000 20 0.000 63±0 3
正常对照组及各实验组盖髓术后不同时间点,VEGF、BMP-2阳性染色的平均光密度值如表1~2。实验组中VEGF、BMP-2的表达强度都呈现出先升高后降低的变化,VEGF在术后第3天达到峰值,而BMP-2在术后第7天达到最大值。统计结果表明,3组实验组VEGF、BMP-2在术后第1、3、7、14天的表达水平要高于正常对照组(P<0.05),但在术后第28天表达水平则无统计学意义(P>0.05)。SIM组及CH组中VEGF的表达量在术后第1、3、7天显著高于CS组,且差异具有统计学意义(P<0.05),此外,与CH组相比,SIM组在术后第3、7天,VEGF的表达水平更高(P<0.05)。术后第3、7、14天SIM组及CH组BMP-2的表达强度要高于CS组(P<0.05),而SIM组与CH组则在术后第7、14天表达存在显著差异,SIM组BMP-2表达要高于CH组(P<0.05)。
3 讨 论
血管生成是所有伤口愈合的关键步骤,同样牙髓血管生成也是牙齿修复的前提条件[6]。血管生成是一个多步骤的动态过程,有众多的细胞因子参与其中,而VEGF作为血管生成最为重要的调节因子之一,在血管的生成中具有重要的促进作用[7]。
研究发现,VEGF不仅能促进牙髓组织血管的形成,而且还参与了牙髓炎症的发展以及牙髓组织损伤后修复的过程中[8]。本实验研究结果表明在正常的牙髓组织中,VEGF有少量的表达,表明其可能参与了正常牙髓的生理过程。而且在直接盖髓术后第1~14天,实验组VEGF的表达水平均高于正常组,且VEGF表达阳性的细胞由起先血管内皮细胞到术后炎症细胞、成纤维细胞、成牙本质细胞均表达阳性,同时这一时间范围内是牙髓组织炎症反应及损伤修复的过程,说明VEGF在这一过程中起着一定的作用。VEGF参与牙髓炎症反应主要与其能上调基质金属蛋白酶的活性、增加血管的通透性,以及促进中性粒细胞、单核巨噬细胞的游走、趋化、聚集于损伤的部位有关[9-10]。此外,VEGF还可通过诱导牙髓血管形成,为损伤组织提供充足的血供和营养物质,促进牙髓细胞增殖、成骨分化、提高ALP的表达水平参与牙髓的修复[11]。VEGF促进炎症反应以及诱导牙髓血管生成、牙髓细胞增殖分化在一定程度上都有利于损伤牙髓的恢复。
本研究中,在盖髓术后1~14 d,SIM组VEGF的表达量要高于CS组及CH组,可知辛伐他汀具有促进牙髓组织VEGF的表达,而且其促进VEGF的表达能力要强于氢氧化钙。研究表明辛伐他汀能够促进包括牙髓细胞在内的多种细胞VEGF mRNA的表达[12],其促进牙髓细胞VEGF的表达可能与提高血红素加氧酶-1(hemeoxygenase-1,HO-1)的表达水平有关[13]。研究发现其还能通过提高VEGF的表达水平来促进糖尿病患者伤口的愈合以及去卵巢大鼠种植体周围骨组织的生成[14-15]。表明辛伐他汀可能通过提高牙髓组织VEGF的表达水平来促进受损牙髓组织的修复。
牙髓愈合的过程中,除了需要新生的血管为其提供氧气和营养物质外,还需要有能够促进修复性牙本质形成的细胞因子,而BMP-2在这一过程中起着重要的作用。早期的研究已证实BMP-2的表达从牙胚发育一直持续到成牙本质细胞分化完成;而且,在成牙本质细胞分泌的牙本质基质时BMP-2出现了表达上调[3];此外,有学者将BMP-2应用于直接盖髓术后,发现其可促进修复性牙本质形成[2]。这些都表明BMP-2在牙胚发育、成牙本质细胞分化以及牙本质形成方面扮演着十分重要的角色。
实验结果显示,盖髓术后第7天,牙髓炎症程度减轻、修复性牙本质开始形成时,BMP-2的表达达到了最大值,此时成牙本质细胞样细胞、成纤维细胞、成牙本质细胞都呈强阳性表达,而这一阳性表达一直持续到完整的修复性牙本质形成,表明BMP-2在牙髓损伤修复阶段能够促进修复性牙本质的形成。在盖髓术后1~14 d,SIM组BMP-2的表达强度要高于CS组,可知辛伐他汀-胶原蛋白复合海绵中促进牙髓损伤修复过程中BMP-2表达的主要成分是辛伐他汀。研究表明辛伐他汀在多种成骨细胞系及骨组织的愈合过程中均能提高BMP-2的表达水平[16]。其促进BMP-2的表达与其能抑制HMG-CoA还原酶和Rho(rhodostomin)相关激酶的活性,以及促进核结合因子al(core binding factors alpha 1,Cbfa1)的表达有关[17]。此外,在盖髓术后1~14 d,CH组BMP-2的表达水平要低于SIM组,可能与氢氧化钙的强碱性引起牙髓组织凝固坏死有关,研究表明将氢氧化钙与大鼠牙髓细胞一起培养时,牙髓细胞BMP-2表达水平出现降低[18],这也说明氢氧化钙的细胞毒性影响了牙髓细胞BMP-2的表达。
综上所述,辛伐他汀-胶原蛋白复合海绵促进牙髓组织愈合以及修复性牙本质的形成与其能显著提高牙髓损伤修复的过程中VEGF及BMP-2的表达水平有关。

