大鲵油的水酶法提取及精制过程中脂肪酸组成的变化
李 招,王建文,王建辉 *,王发祥,李向红,刘永乐,宁静恒,高慧峰
1长沙理工大学化学与食品工程学院,长沙 410114;2张家界金鲵生物工程股份有限公司, 湖南 张家界 427000
中国大鲵(Andriasdavidianus),隶属两栖纲、有尾目、隐鳃鲵科,又名“娃娃鱼”。大鲵具有“水中活人参”的美誉,且氨基酸及蛋白质组成与人体所需模式符合程度较高。目前,国内外对大鲵的研究主要集中于人工繁殖、养殖、资源状况等方面[1],对其资源综合利用研究甚少。Li等[2]发现大鲵油脂中富含多种不饱和脂肪酸(UFA),且UFA对抗衰老[3]、治疗心律不齐[4]、动脉粥样硬化[5]、烫伤、烧伤等作用显著[6],潜在利用价值较高。Luo等[7]通过气相色谱法确定出精制大鲵油中含有25种脂肪酸,Liu等[8]通过气相色谱-质谱法发现了草鱼肌肉中UFA含量较高,且MUFA和PUFA含量丰富。由此可知,大鲵油及草鱼油均具有丰富的脂肪酸,但至今对两者尚无系统比较研究。
水酶法提油是一种绿色健康的油脂提取技术,其具有操作简单,条件温和等优点。该法使用蛋白酶借助其良好的破乳效果,能促使与脂质相关的蛋白裂解,促进油滴的聚结和絮凝[9],在油脂工业中具有较广的应用前景[10]。Li等[11]以提油率为评价指标,分别利用五种蛋白酶提取三文鱼鱼皮油,试验结果表明木瓜蛋白酶提油率最佳。故本实验采用工艺条件温和的水酶法,采用木瓜蛋白酶提取大鲵油,通过正交试验确定水酶法的最优工艺,并比较研究大鲵油精制过程中脂肪酸的组成变化及其与精制草鱼油的差异,以期为大鲵油的开发利用提供理论依据。
1 材料与方法
1.1 主要材料与试剂
大鲵尾部组织由张家界金鲵生物工程股份有限公司提供,均是取自人工饲养大鲵,共3尾,体重为1.8~2.9 kg/尾;草鱼,市购,2.0 ± 0.5 kg/尾;木瓜蛋白酶(来源番木瓜):酶活为800 U/mg,Kayon酶制剂公司。
1.2 主要仪器设备
DS-1高速组织捣碎机,上海圣科仪器设备有限公司;PHS-3C型pH计,上海雷磁仪器厂;LG10-2.4A型高速离心机,北京京立离心机有限公司; YRE-2000B型旋转蒸发仪,巩义市予华仪器有限责任;Scion TQ GC-MS,美国布鲁克道尔顿公司,DK-98-ⅡA电热恒温水浴锅,天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 大鲵尾部脂肪组织粗脂肪含量的测定
粗脂肪含量测定:索氏提取法,参照GB/T5009.6-016。
1.3.2 大鲵油与草鱼油的提取
(1)大鲵油提取参考Bai等[12]方法,并稍作修改。具体方法如下:
将大鲵尾部组织清洗、绞碎,按料液比1∶10加入蒸馏水、匀浆、调节pH、加入一定酶,在适当的温度下酶解一定时间,灭酶,冷却、离心,分离,提取称重Q2,计算提取率W(W=Q2/Q1×100%,Q1为原料中大鲵粗脂肪的质量)。
(2)草鱼油提取工艺:参考Wang等[13]试验方法。
1.3.3 单因素试验
酶解pH:在物料比为1∶10,酶添加量0.75%,酶解温度55 ℃,酶解时间90 min的条件下,考察不同pH(5.5、6.0、6.5、7.0、7.5、 8.0)对粗大鲵油提取率的影响。
酶解温度:在物料比为1∶10,酶添加量0.75%,pH6.5,酶解时间90 min,考察不同温度(40、45、50、55、60、65 ℃)对粗大鲵油提取率的影响。
酶添加量:在物料比为1∶10,pH6.5,酶解温度55 ℃,酶解时间90 min,考察不同酶添加量(0、0.25、0.50、0.75、1.00、1.25%)对粗大鲵油提取率的影响。
酶解时间:在物料比为1∶10,酶解温度55 ℃,pH6.5,酶添加量0.75%,考察不同酶解时间(30、60、90、120、150、180 min)对粗大鲵油提取率的影响。
1.3.4 正交试验
在单因素实验的基础上,选择酶解温度、pH、酶添加量、酶解时间4个因素,采用L9(34)正交试验设计,以大鲵油提取率为指标,确定大鲵油提取的最佳工艺条件。
1.3.5 粗大鲵油理化指标的测定
酸值:热乙醇测定法,参照GB/5009.229-2016;
过氧化值:硫代硫酸钠滴定法,参照GB/T5009.227-2016;
碘值:硫代硫酸钠滴定法,参照GB/T5532-2008;
水分及挥发物含量:直接干燥法,参照GB/T5009.236-2016;
不溶性杂质:坩埚式过滤器法,参照GB/T15688-2008。
1.3.6 粗大鲵油/草鱼油的精制
参考Luo等[7]试验方法,并稍作修改,具体方法如下:
1.3.6.1 脱胶:称取一定量的粗大鲵油/草鱼油于锥形瓶中,在水浴中将油加热搅拌至70 ℃,然后按油量的1%缓慢加入浓度为40%的磷酸,70 ℃下均匀搅拌1 min,再以5 000 rpm离心25 min,分离出上层油样即为脱胶油。
1.3.6.2 脱酸:称取一定量的脱胶油,再按油量的0.07%加入浓度为200 g/L的氢氧化钠溶液,在水浴中加热搅拌至65 ℃,30 min后以5 000 rpm离心15 min,分离上层油样后再加入1 mL热的去离子水,洗去残留皂,反复3次,5 000 rpm离心15 min,分离上层油样即得脱酸油。
1.3.6.3 脱臭:在55 ℃水浴中,利用旋转蒸发仪对大鲵油/草鱼油旋蒸10 min,即得脱臭油。
1.3.7 GC-MS 检测
1.3.7.1 甲酯化条件
大鲵油:取油样0.6 mL于离心试管中,加入5 mL正己烷,摇匀,再加入 2 mol/L氢氧化钾-甲醇溶液0.25 mL,充分振摇30 s,放入离心机内离心1 min后,取上层液体,进行GC-MS色谱脂肪酸成分含量测定。
草鱼油:参考Wang等[13]试验方法。
1.3.7.2 GC-MS测定条件
色谱柱:Rxi-5ms 毛细管柱(30 m×0.25 μm×0.25 mm);柱初温:50 ℃,保持5 min,以10 ℃/min升至160 ℃,保持2 min,以5 ℃/min升至200 ℃,保持5 min,以2 ℃/min升至260 ℃,保持10 min,以5 ℃/min升至300 ℃,保持10 min;进样口温度:280 ℃,载气(He)流量:1.0 mL/min,采用分流模式进行,分流比为5∶1。离子源温度(EI):200 ℃,接口温度:200 ℃,扫描质量数范围:22.00~500.00 u;进样量:1 μL。
1.3.8 脂肪酸营养价值评价
大鲵油脂肪酸以及草鱼油脂肪酸致动脉粥样硬化指数(atherogenicindex,AI)和血栓形成指数(thrombogenic index,TI)的评价方法参考Zhang[14]的方法。
参考文献[14]大鲵油脂肪酸以及草鱼油脂肪酸致动脉粥样硬化指(atherogenicine AI)和血检形成指数(thrombogenic index,TI),来评价两种油对人类心血管疾病发生的影响。其中:
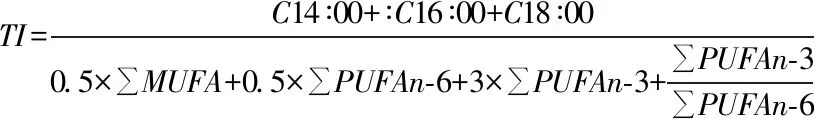
2 结果与分析
2.1 粗脂肪含量
经实验测定,大鲵尾部中粗脂肪含量为78.89%±0.24%,表明大鲵尾部粗脂肪含量较高,故可作为大鲵油提取的良好原料。
2.2 单因素试验
2.2.1 pH对大鲵油提取率的影响
pH对粗大鲵油提取率的影响如图2所示。随着pH增大,大鲵油提取率先升高后下降,pH在5.5~6.5时,提取率随着pH增大而增大,当pH为6.5时达86.69%;pH在6.5~8.0时提取率不断下降。木瓜蛋白酶pH为6~7,随着pH增大,会影响酶活性中心的构象,从而改变木瓜蛋白酶离子基团的离解状态,阻碍酶解反应的进行,导致提取率下降[15]。
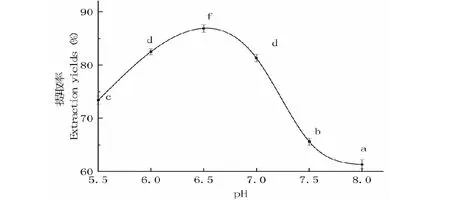
图1 pH对大鲵油提取率的影响Fig.1 Effect of different enzyme pH on extraction yield of Andrias davidianus oil 注:不同字母表示差异显著(P<0.05),下同。Note:Different letters means significant difference (P<0.05),the same below.
2.2.2 酶解温度对提取率的影响
温度对粗大鲵油提取率的影响如图2所示。随着酶解温度增大,大鲵油的提取率呈先上升后下降的趋势。当温度在44~55 ℃时,提取率随温度升高不断增大,达86.83%,而随酶解温度进一步上升,提取率呈下降趋势。究其原因可能是随初始温度升高酶解反应趋完全,但温度过高,会改变酶蛋白的结构,引起酶的失活,从而降低酶解效率,使提取率下降[16]。
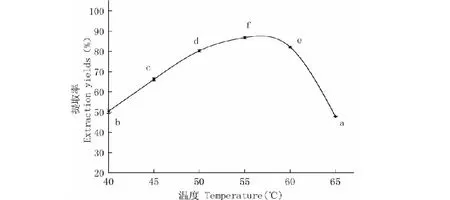
图2 酶解温度对大鲵油提取率的影响Fig.2 Effect of different enzyme temperatures on extraction yield of Andrias davidianus oil
2.2.3 酶添加量对提取率的影响
酶添加量对粗大鲵油提取率影响如图3所示。大鲵油提取率随着酶添加量的增加不断升高后趋于平稳。当酶添加量为0.75%时,提取率为85.56%,与未添加酶组相比(20.03%),增加了65%;当加酶量为1.00%时,提取率为85.93%,增长较为缓慢,酶添加量为1.25%时,提取率为84.20%。这是因为在底物未达到饱和时,酶量增加可促进蛋白质水解,提取率不断增大,当达到饱和后,由于酶自身的水解或者抑制作用,酶解程度降低[17],另外,过量的酶会与底物结合形成络合物对酶形成了反馈抑制,造成反应速率下降。
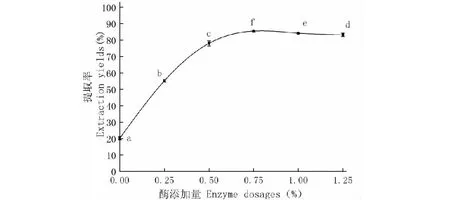
图3 不同酶添加量对大鲵油提取率的影响Fig.3 Effect of different enzyme dosages on extraction yield of Andrias davidianus oil
2.2.4 酶解时间对提取率的影响
酶解时间对粗大鲵油提取率的影响如图4所示。大鲵油的提取率随酶解时间的增加先升高后下降。酶解时间在30~120 min时,提取率随着时间的延长而增大,在120 min时,达86.69%;酶解时间在120~180 min时提取率不断下降。究其原因,随酶解时间的延长酶与底物间的反应越充分,从而释放出脂肪分子。随着酶解时间进一步延长,由于大鲵油中不饱和脂肪酸发生氧化,不利于营养物质的保持[18]。
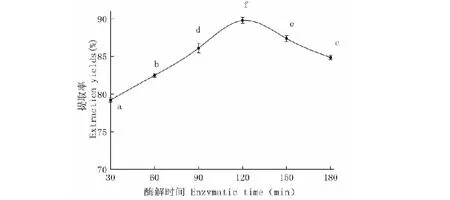
图4 酶解时间对大鲵油提取率的影响Fig.4 Effects of enzyme time on extraction yield of Andrias davidianus oil
2.3 正交试验
从表1可知,C(酶添加量)、A(酶解温度)、D(酶解时间)、B(pH)对大鲵油提取率的影响依次减小,正交试验的最佳组合为A3B2C1D1,即酶解温度60 ℃,pH 6.5,酶添加量0.75%,酶解时间90 min。
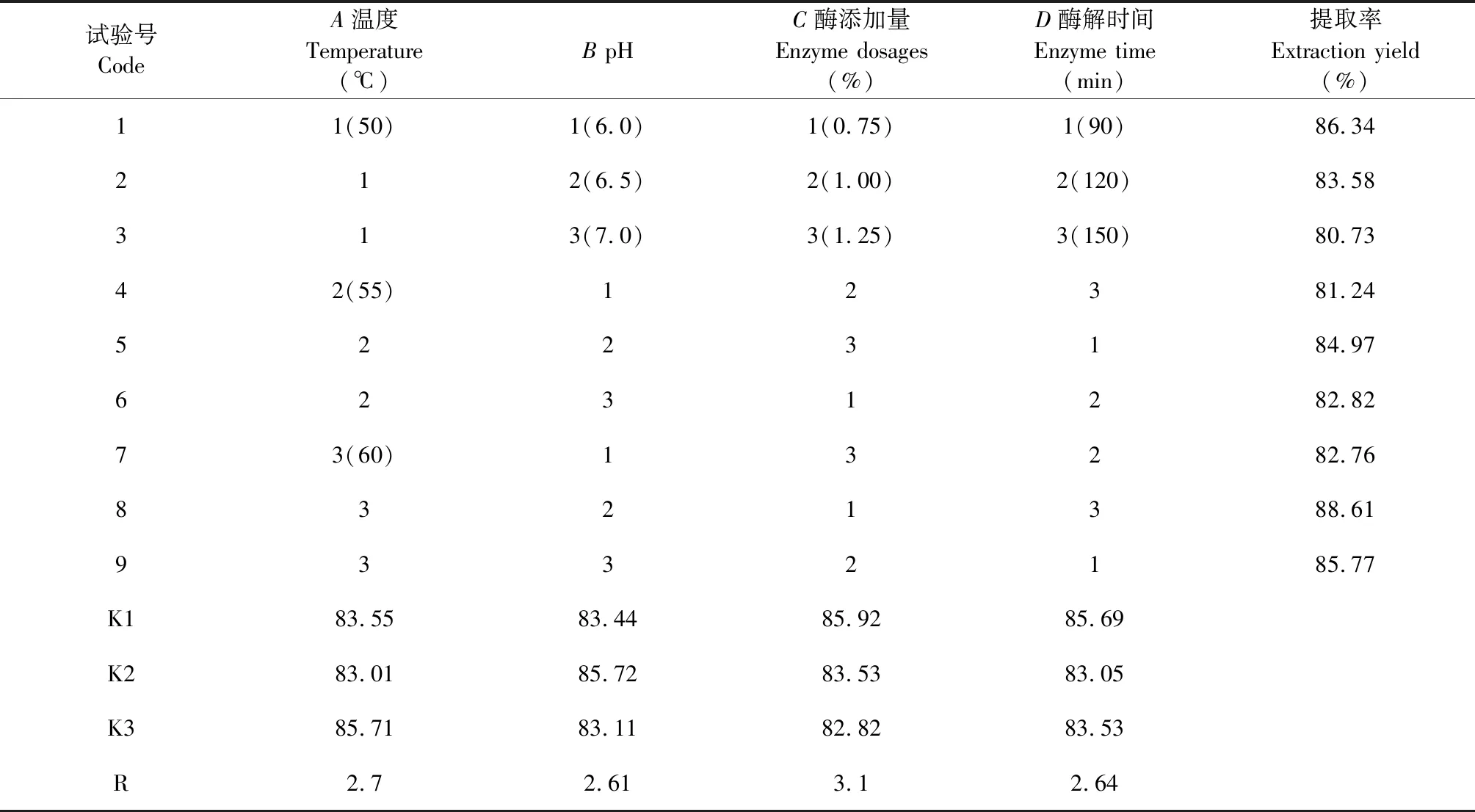
表1 正交试验设计及结果Table 1 Design and results of orthogonal test
2.4 优化反应条件的结果验证
按以上优化的提取条件(温度60 ℃,pH6.5,酶添加量0.75%,酶解时间90 min)进行三组平行试验验证,大鲵油提取率为89.34%±1.00%,表明试验优化的工艺条件可行。
2.5 大鲵油理化特性
所得粗大鲵油的感官指标及理化指标结果如表2所示,符合水产行业标准SC/T3502-2016所规定的粗鱼油二级标准。
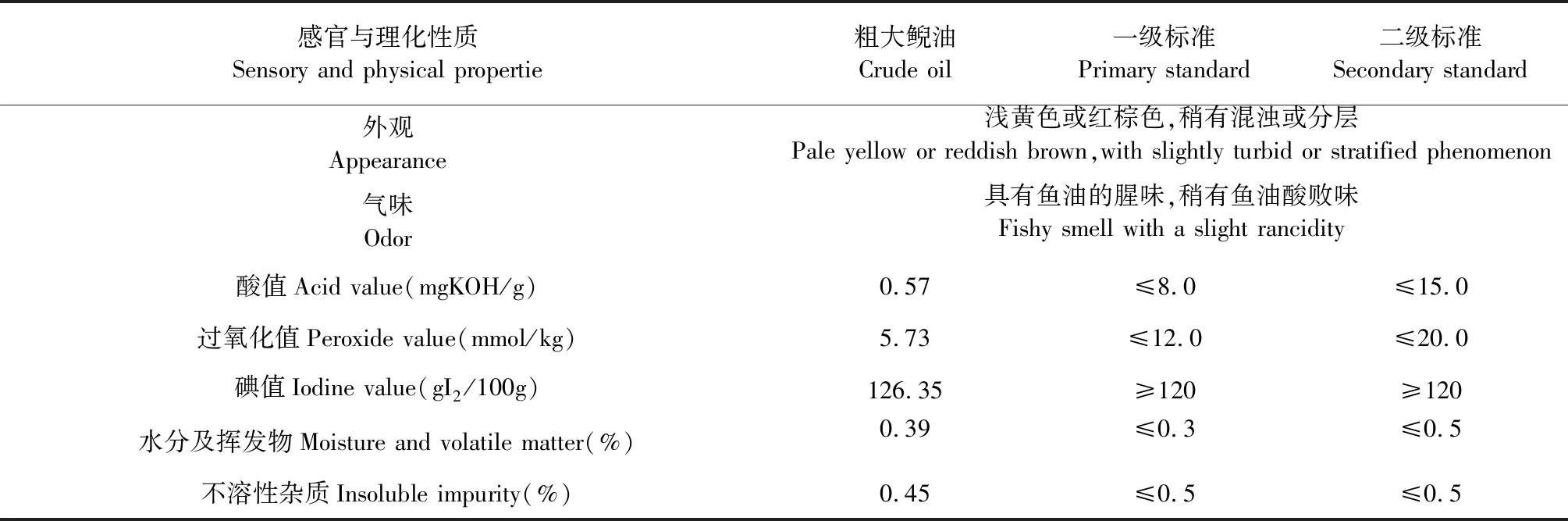
表2 粗大鲵的油的感官与理化指标Table 2 Sensory and physichemical indices of crude Andrias davidianus oil
2.6 脂肪酸组成分析
2.6.1 粗大鲵油精制过程中的脂肪酸组成分析
粗大鲵油在精制(脱胶、脱酸、脱臭)过程中脂肪酸组成及其相对含量变化如表3所示。粗大鲵油与精制过程中大鲵油脂肪酸组成基本相似,由此表明各项精制工艺对大鲵油脂肪酸组成影响较小。精制大鲵油中SFA含量为23.14%,以C16∶0为主(14.06%);MUFA含量为37.98%,以C18∶1(油酸)为主(30.52%);PUFA含量为36.78%,以C18∶2(亚油酸)为主(21.34%),其中EPA和DHA含量分别达3.57%和4.76%。
精制大鲵油中UFA 含量(74.76%)比草鱼油(61.08%)多13.68%, PUFA 含量(36.78%)比草鱼油(25.29%)多11.49%。精制大鲵油中 PUFAω-6型含量(24.37%)为草鱼油(18.88%)的1.3倍,且ω-6∶ω-3为1.96∶1,与美国专家推荐值2.3∶1接近[19]。精制大鲵油中AI(0.41)和TI(0.33)比草鱼油中AI(0.81)和TI(0.61)低,表明前者具有更高的脂肪酸不饱和度,能有效的抑制冠心病和血栓的形成[20]。此外,对人体极为重要的油酸及亚油酸,精制大鲵油中的含量明显高于草鱼油。由此可知,精制大鲵油的保健功能较草鱼油更为突出。
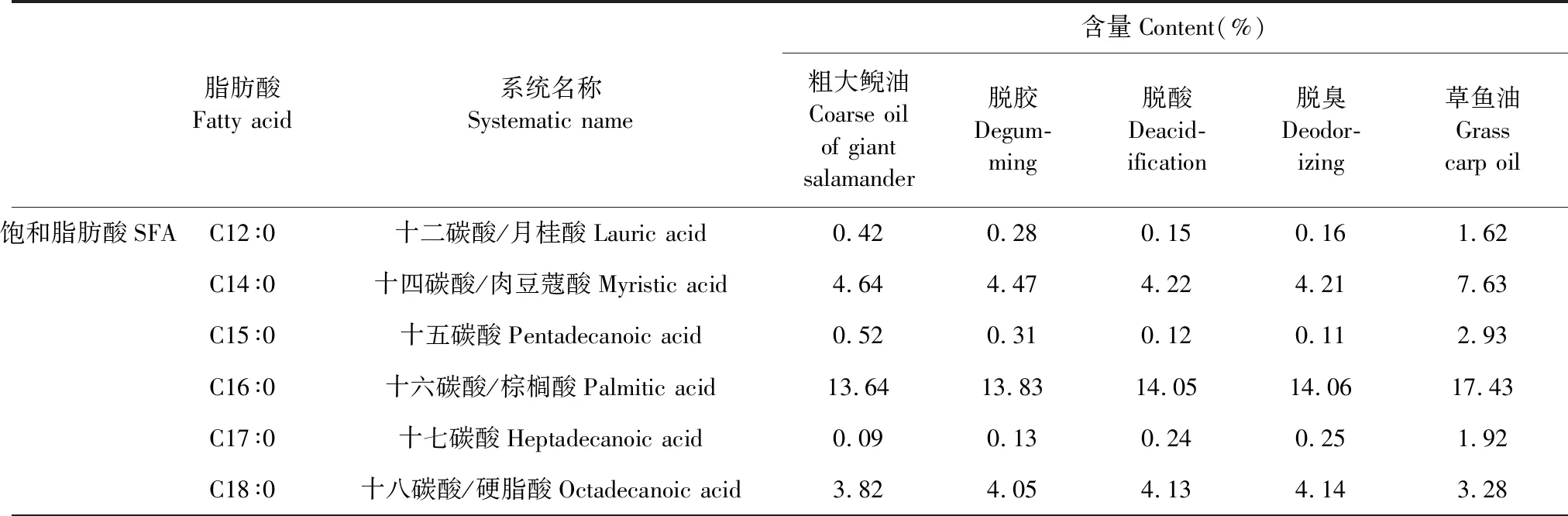
表3 粗大鲵油精制过程中脂肪酸组成变化及其与草鱼油组成间的差异Table 3 Composition changes of fatty acid in crude Andrias davidianusoil during refining process and their difference with grass carp oil
续表3(Continued Tab.3)
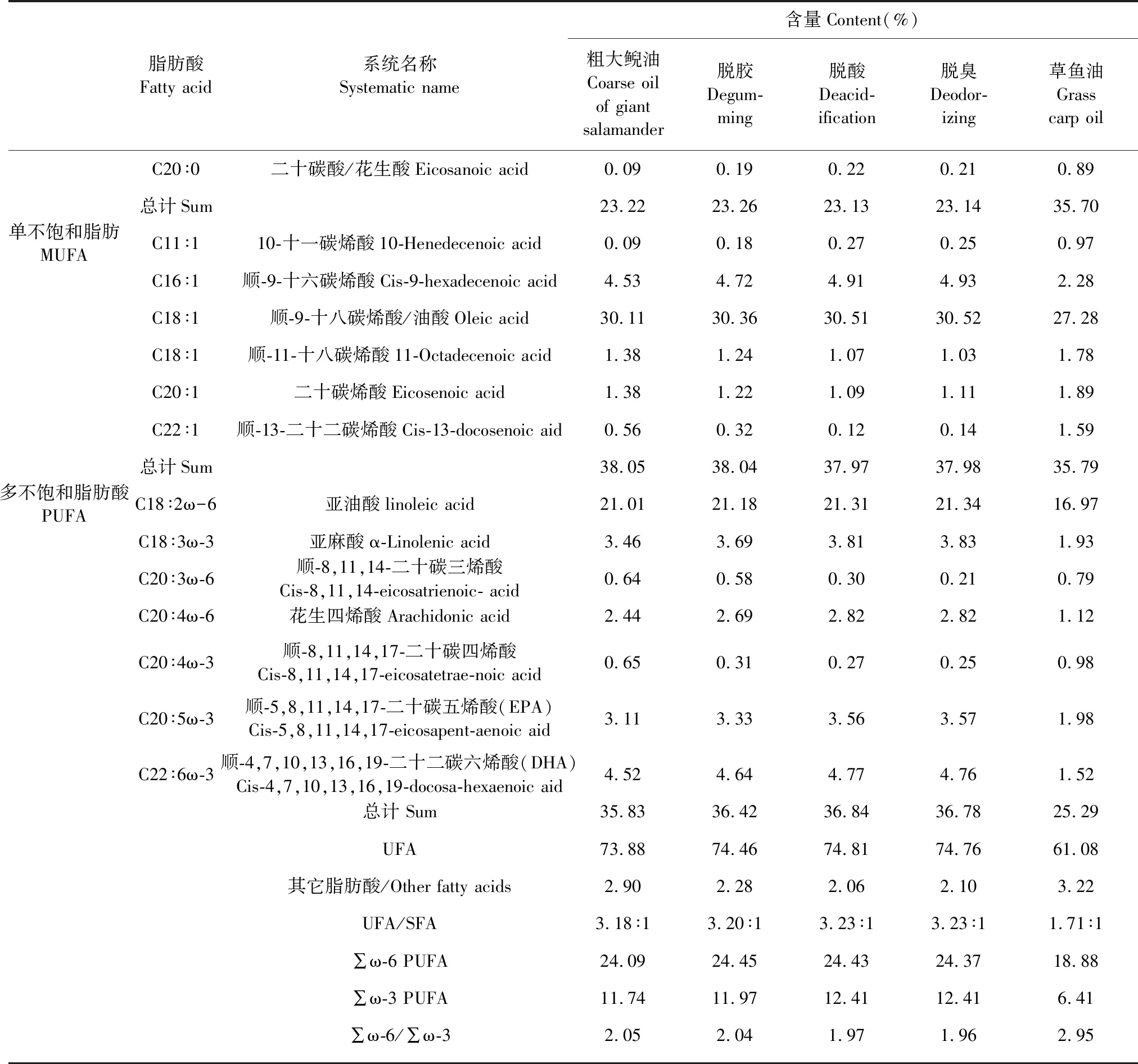
脂肪酸Fatty acid系统名称Systematic name含量Content(%)粗大鲵油Coarse oilof giant salamander脱胶Degum-ming脱酸Deacid-ification脱臭Deodor-izing草鱼油Grasscarp oilC20∶0二十碳酸/花生酸Eicosanoic acid0.090.190.220.210.89总计Sum23.2223.2623.1323.1435.70单不饱和脂肪MUFAC11∶110-十一碳烯酸10-Henedecenoic acid0.090.180.270.250.97C16∶1顺-9-十六碳烯酸Cis-9-hexadecenoic acid4.534.724.914.932.28C18∶1顺-9-十八碳烯酸/油酸Oleic acid30.1130.3630.5130.5227.28C18∶1顺-11-十八碳烯酸11-Octadecenoic acid1.381.241.071.031.78C20∶1二十碳烯酸Eicosenoic acid1.381.221.091.111.89C22∶1顺-13-二十二碳烯酸Cis-13-docosenoic aid0.560.320.120.141.59总计Sum38.0538.0437.9737.9835.79多不饱和脂肪酸PUFAC18∶2ω-6亚油酸linoleic acid21.0121.1821.3121.3416.97C18∶3ω-3亚麻酸α-Linolenic acid3.463.693.813.831.93C20∶3ω-6顺-8,11,14-二十碳三烯酸Cis-8,11,14-eicosatrienoic- acid0.640.580.300.210.79C20∶4ω-6花生四烯酸Arachidonic acid2.442.692.822.821.12C20∶4ω-3顺-8,11,14,17-二十碳四烯酸Cis-8,11,14,17-eicosatetrae-noic acid0.650.310.270.250.98C20∶5ω-3顺-5,8,11,14,17-二十碳五烯酸(EPA)Cis-5,8,11,14,17-eicosapent-aenoic aid3.113.333.563.571.98C22∶6ω-3顺-4,7,10,13,16,19-二十二碳六烯酸(DHA)Cis-4,7,10,13,16,19-docosa-hexaenoic aid4.524.644.774.761.52总计 Sum35.8336.4236.8436.7825.29UFA73.8874.4674.8174.7661.08其它脂肪酸/Other fatty acids2.902.282.062.103.22UFA/SFA3.18∶13.20∶13.23∶13.23∶11.71∶1∑ω-6 PUFA24.0924.4524.4324.3718.88∑ω-3 PUFA11.7411.9712.4112.416.41∑ω-6/∑ω-32.052.041.971.962.95
3 结论
本研究采用水酶法优化了大鲵油提取的最佳工艺:酶解温度60 ℃,pH6.5,酶添加量0.75%,时间90 min,在此条件下大鲵油的提取率达89.34%±1.00%。粗制大鲵油达到SC/T3502-2016粗鱼油二级标准。粗大鲵油精制过程中,脂肪酸组成变化较小,精制后的大鲵油中UFA和必须脂肪酸(EFA)相对含量分别达74.76%和25.17%,均高于精制草鱼油。本研究确定了水酶法提取大鲵油的最佳工艺条件,初步掌握了大鲵油脂肪酸组成,为大鲵油的开发利用提供了理论依据。然而,对大鲵油中各MUFA和PUFA的定量分析及其分离提取有待开展进一步研究。

