1 934例围产期妇女B族链球菌感染情况及耐药性分析Δ
丁毅伟,李艳君,孙 影,丁赔赔,王娇贤,董 蓉
(1.中国人民解放军总医院第六医学中心检验科,北京100048; 2.北京大学肿瘤医院检验科,北京 100142)
B族链球菌(groupBstreptococcus,GBS)是β-溶血性革兰阳性球菌,主要寄生于产妇的生殖道,是围产期妇女和新生儿感染的主要致病菌。围产期妇女感染会导致胎膜早破、早产、流产及胎儿感染等一系列妊娠并发症;分娩时,新生儿易被定植于母体生殖道内的GBS感染,引起肺炎、脑膜炎及败血症等疾病,甚至引起新生儿死亡[1]。在美国和欧洲等发达国家,感染GBS的围产期妇女和早期新生儿逐年增加。因此,中国人民解放军总医院第六医学中心(以下简称“我院”)作为全军计划生育中心,针对GBS感染进行早期、及时、有效的治疗,显得尤为重要。本研究回顾性分析了近年来我院围产期妇女GBS的感染率、相关流行病学因素及耐药性监测,以期为预防和及时治疗围产期妇女、新生儿GBS感染提供参考。
1 资料与方法
1.1 资料来源
选取2017年5月至2018年4月我院感染GBS的妊娠37周围产期妇女1 934例,在我院数字化病案库软件中查阅患者的基本信息,按年龄、临床诊断进行分组,对分离出的GBS进行药物敏感性试验。
1.2 仪器与试剂
VITEK2 compact全自动细菌分析仪(法国梅里埃公司);MALDI-TOF质谱仪(Microflex LT/SH、Bruker,德国布鲁克公司);B群链球菌显色平板(郑州安图生物有限公司),质控菌株为无乳链球菌ATCC12386。
1.3 方法
1.3.1 取材:取妊娠37周围产期妇女的阴道分泌物,首先拭去外阴过多的分泌物,在阴道下1/3处用1根无菌阴道棉拭子旋转1周取阴道分泌物,在30 min内送检。取材时无需外阴消毒,也无需阴道窥器。
1.3.2 细菌培养鉴定及药物敏感试验:按照《全国临床检验操作规程》(3版)进行微生物培养标准化操作,将临床送检的分泌物拭子接种于B群链球菌显色平板,于35 ℃、5%二氧化碳的孵箱中孵育;18~24 h后,选取粉红色菌落,采用质谱仪的MALDI-TOF技术进行鉴定,采用VITEK2 compact全自动细菌分析仪进行药物敏感试验。
1.4 统计学方法
采用WHONET 5.6软件进行GBS耐药性分析;采用SPSS 17.0统计学软件处理数据,计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 围产期妇女GBS检出情况
经细菌培养和鉴定,1 934例围产期妇女中共检出GBS阳性者140例,检出率为7.24%。
2.2 围产期妇女GBS流行病学调查情况
对140例GBS阳性的围产期妇女进行相关流行病学分析,其中,不同年龄(<35岁 vs.≥35岁)、有无妊娠先兆早产及有无双胎妊娠感染的围产期妇女GBS阳性率的差异均有统计学意义(P<0.05);有无其他围产期并发症的围产期妇女GBS阳性率的差异均无统计学意义(P>0.05),见表1。
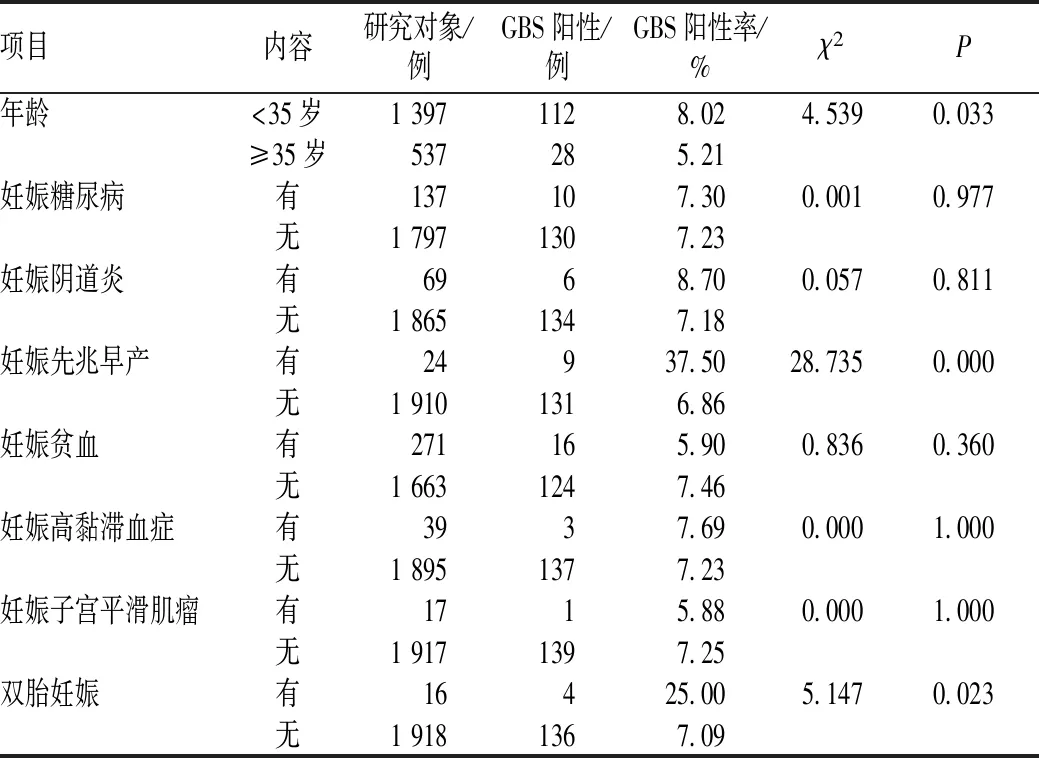
表1 围产期妇女GBS流行病学调查情况Tab 1 Epidemiological investigation of perinatal women with GBS
2.3 GBS对常用抗菌药物的药物敏感试验结果
药物敏感试验结果显示,140例围产期妇女检出的GBS对氨苄西林、青霉素、万古霉素、奎奴普汀-达福普汀、利奈唑胺、替加环素和替考拉宁的敏感率为100.00%;对头孢噻肟、头孢吡肟、呋喃妥因和氯霉素的敏感率较高,分别为85.71%、85.71%、80.65%和80.00%;对克林霉素、环丙沙星、左旋氧氟沙星、四环素和莫西沙星的耐药率较高,分别为72.93%、66.67%、60.31%、59.12%和50.09%,见表2。
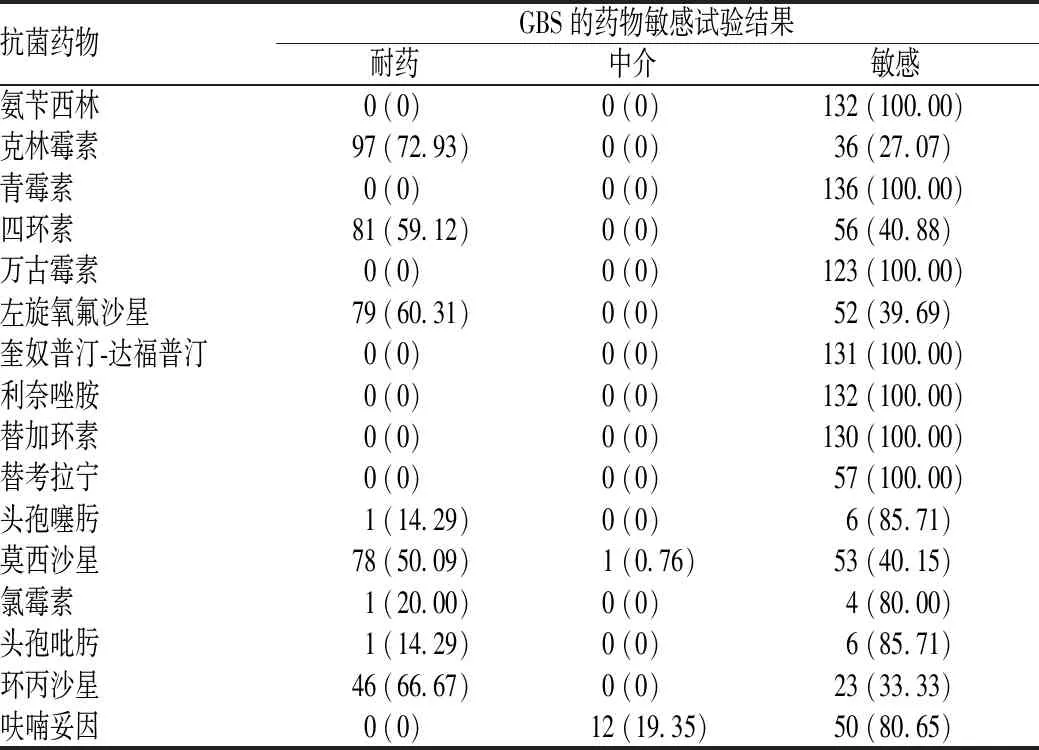
表2 140例围产期妇女检出的GBS对常用抗菌药物的药物敏感试验结果[例(%)]Tab 2 Results of drug sensitivity test of GBS detected from 140 perinatal women against common antibiotics[cases(%)]
3 讨论
目前,GBS几乎成为围产期妇女感染的主要致病菌[2],生殖道感染一般最为常见,如子宫内膜炎、败血症及绒毛膜羊膜炎等严重感染性疾病,可导致胎儿发育不良、流产及早产等妊娠并发症,严重者会引起胎儿死亡;GBS感染血清型以Ⅴ型更为多见[3]。
2017年5月至2018年4月,我院在1 934例围产期妇女中共检出140例GBS阳性者,GBS阳性率为7.24%,明显低于与发达国家的18%~27%[4],但阳性率>5%,作为围产期妇女GBS感染的常规筛查很有意义[5]。同时,除了我国与发达国家的GBS阳性率不同外,我国各省市对GBS阳性率的报道也有所不同,上海地区的GBS检出率为3.8%,而北京地区较高,为8.1%[6],可能与取样次数、取样时间、分娩方式、临床抗菌药物治疗及菌落生长密集程度等密切相关。我院妊娠先兆早产的围产期妇女GBS阳性率为37.50%,明显高于无妊娠先兆早产者,差异有统计学意义(P<0.05)。有研究结果显示,GBS通过对绒毛膜的强有力吸附和穿透,可直接侵袭胎膜,引起绒毛膜羊膜炎、宫内感染;另外,GBS能通过自身蛋白水解酶的侵袭作用,躲避炎性细胞的吞噬,从而使胎膜张力降低,引起早产、胎膜早破等并发症,导致新生儿感染[7]。<35岁围产期妇女的GBS阳性率为8.02%,明显高于≥35岁者,差异有统计学意义(P<0.05)。可能是由于<35岁者性生活较频繁,进行人工流产的概率较高,或者与妊娠期女性雌激素水平较高等因素有关,改变了生殖道细菌的微环境,易于生殖道中GBS的生存和繁殖[8]。本研究结果发现,双胎妊娠的围产期妇女GBS阳性率为25.00%,非双胎妊娠者为7.09%,两者的差异有统计学意义(P<0.05)。双胎感染率极高有可能与母体内激素水平有关,影响了子宫内环境,易于GBS的繁殖。本研究结果还显示,有、无妊娠糖尿病的围产期妇女GBS阳性率的差异无统计学意义(P>0.05)。但葡萄糖不耐受是GBS感染的危险因素[9],本研究中有妊娠糖尿病的围产期妇女GBS阳性率为7.30%,也应引起相应重视。有妊娠阴道炎的围产期妇女GBS阳性率为8.70%。考虑可能与GBS抑制乳酸杆菌生长有关,破坏了生殖道酸性环境,使pH升高而感染细菌或真菌,继而发生阴道炎[10]。有、无妊娠贫血的围产期妇女GBS阳性率的差异无统计学意义(P>0.05)。
对140例围产期妇女检出的GBS进行药物敏感试验,结果显示,GBS对氨苄西林、青霉素、万古霉素、奎奴普汀-达福普汀、利奈唑胺、替加环素和替考拉宁的敏感率为100.00%;对头孢噻肟、头孢吡肟、呋喃妥因和氯霉素的敏感率较高,分别为85.71%、85.71%、80.65%和80.00%;对克林霉素、环丙沙星、左旋氧氟沙星、四环素和莫西沙星的耐药率较高,分别为72.93%、66.67%、60.31%、59.12%和50.09%。2010年,美国疾病控制与预防中心推荐将青霉素作为非青霉素过敏妊娠期妇女及新生儿GBS感染的首选药物,对青霉素过敏者可以使用红霉素和克林霉素[11-12]。国内外也有应用氨苄西林治疗GBS感染患儿的情况。临床治疗妊娠期妇女支原体感染的生殖道疾病,多用红霉素等大环内酯类抗菌药物,但细菌对其耐药率逐年升高,耐药机制可能与ermB基因的表达有关[13];因此,有研究建议红霉素不宜作为GBS感染的首选药物[14]。2017年,英国皇家妇产科学院发布的最新指南建议,随着抗菌药物的滥用,GBS的耐药率呈现逐年升高趋势,克林霉素不应再用于GBS的预防与治疗[15]。因此,GBS感染可使用的首选抗菌药物为青霉素。虽然GBS对利奈唑胺和万古霉素的敏感率为100%,但是临床研究结果显示,万古霉素对新生儿有一定的副作用,可导致新生儿耳聋和肾损伤,不适用于对妊娠期、围产期妇女和婴儿进行治疗。利奈唑胺是新型抗菌药物,具有很好的安全性及耐受性,2002年已被批准应用于新生儿,可以作为危急症状的用药。头孢噻肟和头孢吡肟为第3代头孢菌素,在抗菌药物选择压力下易出现GBS的耐药株,故不作为一线用药。虽然GBS对氯霉素的敏感率能达到80%,但氯霉素会导致灰婴综合征,妊娠期妇女不适合使用。四环素可导致胎儿牙齿变色,抑制胎儿骨骼发育等,妊娠期妇女禁用。目前,青霉素是围产期妇女GBS感染治疗的首选药物[16]。为防止发生细菌耐药性扩散及交叉耐药,不仅要监测GBS对β-内酰胺类抗菌药物的耐药性,也应关注GBS对其他类抗菌药物的耐药性。
综上所述,围产期妇女GBS感染率不低,为预防围产期妇女以及新生儿的感染,筛查GBS显得尤为关键。同时,应加强预防策略,如产时抗菌药物预防(intrapartum antibiotic prophylaxis,IAP)和疫苗的研发[17]。近年来,分子诊断聚合酶链反应筛查和IAP逐渐发展,加强了对免疫因子和GBS菌株等因素对胎儿出生结局作用的理解,并将这些信息与GBS的定植和种群结构相结合,逐渐提高了对潜在疫苗覆盖率和分子诊断目标的认识。一些分子诊断工具正在成为更快速识别GBS感染性疾病或潜在患者的候选工具,包括Minlon、环介导的等温扩增技术等。最近,全基因组测序(whole-genome sequencing,WGS)已被用于GBS定植因素的研究,提供了血清型之外的研究方向。WGS可用于识别抗菌药物耐药基因,这些基因可能是未来抗菌药物过敏筛选试验的有用靶点,有利于更好地选择IAP[18]。GBS疫苗的研发也显得尤为重要,其可对妊娠期妇女起到预防作用,降低胎儿宫内感染的风险。随着抗菌药物的广泛使用,应重视对GBS的筛检、耐药性分析,必要时要结合临床增加药物敏感试验。应综合分析特殊群体的情况,谨慎使用抗菌药物,尽早对分离的GBS进行药物敏感试验,为临床提供用药依据,更有效地预防和治疗GBS感染。

